肺多发结节囊性病变罕见原因结节性硬化症1例
王 平,徐作军,徐凯峰
(中国医学科学院 北京协和医学院 北京协和医院 呼吸与危重症医学科 疑难重症及罕见病国家重点实验室, 北京 100730)
结节性硬化症(tuberous sclerosis complex,TSC)是一种罕见常染色体显性遗传病,由TSC1或TSC2功能缺失性突变引起[1],以多系统错构瘤和发育不良病变为特征。但不同个体间表型差异很大,不到1/3患者出现癫痫、精神发育迟滞和面部血管纤维瘤典型诊断三联征或具有家族史[2-3],因而极易误诊和漏诊。TSC肺部受累可表现为弥漫囊状影,也可出现多发小结节影,但两者同时出现少见,临床发生率尚不清楚。另一方面,肺多发囊状影或多发小结节影可见于多种肺部疾病,不具有特异性。因此本文通过报道1例以双肺多发小结节和散在囊状影为首发表现的TSC患者,以提高对肺内多发结节囊性病变罕见原因的鉴别诊断能力和对TSC非典型表现的认识。
1 临床资料
1.1 病史及体格检查
患者,女,49岁,主因“发现肺部弥漫结节及囊性改变1年”入院。患者1年前体检行胸部CT(computed temography)检查发现两肺呈弥漫磨玻璃样,多发小囊状影和小结节影,无不适症状,未进一步诊治。1月前复查胸CT:两肺弥漫磨玻璃密度小结节,两肺弥漫性磨玻璃影并多发肺大泡,左心室见低密度灶,双肾多发结节占位, 肝囊肿,肝左叶低密度灶,双侧锁骨、肋骨、多个椎体内高密度结节;查抗可溶性核抗原抗体:抗SSA(Sjögren syndrome A)抗体、抗Ro-52阳性; 电子支气管镜镜下未见异常,支气管肺泡灌洗液(bronchoalveolar lavage fluid,BALF)细菌及分枝杆菌涂片和培养阴性、未找到异型细胞;腹腔B超:双肾囊肿、肝左叶血管瘤可能;心脏超声:心尖部条索样强回声,考虑肌束钙化,为进一步诊治收入北京协和医院呼吸科病房。患病以来,患者无口眼干症状,睡眠饮食好,二便无异常,体重无变化。既往:2000年因子宫内膜异位症行子宫全切术;2005年因一过性下肢麻木诊断先天性脊柱栓系,隐性脊柱裂,骶骨内囊肿;2014年诊断高血压病。个人史、家族史、月经婚育史无殊。入院体检:心肺腹未查及异常体征,四肢及躯干皮肤可见散在小点片状色素脱失斑(图1)。

图1 患者皮肤色素脱失斑Fig 1 Numerous hypopigmented macules on the skin of the patient
1.2 实验室检查
血常规、肝肾功、尿常规、便常规正常;血沉、C-反应蛋白、免疫球蛋白G、免疫球蛋白M、免疫球蛋白A、血轻链KAP+轻链LAM、血清蛋白电泳、血免疫固定电泳均正常;抗核抗体谱:抗Ro 52抗体强阳性、抗SSA抗体阳性,抗中性粒细胞胞质抗体阴性;血糖链抗原199:39 U/mL、糖链抗原242:25 U/mL、甲胎蛋白正常;查胸腹盆增强CT:双肺多发磨玻璃密度小结节影及散在囊状低密度影,双肺弥漫磨玻璃影(图2A,B);左心室心尖区小圆形脂性低密度灶(图2C);肝内多发小低密度灶,双肾多发结节占位,形态、分布、密度及强化方式各异(图2D);胸椎、腰椎、骶椎、髂骨、肋骨、胸骨、锁骨多发点状高密度影(图2E);超声心动图:左室心尖部可疑团块影;头常规磁共振成像(magnetic resonance imaging,MRI)平扫未见明显异常;腰椎MRI示脊髓栓系可能,诸腰椎信号不均,多发斑点、小结节状异常信号,骶管囊肿;正电子发射计算机断层显像(positive emission computed tomography,PET):双肺多发小结节、囊性病变,心脏多发混杂密度影,肝内散在小结节,均未见异常代谢增高;双肾多发结节,最大标准摄取值16.7,伴或不伴代谢增高(图2F),全身多发成骨病灶,放射性分布欠均匀,以上病变均不除外恶性病变;头颅MRI未见异常;眼科检查存在干眼症,口腔科检查口腔唾液流率、腮腺造影正常, 唇腺活检病理:间质及导管周可见散在淋巴细胞浸润,未见明确淋巴细胞灶;气管镜镜下未见异常,BALF细胞分类: 细胞总数 15.4×106个,吞噬细胞 96%,淋巴细胞 3%,嗜中性粒细胞 1%,嗜酸性白细胞 0%,BALF细菌、真菌、分枝杆菌涂片及培养均阴性。行肾高代谢结节经皮穿刺活检,组织病理示血管平滑肌脂肪瘤(angiomyolipoma, AML)。再次对患者进行详细查体但未见血管纤维瘤、鲨鱼革斑、前额棕色纤维斑和甲周纤维瘤等体征。外周血全外显子测序发现患者TSC2外显子区存在一杂合缺失突变(c.1283_1285delCCT),导致氨基酸改变(p.S248del)。血血管内皮生长因子D:1 532 ng/mL。本研究通过北京协和医院伦理委员会批准(批准号JS-1323),患者签署相关知情同意书。
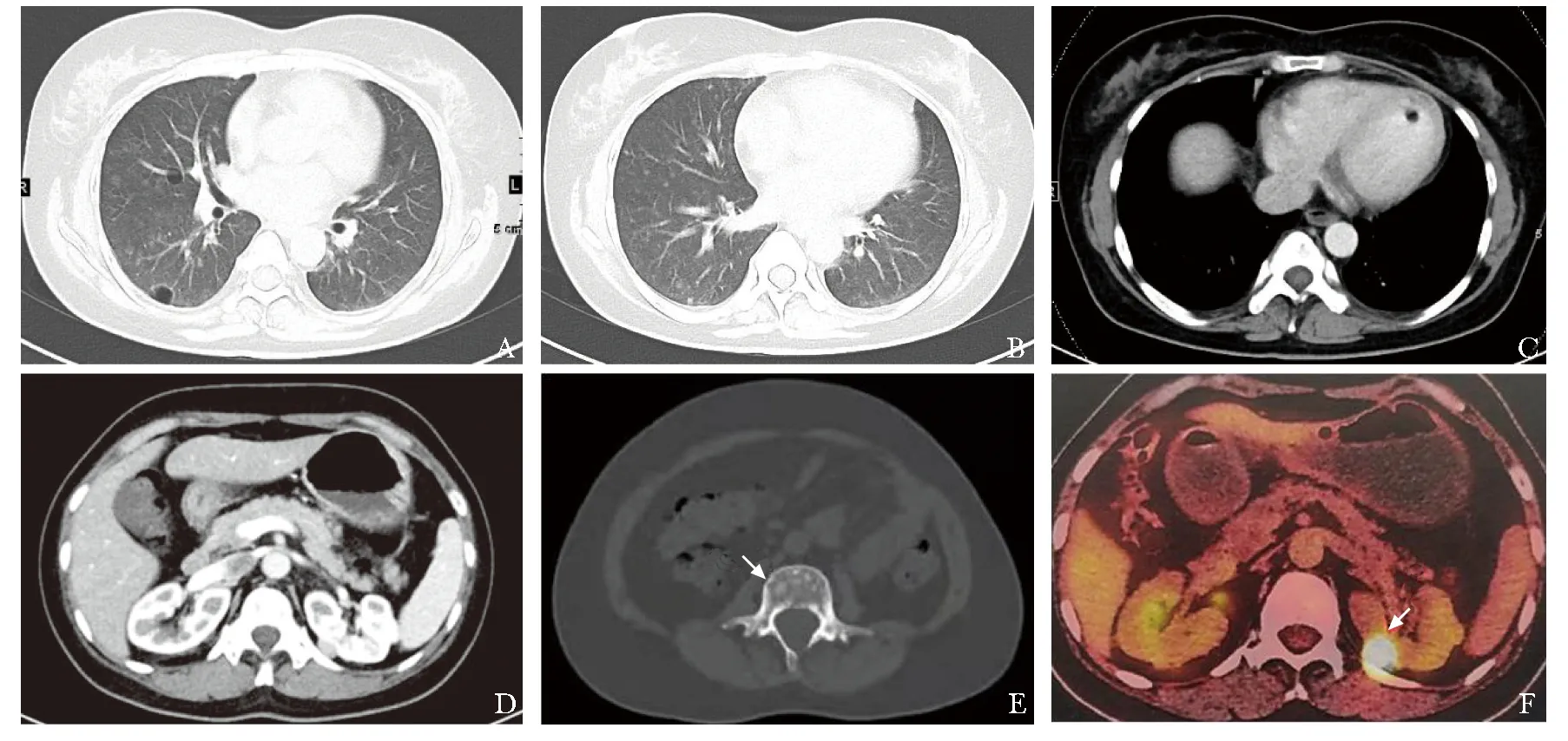
A,B.chest and abdominal enhanced CT showed: multiple thin-walled cysts, diffuse ground glass opacity nodules, and patchy ground glass opacities in lung window; C.small round fatty low-density focus at the apex of left ventricle in mediastinal window;D.multiple masses in both kidneys;E.multiple high-density foci in vertebrae in bone window indicated by the arrow;F.positron emission computed tomography(PET-CT) showed multiple high metabolic masses in both kidneys indicated by the arrow
1.3 诊断、治疗及转归
根据TSC诊断标准[4],患者符合两条主要标准:1)皮肤色素脱失斑(≥3);2)肾血管平滑肌脂肪瘤(≥3),且具有致病性TSC2突变,可明确诊断为TSC。予西罗莫司片1 mg/d口服。治疗1年后复查双肺弥漫结节及磨玻璃影较前减少缩小(图3A,B),双肺囊状影、双肾错构瘤、心脏和骨病灶稳定。

Chest CT at one year after treatment (A and B) showed reduction in ground glass opacity nodules and ground glass opacities, but no change in cysts
2 讨论
肺多发结节和囊性病变的常见病因包括肺朗格罕组织细胞增生症、恶性肿瘤肺转移、干燥综合征、淀粉样变、慢性过敏性肺炎等。该患者虽然有干燥综合征相关抗体阳性,但仅有干眼症,无口干燥症,唇腺活检阴性,不能诊断干燥综合征。正电子发射计算机断层显像结果提示恶性病变,然而最终组织病理结果提示了以多系统错构瘤形成为特征的罕见系统性疾病TSC的可能性。该患者无家族史和TSC诊断三联征,肺部影像无特征性,肾脏占位因为影像上缺乏脂肪密度易与肾脏恶性肿瘤混淆,极具迷惑性。
1%~3%的TSC患者出现肺淋巴管肌瘤病(ly-mphangioleiomyomatosis, LAM)。胸CT特征表现为双肺弥漫分布均一薄壁圆形囊样影,但也可出现数个(≤10个)散在分布大小不一薄壁囊状影不典型表现[5],测定血血管内皮生长因子D有助于LAM诊断。肺内多发小结节影是TSC另一少见肺部表现,组织病理为肺泡II型上皮细胞结节状增殖[6],又称为多灶性小结节型肺泡细胞增生(multifocal micronodular pneumocyte hyperplasia, MMPH)。约90%TSC患者存在中枢神经系统病变,但本例患者并未出现。约80%以上患者在20岁前出现肾AML,肾占位中含有脂肪密度有助于与其他肾脏肿瘤鉴别,然而乏脂肪AML也并不少见[7]。
TSC1或TSC2功能失活突变导致哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路异常活化从而导致细胞异常增殖是TSC发病分子基础[8]。对于AML≥3 cm、TSC继发LAM出现中重度通气功能障碍或进展较快者指南推荐应用哺乳动物雷帕霉素靶蛋白抑制剂治疗[9]。MMPH通常进展慢[10], 尚未见有mTOR蛋白抑制剂对MMPH治疗的报道,目前仅有1例报道mTOR治疗后肺内弥漫磨玻璃影小结节好转[11],本例患者也观察到相似的治疗反应。
成人多发囊性肺疾病和多结节肺病鉴别诊断应考虑TSC,深入认识TSC各系统典型及非典型表现对早诊断早治疗TSC至关重要。

