N端去糖基化修饰对三阴型乳腺癌中PD-L1蛋白表达的影响
马怡君,周彩婷,韩 微,王 磊,陈 勇,黄天宇
三阴型乳腺癌(triple-negative breast cancer, TNBC)是一种特殊类型的乳腺癌,目前,临床上免疫治疗为其优势治疗[1]。免疫治疗的开展以及对其治疗疗效的评估均需通过免疫组化检测程序性死亡配体1(programmed cell death 1 ligand 1, PD-L1)在癌细胞中的表达[2],但临床实践发现PD-L1在TNBC组织中的表达不佳,导致部分TNBC患者无法从免疫治疗中获益。临床最新研究发现[3],将肺恶性肿瘤组织进行去糖基化后再行PD-L1的免疫组化检测,发现肿瘤细胞阳性比例和免疫组化评分均升高且与免疫治疗的疗效呈正相关。因此,本实验将TNBC组织进行去糖基化处理后行PD-L1的免疫组化检测,发现其表达高于未处理的肿瘤组织,即在一定程度上减少了假阴性率,使得更多的TNBC患者受益,现介绍如下。
1 材料与方法
1.1 研究对象收集2019~2021年扬州大学附属医院存档的67例TNBC原发灶肿瘤组织和淋巴结转移肿瘤组织。其中免疫组化明确ER、PR、HER-2均阴性的判读标准:PR、ER阴性是指其免疫组化标记>10%肿瘤细胞阳性且Ki-67增殖指数﹤14%;HER-2阴性是指其免疫组化结果判读为(0)或(1+)[4]。原发灶肿瘤组织中有30例肿瘤直径≤2 cm,37例>2 cm;肿瘤分化程度:21例高分化,25例中分化,21例低分化;临床分期:13例Ⅰ期,31例Ⅱ期,23例Ⅲ期;35例为浸润性小叶癌,32例为浸润性导管癌;其中45例有淋巴结转移,22例无淋巴结转移;其中21例发生前哨淋巴结微转移(即淋巴结转移肿瘤组织直径>0.2 mm且≤2 mm[5]),24例发生宏转移(即淋巴结转移肿瘤组织直径>2 mm[5]);22例转移淋巴结直径≤1 cm,23例直径>1 cm;淋巴结转移肿瘤分化程度:24例为中分化,21例为低分化;临床分期:24例为Ⅱ期,21例为Ⅲ期;22例为浸润性小叶癌,23例为浸润性导管癌。
1.2 方法67例TNBC原发灶肿瘤组织及淋巴结转移肿瘤组织经10%中性福尔马林固定及梯度乙醇(75%~95%)脱水,组织包埋成蜡块后连续5 μm厚切片。免疫组化染色采用EnVision两步法,一抗PD-L1为兔单克隆抗体(上海艾博抗公司)。组织去糖基化处理步骤:首先将白片在40 ℃温箱中孵育过夜,然后在60 ℃温箱中孵育1 h后依次进行二甲苯脱蜡、乙醇脱水和蒸馏水水化,之后应用热变性方法,用PBS将切片洗涤3次后,在95 ℃下用1倍糖蛋白变性缓冲液孵育5 min,再用PBS洗涤3次,然后将5%重组肽-N糖苷酶F(PNGase F)(P0708,新英格兰生物实验室)溶解于糖基化缓冲液中,将切片在37 ℃下用此溶液洗涤1 h,后续步骤同上述常规免疫组化法。最后将行常规免疫组化染色者为常规组,去糖基化处理后行免疫组化染色者为去糖基化组,镜下观察PD-L1在两组肿瘤组织中的表达。
1.3 判读标准PD-L1阳性判定标准:(1)癌细胞胞膜和(或)胞质染色呈明显的黄棕色,且细胞着色率≥5%;(2)肿瘤间质为阳性时,也可判定为PD-L1阳性。PD-L1阴性判定标准:(1)癌细胞着色率不超过5%;(2)癌细胞不着色。计算细胞着色率的方法:在(400×)镜下计数3个视野的染色细胞数与总细胞数的比值,并计算均值[6]。
1.4 统计学分析采用SPSS 19.00软件进行统计学分析,例数采用百分率(%)表示,利用χ2检验进行数据分析,以P<0.05为差异有统计学意义。
2 结果
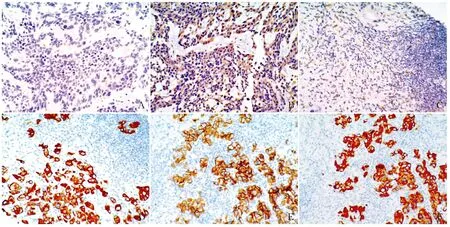
2.1 常规组与去糖基化组中PD-L1的表达67例TNBC原发灶肿瘤组织PD-L1免疫组化染色结果显示,常规组23例阴性(图1A),44例阳性,其中20例呈弱阳性,24例呈强阳性;去糖基化处理后23例阴性病例中10例阳性(图1B),20例弱阳性病例中12例强阳性;45例TNBC淋巴结转移肿瘤组织PD-L1免疫组化染色结果显示,常规组17例阴性(图1C),28例阳性,其中17例弱阳性,11例强阳性;去糖基化处理后17例阴性病例中7例阳性(图1D),17例弱阳性(图1E)病例中10例强阳性(图1F)。
ABCDEF
2.2 常规组与去糖基化组PD-L1表达与TNBC原发灶肿瘤组织临床病理特征的关系67例TNBC原发灶肿瘤组织PD-L1免疫组化染色结果显示,PD-L1在常规组与去糖基化组中的表达与肿瘤直径、分化程度、病理类型、临床分期以及淋巴结转移均无相关性(P>0.05),肿瘤组织去糖基化处理后,PD-L1在各临床分组中的阳性率均有所提高,增加5.7%~19.1%不等(表1)。
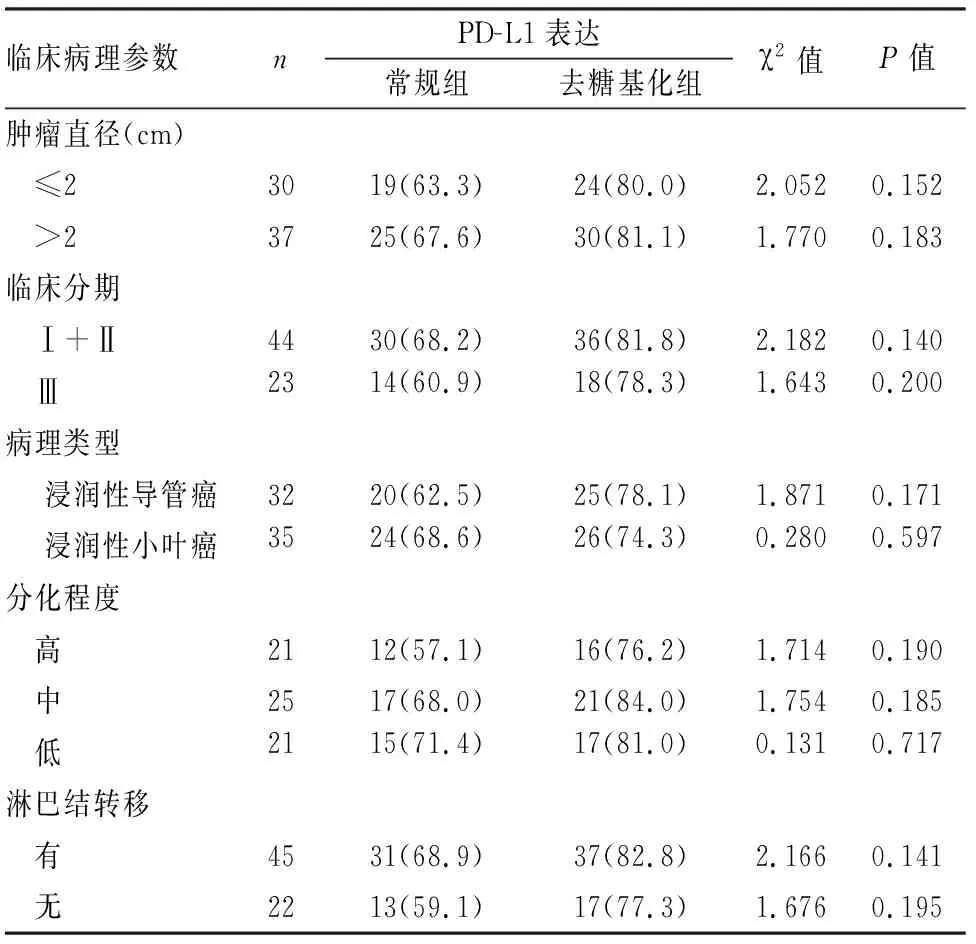
表1 常规组与去糖基化组PD-L1表达与TNBC临床病理特征的关系[n(%)]
2.3 常规组与去糖基化组PD-L1表达与TNBC淋巴结转移肿瘤组织临床病理特征的关系45例淋巴结转移肿瘤组织PD-L1免疫组化染色显示,PD-L1在常规组和去糖基化组中的表达与淋巴结直径、肿瘤分化程度、转移灶分类、临床分期、病理类型、分化程度均无相关性(P>0.05),但淋巴结转移肿瘤组织经去糖基化处理后,PD-L1在各临床分组中的阳性率均有所提高,增加幅度13.7%~21.7%不等(表2)。
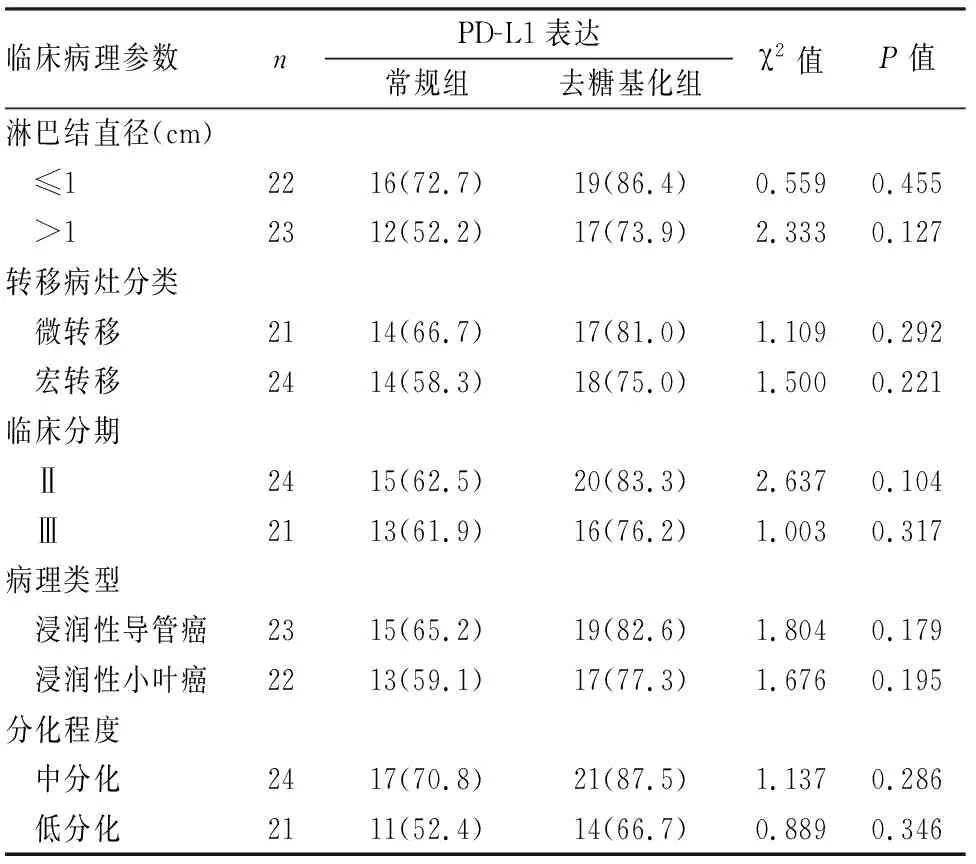
表2 常规组与去糖基化组PD-L1表达与TNBC淋巴结转移肿瘤组织临床病理特征的关系[n(%)]
3 讨论
TNBC是一种PR、ER和HER-2免疫组化检测均为阴性的乳腺癌[7]。目前乳腺癌术后临床通常以靶向治疗和内分泌治疗作为主要治疗方式[8],但由于TNBC细胞不仅分化差而且基因也不够稳定,导致患者术后不能采用上述两种临床常用治疗方式,并且TNBC比其他类型的乳腺癌更易发生复发和转移[9],所以临床迫切需要新的治疗方式。有研究发现,TNBC在激活免疫系统方面具有优势,这与其拥有较高的异质性和可以选择突变的基因位点相关,因此也拥有更好的抗原性,从而使免疫治疗成为目前TNBC临床术后的优势治疗。
现阶段有研究发现,对PD-L1阳性的TNBC患者进行免疫治疗后,获得较为满意的临床效果[10]。现临床多采用阿特丽珠单抗(atezolizumab)及帕博丽珠单抗(pembrolizumab)进行免疫治疗[11],其中有研究表明[12],PD-L1阳性TNBC患者如果能在早期使用帕博利珠单抗,可明显提高药物的反应率。并且在TNBC中PD-L1表达与其不良预后密切相关[13]。因此,越早实施免疫治疗越有利于患者预后。我们需要解决的是PD-L1在TNBC组织中的表达呈假阴性或不稳定性,让更多的患者满足免疫治疗条件,尽早开展治疗。
最近有实验首先提取乳腺癌中的相关细胞(BT549细胞、MB231细胞以及A431细胞),然后将多种糖基化相关抑制剂作用于上述细胞,最后证实PD-L1的糖基化修饰是N端糖基化[14]。N端糖基化作为一种生物合成分泌,是在高尔基体及内质网中进行的[15],一旦其发生失调,其蛋白质将立即被转运至内质网中降解[16]。肿瘤组织中PD-L1表达不佳[17]的原因是其能够影响PD-L1蛋白结合抗PD-L1抗体。但有研究将肺癌的肿瘤细胞进行肽-N-糖苷酶F(PNGase F)去糖基化处理后[3],发现其肿瘤细胞中的PD-L1表达信号明显增强,而且其PD-L1的表达水平与包括帕博丽珠单抗和阿特丽珠单抗在内的免疫治疗疗效呈明显正相关性。
本实验发现,对进行去糖基化处理的TNBC原发灶肿瘤组织及其淋巴结转移肿瘤组织进行PD-L1免疫组化染色,原发灶肿瘤组织中PD-L1的阳性率由65.6%提高至80.5%,强阳性率由35.8%提高至53.7%,淋巴结转移肿瘤组织中PD-L1的阳性率由66.2%提高至77.8%,强阳性率由24.4%提高至46.6%,这表明经去糖基化处理后,PD-L1的免疫组化阳性率不仅在原发灶肿瘤组织中明显增强,在淋巴结转移肿瘤组织中也明显增强。这也说明将组织进行去糖基化处理后再进行免疫组化染色的方式不仅适用于原发肿瘤组织,也适用于淋巴结转移肿瘤组织。虽然差异无统计学意义,但有部分PD-L1阴性的TNBC患者确实能够通过这种方式满足免疫治疗的条件而获益。
综上,本实验对TNBC肿瘤组织进行去糖基化处理后,不仅可以提高TNBC组织中PD-L1的表达,让更多的TNBC患者符合免疫治疗条件,而且可以更好地预测免疫治疗的临床疗效。这无疑给更多的TNBC患者带来更多临床治疗的可能性。所以,对TNBC患者进行PD-L1免疫组化检查前,应推广使用去糖基化处理肿瘤组织的方法,以提高PD-L1的阳性率。后期我们将继续扩大样本量或者改良去糖基化方法来进一步完善临床研究。

