乳腺癌微环境中浸润中性粒细胞与淋巴细胞的比值对预后的意义
程岚卿,汪树静,盛有璟,江冬瑞,吴 强,
乳腺癌是女性癌症死亡的主要原因之一[1]。尽管其治疗水平不断改善,但仍有约20%的患者出现肿瘤复发和转移[2],至今无可靠预后指标。因此,寻求特异性、可靠性、易获得性的乳腺癌预后指标尤为重要。外周血中性粒细胞与淋巴细胞比值(peripheral neutrophil-to-lymphocyte ratio, pNLR)与多种恶性肿瘤的不良预后密切相关[3]。但其数值极易受炎症、神经内分泌压力等非肿瘤因素的影响[4],因此,将pNLR作为预测乳腺癌患者预后的指标尚存在缺陷和争议。
宿主抗肿瘤免疫反应主要是由局部免疫细胞驱动,肿瘤原位浸润的免疫细胞含量相对稳定。本实验对乳腺癌组织中CD66b+肿瘤浸润中性粒细胞(tumor infiltrating neutrophils, TINs)和CD8+肿瘤浸润淋巴细胞(tumor infiltrating lymphocytes, TILs)进行观察,分析两者及其比值(tumor infiltrating neutrophil-to-lymphocyte ratio, iNLR)在乳腺癌中的预后价值及临床病理意义。
1 材料与方法
1.1 临床资料收集2016~2018年安徽医科大学第二附属医院存档的改良根治术切除并经病理检查确诊为非特殊型浸润性乳腺癌组织112例,患者均为女性,年龄29~69岁,中位年龄50岁。所有患者术前均未行新辅助化疗且诊断标准依照WHO(2019)乳腺肿瘤指南及第八版AJCC TNM分期。通过电话及查阅诊疗记录进行随访,将手术时间作为随访起始时间,随访截至2021年1月。无进展生存期(progression-free survival, PFS)定义为手术至患者出现复发、转移或随访截止时间。
1.2 试剂鼠抗人CD66b单克隆抗体(G10F5,BD Pharmingen公司,浓度0.5 mg/mL,稀释比1 ∶75);即用型兔抗人CD8单克隆抗体(SP16,福州迈新公司);双染检测试剂盒(DS-003,抗小鼠IgG/HRP+抗兔IgG/AP)及GVA封片剂均购自北京中杉金桥公司。
1.3 双重免疫组化所有标本均经10%中性福尔马林固定、石蜡包埋,4 μm厚连续切片,行免疫组化染色。免疫组化采用EnVison两步法双重染色,操作步骤严格按试剂盒说明书进行。简要步骤为切片脱蜡至水,抗原修复后滴加过氧化物酶阻断剂,混合一抗4 ℃孵育过夜,混合二抗室温孵育30 min,DAB及Fast-Red分别进行显色,苏木精复染,快速脱水、透明、封固,镜下观察。
1.4 结果判读CD66b阳性染色为细胞质和(或)细胞膜呈棕黄色[5]。CD8阳性染色为细胞膜呈玫红色。分别计数10个高倍镜视野乳腺癌癌巢中浸润的CD66b+TINs和CD8+TILs,排除坏死组织、血管中染色阳性细胞及非特异性染色。以112例CD66b+TINs和CD8+TILs密度的中位数作为标准,将浸润免疫细胞分为高密度组和低密度组。所有结果均由两位病理科医师独立判读。
1.5 统计学分析采用Graphpad(Prism 8.0)软件进行统计学分析,χ2检验或Fisher精确检验进行样本率之间的比较,Kaplan-Meier检验进行生存分析,ROC曲线分析预测价值,Cox比例风险回归模型进行单因素和多因素生存分析。以P<0.05为差异有统计学意义。
2 结果
2.1 乳腺癌中CD66b+TINs和CD8+TILs浸润情况在乳腺癌癌巢中可见CD66b+TINs和CD8+TILs浸润,CD66b+TINs的浸润密度为0~286个/10 HPF,中位密度为6个/10 HPF;CD8+TILs的浸润密度为2~456个/10 HPF,中位密度为56个/10 HPF。计算得出,iNLR的数值为0~48.50,中位数为0.12(图1)。
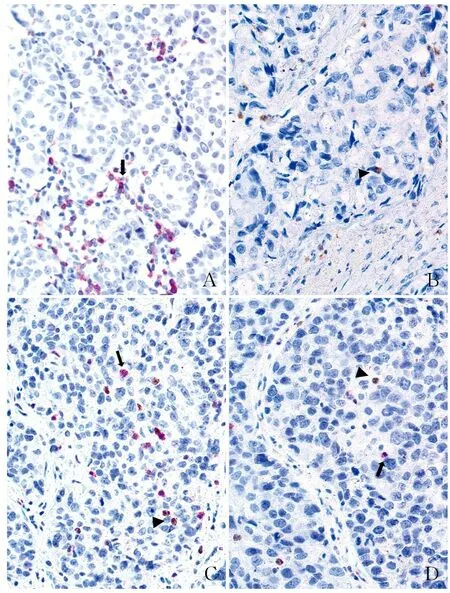
ABCD
2.2 CD66b+TINs密度、CD8+TILs密度和iNLR对乳腺癌患者PFS的预测价值分析Kaplan-Meier生存分析显示,高密度CD66b+TINs和iNLR与患者PFS均呈负相关(P<0.05,图2),高密度CD8+TILs与患者PFS呈正相关(P<0.05,图2)。ROC曲线分析结果显示,CD66b+TINs、CD8+TILs及iNLR对乳腺癌患者PFS预测的ROC曲线下面积值分别为0.717、0.730和0.786(P<0.05,图3)。

图2 乳腺癌中CD66b+TINs密度、CD8+TILs密度及iNLR与患者预后的关系:A.CD66b+TINs密度与患者PFS的关系;B.CD8+TILs密度与患者PFS的关系;C.iNLR与患者PFS的关系

图3 预测乳腺癌PFS的ROC曲线:A.CD66b+TINs密度的ROC曲线;B.CD8+TILs密度的ROC曲线;C.iNLR的ROC曲线
2.3 iNLR、CD66b+TINs密度、CD8+TILs密度与乳腺癌临床病理特征的相关性iNLR与组织学分级、淋巴结转移和Ki-67增殖指数呈正相关(P<0.05),与ER、PR表达呈负相关(P<0.05,表1)。CD66b+TINs密度与组织学分级呈正相关(P<0.05,表1)。CD8+TILs密度与淋巴结转移、组织学分级呈负相关(P<0.05,表1)。

表1 乳腺癌中iNLR、CD66b+TINs密度及CD8+TILs密度与临床病理特征的关系
2.4 生存分析Cox单因素分析发现,高iNLR和低密度CD8+TILs与乳腺癌患者PFS相关(P<0.05,表2)。将单因素分析有关指标纳入多因素分析,结果显示,iNLR是影响乳腺癌患者PFS的独立危险因素(HR=2.446,P<0.05,表2)。

表2 乳腺癌患者PFS的Cox单因素和多因素分析
2.5 CD66b+TINs密度和iNLR与乳腺癌分子分型的相关性乳腺癌的四种分子分型中,iNLR占比差异有统计学意义,三阴型乳腺癌(78.3%)中高iNLR病例明显多于非三阴型乳腺癌(42.7%)(P<0.05,表3)。CD66b+TINs密度与乳腺癌分子分型无明显相关性(P>0.05,表3)。

表3 iNLR和CD66b+TINs密度与乳腺癌分子分型之间的相关性
3 讨论
肿瘤微环境(tumor microenvironment, TME)由肿瘤细胞、基质细胞和免疫细胞组成,近年来在癌症进展中的作用逐渐受到重视。乳腺癌TME中存在丰富的免疫细胞,它们是肿瘤进展和免疫治疗反应的关键参与者[6-7]。中性粒细胞和淋巴细胞是血液循环白细胞的主要成分和TME中免疫细胞的主要来源,在机体全身免疫反应中起关键作用,影响肿瘤的进展[8-9]。研究报道两者的比值可以预测患者的预后,但多集中于外周血中的免疫细胞比值,即pNLR。pNLR是代表肿瘤炎症反应的指标,在一定程度上可代表肿瘤负荷[10],Guo等[11]分析了pNLR对乳腺癌患者的预后意义,发现pNLR是乳腺癌总生存率的预测指标。而另一项研究发现老年乳腺癌患者中的pNLR与总生存期和PFS无相关性[12]。这些研究提示pNLR对乳腺癌的预后价值尚存在争议。
免疫细胞对肿瘤进展的影响主要在肿瘤微环境中实现,即浸润肿瘤组织内的免疫细胞。TME中的各种免疫细胞发挥的作用不同,且相互作用过程复杂,因此,探索肿瘤组织中的iNLR可以更直接的反应局部肿瘤细胞与免疫细胞的相互作用。Ilie等[13]评估了非小细胞肺癌的iNLR对预后影响,发现其是高复发率和低生存率的独立预后因素。另一项研究发现,iNLR升高与肝细胞癌切除术后无瘤生存期和总生存期降低显著相关[14]。但乳腺癌iNLR对预后的影响尚未见报道。本实验利用双重免疫组化法检测乳腺癌组织中浸润的CD66b+TINs、CD8+TILs,分析了iNLR的预后价值。结果显示,iNLR与乳腺癌患者的PFS呈负相关,ROC曲线显示iNLR预测预后的准确性为0.786,进一步分析发现,iNLR与组织学分级、淋巴结转移和Ki-67增殖指数呈正相关,Cox分析发现iNLR是乳腺癌PFS的独立预后因子。
本实验分析了CD66b+TINs和CD8+TILs与乳腺癌患者预后的相关性。越来越多的证据表明,中性粒细胞在癌症的反应中起着重要的作用。在胃癌中,中性粒细胞激活并表达PD-L1,与胃癌预后呈负相关[15]。在小鼠乳腺癌模型中,CD66b+TINs及M2型巨噬细胞的浸润促进乳腺癌细胞基质金属蛋白酶9高表达[16],可加速肿瘤的恶性进程[17]。本实验结果表明,高密度CD66b+TINs与乳腺癌PFS呈负相关,与组织学分级呈正相关。CD8+TILs是抗肿瘤免疫效应机制之一,具有杀伤肿瘤细胞和细胞内病原体等细胞毒性能力,在诱导机体抗肿瘤反应中发挥重要作用[18]。Mahmoud等[19]分析1 334例乳腺癌中CD8+TILs的临床意义,发现CD8+TILs与总生存期呈正相关。与之前研究结果一致,我们发现CD8+TILs密度较低的患者,预后较差。随后,本实验通过ROC曲线分析发现,iNLR的曲线下面积值为0.786,而CD66b+TINs和CD8+TILs的曲线下面积值分别为0.717和0.730,表明iNLR预测乳腺癌预后的准确性更高,能够更好的预测乳腺癌患者预后并指导临床治疗。
国际免疫肿瘤生物标志物工作组的研究发现,浸润到肿瘤实质的免疫细胞在HE染色观察中易被忽略[20]。与免疫组化单染相比,免疫组化双染对观察两种类型蛋白质的表达更具有优势并且可广泛应用于临床研究,表明使用免疫组化双重染色评估iNLR预测乳腺癌进展可以更容易地应用于临床实践。
综上所述,iNLR是影响乳腺癌患者PFS的独立危险因素,其预测乳腺癌预后的准确性优于单独计数CD66b+TINs或CD8+TILs。iNLR是一种新颖的、可靠的临床应用指标,可作为临床评估乳腺癌患者预后的潜在预测指标。

