瑞巴派特治疗NSAIDs相关性肠病疗效的Meta分析
王腾燕,何雅军,舒建昌
(1.贵州医科大学,贵州 贵阳 550025;2.暨南大学附属广州红十字会医院 消化内科,广东 广州 510220)
非甾体抗炎药(nonsteroidal anti-inflammatory drugs,NSAIDs)具有抗炎、抗风湿、解热、镇痛效应,被广泛应用于类风湿性关节炎、炎症性疾病、心血管疾病和肿瘤等疾病的临床治疗。近年来,NSAIDs使用呈逐渐增多趋势[1]。众多研究表明,NSAIDs不仅引起胃黏膜损伤,还可以引起肠道黏膜损伤,因此,限制其在临床中的应用。NSAIDs通过抑制环氧化酶(cyclooxygenas,COX)、破坏磷脂层等多种机制引起肠道广泛的病变,即NSAIDs相关性肠病,包括肠道通透性增加、肠道炎症、黏膜溃疡、小肠出血、贫血、吸收不良、蛋白质丢失等[2]。其中,小肠黏膜损伤因超过常规内镜检查的范围,使其诊断困难。在服用NSAIDs人群中,NSAIDs相关性肠病的发病率为50%~80%[3-5]。目前,仍无指南明确提出用于治疗NSAIDs相关性肠病的药物。而临床上常用的质子泵抑制剂被认为会加重NSAIDs相关性肠病[6-7]。
瑞巴派特是一种内源性黏膜保护剂,通过上调内源性前列腺素的产生、抗氧化、清除自由基、保护线粒体功能而起效,主要应用于消化性溃疡、慢性胃炎和十二指肠溃疡等胃黏膜病[8]。近年来,研究显示,瑞巴派特对于NSAIDs相关性肠病具有一定的防治作用。现对近年发表的高质量的临床随机对照试验(randomized controlled trial,RCT)资料进行Meta分析,旨在更客观地评价瑞巴派特治疗NSAIDs相关性肠病的有效性。
1 资料与方法
1.1纳入标准 ①文献提供病例入选标准,瑞巴派特治疗NSAIDs相关性肠病的RCT,语种仅限于中文或英文,分配隐藏及盲法不限。②研究对象:NSAIDs相关性肠病的患者,种族、年龄、性别、地点不限。③干预措施:试验组以瑞巴派特为治疗手段,对照组行常规治疗或安慰剂对照。④结局判定指标:a.主要指标为肠黏膜损伤例数,b.次要指标为肠黏膜红斑数、肠黏膜糜烂数、肠黏膜溃疡数、血清白蛋白、血红蛋白。
1.2排除标准 ①无法获取全文、数据结果不全的研究以及病例报告、综述、述评及系统分析类研究;②重复发表的文献和动物试验。
1.3文献检索 计算机检索Embase、Cochrane、The Pubmed Library及中国知网、中国生物医学数据库、万方医学网。人工检索中、英文已发表的论文。检索时间范围为各数据库建库至2021年6月。中文检索词包括阿司匹林、非甾体抗炎药、瑞巴派特、肠损伤、肠黏膜损伤、下消化道出血、肠炎,英文检索词包括nonsteroid antiinflammatory agent、nonsteroid anti-inflammatory agent、nsaidst’、nsaids’、antiinflammatory agent,non steroidal、 analgesics, anti-inflammatory、rebamipide、intestinal、bowel。并查阅纳入文献的参考文献,以补充可能遗漏的研究。进一步将符合条件的文献纳入研究。
1.4文献质量评价与数据提取 由2名研究者独立完成质量评价和资料提取,之后进行交叉核对,当出现分歧时,共同讨论解决。依据Cochrane系统评价指导手册推荐的评价标准对纳入研究进行质量评价,手册以“高风险”“低风险”和“不清楚”3种作为评价结果,内容主要包括以下7个方面:①随机序列的产生;②分配序列的隐藏;③所有研究参与者和人员采用盲法;④结果评估的盲法;⑤结果数据的完整性;⑥选择性结局报告;⑦其他偏倚来源。提取内容包括第一作者、发表时间、总例数、疗程、干预组和对照组的例数及处理方法、2组的结局指标。
1.5统计学方法 采用RevMan 5.3软件对结果指标进行Meta分析。计数资料以比值比(odds ratio,OR)及其95%置信区间(confidence interval,CI)作为效应量, 计量资料采用用均数差(mean difference,MD)和95%CI作为效应量。若I2≤50%同时满足P≥0.05,认为各研究间无统计学异质性,此时应采用固定效应模型;若I2>50%或P<0.05,认为各研究间存在统计学异质性,此时需分析异质性产生的原因,若无法消除异质性,则需要选择随机效应模型分析。对所纳入的文献进行文献质量评价以及偏倚评估。
2 结 果
2.1文献检索结果及纳入信息 共检索出相关文献168篇,剔除重复文献后获得文献102篇,通过阅读文题、摘要后获得文献30篇,通读全文后最终纳入6篇RCT文献[9-14],具体流程见图1。最后入选患者255例,其中接受瑞巴派特治疗158例,接受安慰剂或其他药物对照治疗130例,纳入研究的基本特征见表1。文献质量评价见图2。

图1 文献筛选流程及结果
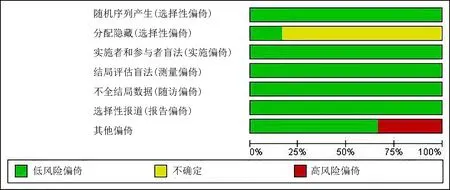
图2 偏倚风险图
2.2Meta分析结果 ①主要指标:肠黏膜损伤例数。3篇文献报道肠黏膜损伤例数,瑞巴派特组54例,常规治疗组58例。各研究间无显著异质性(I2=39,P>0.05),采用固定效应模型对其进行分析。Meta分析结果表明,与常规治疗组比较,瑞巴派特组肠黏膜损伤明显降低(OR=0.34,95%CI为0.15~0.75,P<0.05),见图3。

图3 瑞巴派特组与常规治疗组肠黏膜损伤比较
②次要指标:肠黏膜红斑数。6篇文献报道肠黏膜红斑,瑞巴派特组140例,常规治疗组116例。各研究间无显著异质性(I2=12,P>0.05),采用固定效应模型对其进行分析。Meta分析结果表明,瑞巴派特组与常规治疗组比较,肠黏膜红斑数差异无统计学意义(MD=-0.29,95%CI为-0.67~0.09,P>0.05),见图4。

图4 瑞巴派特组与常规治疗组肠黏膜红斑数比较
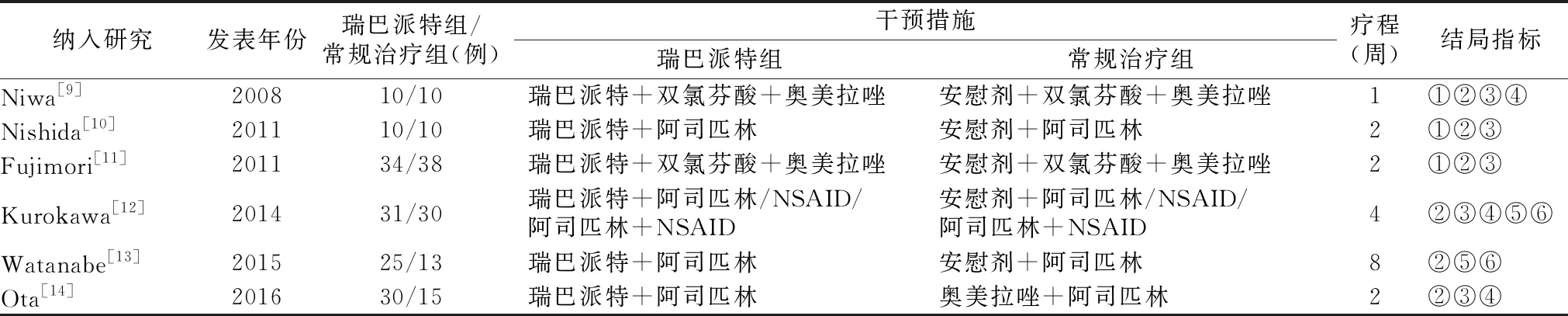
表1 纳入研究的基本特征
③次要指标:肠黏膜糜烂数。4篇文献报道肠黏膜糜烂,瑞巴派特组105例,常规治疗组93例。各研究间无显著异质性(I2=36,P>0.05),采用固定效应模型对其进行分析。Meta分析结果表明,与常规治疗组比较,瑞巴派特组肠黏膜糜烂明显减少(MD=-4.71,95%CI为-6.40~-3.02,P<0.05),见图5。
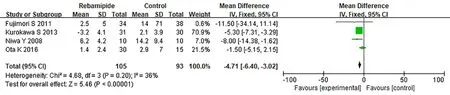
图5 瑞巴派特组与常规治疗组肠黏膜糜烂数比较
④次要指标:肠黏膜溃疡数。3篇文献报道肠黏膜溃疡,瑞巴派特组71例,常规治疗组55例。各研究间无异质性(I2=0,P>0.05),采用固定效应模型对其进行分析。Meta分析结果表明,瑞巴派特组与常规治疗组比较肠黏膜溃疡较少(MD=-0.45,95%CI为-0.89~-0.01,P<0.05),见图6。

图6 瑞巴派特组与常规治疗组肠黏膜溃疡数比较
⑤次要指标:血红蛋白量。2篇文献报道血红蛋白量,瑞巴派特组56例,常规治疗组43例。2个研究间有显著异质性(I2=86,P<0.05),采用随机效应模型对其进行分析。Meta分析结果表明,瑞巴派特组与常规治疗组比较,血红蛋白量差异无统计学意义(MD=0.22,95%CI为-0.04~0.47,P>0.05),见图7。

图7 瑞巴派特组与常规治疗组血红蛋白比较
⑥次要指标:血清白蛋白。2篇文献报道血清白蛋白,瑞巴派特组56例,常规治疗组43例。2个研究间无异质性(I2=0,P>0.05),采用固定效应模型对其进行分析。Meta分析结果表明,瑞巴派特组与常规治疗组比较,血清白蛋白差异无统计学意义(MD=0.37,95%CI为-0.05~0.78,P>0.05),见图8。
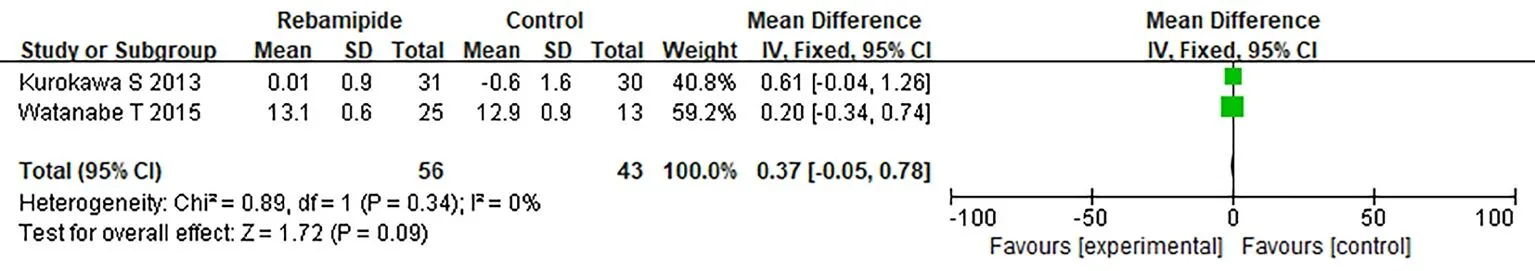
图8 瑞巴派特组与常规治疗组血清白蛋白比较
3 讨 论
NSAIDs相关性肠病缺乏诊断金标准,临床上常根据患者NSAIDs服用史、粪便钙卫蛋白、影像学及内镜检查综合诊断[15]。其在内镜下的特异性病变为黏膜网格化,并伴有隔膜样狭窄以及其他如黏膜糜烂、红斑、溃疡甚至活动性出血等[16-17]。目前,NSAIDs导致肠黏膜损伤的具体机制仍未明确,多认为NSAIDs相关性肠病是多种因素共同作用的结果,包括系统的和局部的作用,如微循环障碍、肠道动力紊乱、NO、炎症因子、氧族激活等;另外,国外学者提出“三阶段攻击假说”,解释可能的损伤过程。首先,NSAIDs溶解了小肠黏膜上皮细胞表面磷脂层的类脂,上皮细胞内的线粒体受到直接的损害;随之钙离子外流,诱导产生自由基,进而细胞间连接断裂,小肠黏膜通透性增加,胆汁、蛋白水解酶、肠道细菌或毒素等攻击因素侵蚀损伤黏膜上皮细胞,引发炎症反应[18]。
目前尚无专门批准用于防治NSAIDs相关性肠病的措施。质子泵抑制剂或H2受体拮抗剂常与NSAIDs联用,前者对上消化道黏膜的保护作用已被证实,然而,对于NSAIDs引起的肠黏膜损伤的效果却并不明确。近年来,一些药物被用于防治NSAIDs相关性肠病,如瑞巴派特、替普瑞酮、抗生素、5-氨基水杨酸制剂、抗肿瘤坏死因子及硫化氢等[15]。
瑞巴派特在保护上消化道黏膜方面效果显著,因此其在保护肠黏膜方面也越来越受到关注。早前就有动物实验证明,瑞巴派特可通过清除氧自由基、抑制多种炎症反应参与保护肠黏膜[19]。另有研究证实,瑞巴派特能够诱导COX-2活性并刺激前列腺素受体表达,进而提高内源性前列腺素、增加胃黏液分泌[20]。一项动物实验显示,瑞巴匹特可能通过抑制TLR4/NF-κB信号通路和减少细胞紧密连接蛋白的破坏而逆转NSAIDs介导的肠黏膜损伤[21]。近年,韩涛涛等[22]研究显示,瑞巴派特可通过维持肠黏膜机械屏障的稳定性、调节黏膜保护因子水平进而维持肠黏膜化学屏障功能而参与保护肠黏膜屏障。也有研究证实,肠道菌群是NSAIDs相关性肠病的重要病理生理因素,且质子泵抑制剂会通过改变肠道菌群谱加重NSAIDs相关性肠病[23],由此猜测维持肠道菌群环境也许是改善NSAIDs相关性肠病的另一策略。有临床证据表明,瑞巴派特改善小肠黏膜损伤确实伴随着肠道微生物谱的改变[24-26]。Tanigawa等[7]进一步证实,瑞巴派特不仅可以通过调节肠道菌群从而抑制NSAIDs引起的肠道黏膜损伤,而且还能通过上述途径抑制质子泵抑制剂对NSAIDs相关性肠病的加剧作用。
本研究通过检索国内外关于瑞巴派特在临床中治疗NSAIDs相关性肠病的RCT研究,讨论瑞巴派特治疗NSAIDs相关性肠病的疗效,将肠黏膜损伤例数、肠黏膜糜烂、肠黏膜溃疡、肠黏膜红斑、血红蛋白、血清白蛋白纳入疗效评价指标;分析结果显示,与常规治疗组比较,瑞巴派特虽然并没有显著改善患者的血红蛋白、血清白蛋白水平及减少黏膜红斑,但在改善肠黏膜损伤如糜烂、溃疡方面发挥着重要作用。过往研究已证实,瑞巴派特不仅可以清除氧自由基、抑制多种炎症反应、调节肠道菌群参与保护肠黏膜,而且能够诱导COX-2活性并刺激前列腺素受体表达,进而提高内源性前列腺素、增加胃黏液分泌、维持肠黏膜屏障的稳定性。这可能是其减少肠黏膜损伤例数,促进糜烂、溃疡愈合的主要原因。
本研究存在一些不足之处:①纳入研究多为探索性小样本、单中心研究,未进行长期、大规模、多中心研究;②纳入的研究中有2个研究为交叉对照试验,最后得出有利结果,不排除受到干预措施的交叉影响;③纳入研究中瑞巴派特使用剂量、使用时间存在差异;④纳入研究均未对服用NSAIDs的人群进行分组,如短期服用、长期(>3个月)服用,而服用药物的时间长短必定会对结局指标造成一定程度的影响;⑤本研究仅检索了中、英文文献,未纳入中、英文以外其他语种的相关文献。因此,上述因素可能导致结论存在偏倚,需要更多关于瑞巴派特治疗NSAIDs相关性肠病疗效的大样本RCT进一步证实。
综上所述,本研究结果显示,瑞巴派特在治疗NSAIDs相关性肠病方面具有优势,可以减轻服用NSAIDs药物患者的肠黏膜损伤,如糜烂、溃疡。由于目前试验的局限性,还需进行大规模、高质量、更贴近临床实际的设计研究,以进一步确定瑞巴派特对于NSAIDs相关性肠病的实际疗效。

