拐枣多糖的反复冻融回流工艺优化及抗氧化活性研究
杨 静,李 博,张延妮
(1.杨凌质量技术检测检验所,陕西杨凌 712100;2.陕西师范大学生命科学学院,陕西西安 710119)
拐枣学名枳椇(),为鼠李科枳椇属植物(),分布在我国甘肃、陕西等地。它可以直接食用,也可以开发为功能性食品。《唐本草》最早记录了该植物的药用应用,被称为金果树,此外《救荒本草》、《雷公炮炙论》等多部医药著作中都对其有介绍。拐枣含有多种化学成分,包括多糖类、黄酮类和酚酸类等,其中多糖类是其最主要化学成分。现已研究发现,多糖在免疫调节、抗氧化、抗肿瘤、降血糖等方面都具有独特的药理活性。因此,拐枣中多糖的提取成为了拐枣开发、利用的重要一环。
科学地选择提取方法在药物分析、食品分析及环境分析等中都是极其重要的,它可以提高有效成分的提取率,降低杂质的含量,使有效成分更具有代表性。在多糖提取的常用方法中,目前已应用于拐枣中多糖提取的方法有超声-微波辅助法、回流法、酶法、超声波辅助法等,也取得了一定的效果,但每种方法都存在一定的局限性,对于拐枣中多糖提取时存在的挑战没有完全解决,拐枣开发的需求依然在呼唤性能更优越的提取方法,或针对以上方法的不足进行改进的措施。反复冻融技术是利用冻结-解冻过程中细胞内部的冰晶体对细胞壁的机械作用而使其破裂,该技术实验条件温和,不破坏热不稳定性成分,也容易在工业上放大,是一种环境友好且经济的提取方法。反复冻融法已用于油菜花粉多糖、刺麒麟菜多糖、枸杞多糖和小球藻多糖的提取,均取得了较好的效果;当反复冻融法进一步与回流法结合起来用于枸杞多糖的提取时,显示出消耗少、效率高的优势。而反复冻融技术结合回流法尚未应用于拐枣中多糖的提取。为了提高拐枣多糖提取物的抗氧化等活性,本研究在设计提取工艺上,在对拐枣粉末样品进行传统回流提取之前,叠加反复冻融的预处理,从而减少拐枣粉末样品在高温回流环节中的持续时间和频次,从理论上减少热不稳定多糖可能的损失并提高其生物利用度;同时,通过探索溶胀溶剂用量、冷冻时间及温度、冻融循环次数等对多糖含量的影响规律,优化提取工艺,最后对得到的多糖提取物进行抗氧化性方面的评价,以期为拐枣多糖的深入研究及开发应用提供参考。
1 材料与方法
1.1 材料与仪器
拐枣 采自陕西旬阳,经陕西师范大学生命科学学院植物学教研室鉴定为鼠李科枳椇属植物(),于40 ℃烘干,粉碎,过60 目筛保存备用;牛血清白蛋白(BSA 批号S12014)、1,1-二苯基-2-三硝基苯肼(DPPH 批号190301)、2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS 批号24146)及葡萄糖标准品(批号70925)购自上海源叶生物科技有限公司;所有其他使用的化学品和溶剂均为分析纯试剂。
101 型电热鼓风干燥箱 北京科伟永兴仪器有限公司;F120 型粉碎机 北京中兴伟业仪器有限公司;RE-52AA 旋转蒸发仪 上海亚荣生化仪器厂;FDU-1200 真空冷冻干燥机 东京理化;UV6100S型紫外可见分光光度计 上海美普达仪器有限公司。
1.2 实验方法
1.2.1 拐枣中多糖的提取 参照云南小粒咖啡花中多糖提取的工艺流程,取100 g 拐枣粉末置于冻存管中,加入一定量的蒸馏水溶胀后,置于冰箱冷冻室(-20 ℃)冷冻一定时间后取出,放入一定温度的水浴锅中解冻4 h,再次重复以上操作(冻存、放置及解冻)一定次数,将溶胀的拐枣及溶液倒入圆底烧瓶中,加入100 mL 石油醚,于45 ℃水浴回流1 h,过滤滤去拐枣残渣,分液后弃去石油醚层,剩余溶液与拐枣一并倒入圆底烧瓶中,加蒸馏水150 mL,在65 ℃水浴2 h 后减压浓缩至25 mL,加入75 mL 乙醇,溶液中的沉淀即为粗多糖,将沉淀溶于水,然后用Sevage 法除蛋白质,再通过透析除去单糖,再次用乙醇从提取液中将多糖沉淀下来,沉淀冷冻干燥后即得拐枣多糖提取物,其质量记作m。
1.2.2 单因素法优化拐枣多糖的提取 以多糖含量为指标,对以上提取工艺中的四个与冻融过程有关的条件进行考察。溶胀加水量的考察:固定冻结时间为3 h、解冻温度为50 ℃,冻融次数为3 次,按照以上工艺流程获得一系列不同溶胀加水量(分别为10、20、30、40 和50 mL/100 g)时的多糖提取物;冻结时间的考察:固定加水量为30 mL/100 g,解冻温度为50 ℃,冻融次数为3,按照以上工艺流程获得一系列不同冻结时间(分别为1、2、3、4、5 h)时的多糖提取物;解冻温度的考察:固定加水量为30 mL/100 g,冻融次数为3,冻结时间3 h,按照以上工艺流程获得一系列不同解冻温度(分别为30、40、50、60、70 ℃)时的多糖提取物;冻融次数的考察:固定加水量为30 mL/100 g,解冻温度为50 ℃,冻结时间3 h,按照以上工艺流程获得一系列不同冻融次数(分别为1、2、3、4、5 次)时的多糖提取物。
1.2.3 正交试验优化法提取拐枣多糖 按照L(3)正交表设计,以多糖含量为指标,以溶胀加水量、解冻温度、冻融次数、冻结时间为考察因素,每个因素设置三个水平(见表1),进行拐枣多糖的提取。
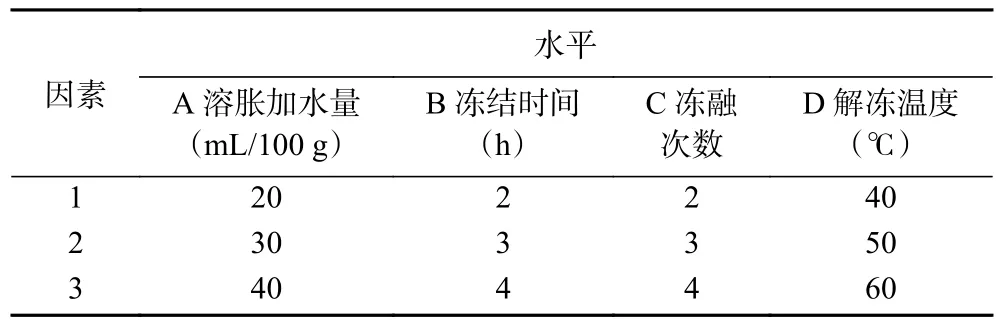
表1 正交试验因素水平表Table 1 Factors and levels of the orthogonal test
1.2.4 拐枣多糖提取物中多糖含量的分析 应用蒽酮-硫酸法对多糖提取物中的多糖进行含量测定。
1.2.4.1 标准曲线的建立 称取100 mg 葡萄糖(105 ℃烘干至恒重),用蒸馏水溶解后定容于100 mL容量瓶中。分别吸取1.00、2.00、3.00、4.00、5.00、6.00 mL 置于6 个100 mL 容量瓶中,用蒸馏水定容,然后从各容量瓶中吸取2.00 mL 溶液分别加入到6 支容量为20 mL 的带塞试管中,以蒸馏水作空白对照,往7 支试管中分别加入8.0 mL 蒽酮-硫酸试剂(蒽酮-硫酸试剂由75 mL 无水硫酸、25 mL 蒸馏水和0.2 g 蒽酮混合而成),加完后立刻置冰水中冷却5 min,再将7 支试管同时浸入沸水浴中,加热10 min 后取出,于冰水中冷却至室温,在620 nm 波长处测定其吸光度,以容量瓶中葡萄糖的浓度为横坐标,吸光度为纵坐标,绘制葡萄糖溶液标准曲线。
1.2.4.2 拐枣中多糖含量的测定 称取干燥至恒重的拐枣多糖提取物0.1000 g,用蒸馏水定容于50 mL容量瓶中。吸取2.00 mL,按1.2.4.1 中的步骤测定吸光度值,计算拐枣中多糖含量Y,含量Y 计算公式如下:
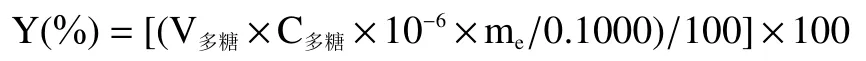
其中V=50.00 mL;C为容量瓶中溶液多糖的浓度,单位为μg/mL;m为1.2.1 中所获拐枣多糖提取物,单位为g。
1.2.5 拐枣多糖提取物的红外光谱分析 将拐枣多糖提取物与KBr 粉末(1:100)研磨混匀压片后,在4000~400 cm范围内进行红外光谱扫描,以分析提取物中的官能团及物质种类。
1.2.6 拐枣多糖提取物的抗氧化活性评价
1.2.6.1 拐枣多糖提取物对DPPH 自由基清除能力的测定 参照文献[27]将DPPH 溶液(0.2 mmol/L,无水乙醇配制,与蒸馏水等体积混合后在517 nm 处测量其吸光度并记为A)和拐枣多糖提取物水溶液(将拐枣多糖提取物粉末溶解于蒸馏水中,配制成4.00 mL 浓度分别为0.005、0.01、0.02、0.04、0.06、0.08、0.10 mg/mL 的溶液,与无水乙醇等体积混合后在517 nm 处测量其吸光度并记为A)等体积混匀,使其充分混合,室温静置,避光反应半小时,然后在517 nm 处测量混合反应液的吸光度并记为A;阳性对照选择相同浓度梯度的系列抗坏血酸(V)溶液,同样进行吸光度测量。最后按照以下公式计算对DPPH 自由基的清除率:
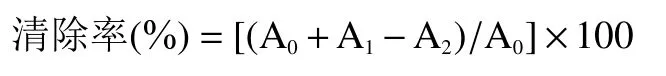
1.2.6.2 拐枣多糖提取物对ABTS 自由基清除能力的测定 先配制两种储备液,称取0.096 g ABTS 溶于蒸馏水,定容于25 mL 容量瓶得到储备液1,称取0.033 g 过硫酸钾溶于蒸馏水,定容于25 mL 容量瓶得到储备液2,每次实验前取两个储备液各500 μL等体积新鲜混合,室温避光反应18 h,作为母液,再将母液用无水乙醇稀释50 倍作为后续反应液,取2mL 该反应液与蒸馏水等体积混合后在734 nm 处测量其吸光值,记为A;将2.00 mL 拐枣多糖提取物溶液(浓度梯度为0.50、1.00、2.00、3.00、4.00、5.00 mg/mL,与等体积蒸馏水混合后在734 nm 处的吸光度记为A)与2.00 mL 母液稀释后的反应液混合,室温避光反应6 min后在734 nm 处测量其吸光度,记为A,阳性对照选择相同浓度梯度的系列V溶液。按照以下公式计算清除率:
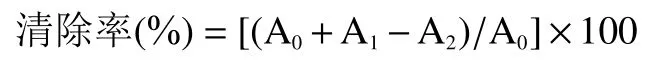
1.2.6.3 拐枣多糖提取物对Fe还原能力的测定参照文献[29]的测定方法,将75 μL 拐枣多糖提取物溶液(浓度分别为0.10、0.20、0.40、0.60、0.80、1.0 mg/mL)与75 μL 的磷酸盐缓冲液(0.20 mol/L,pH6.60)及75 μL 1%铁氰化钾溶液混合,于50 ℃恒温反应20 min,再加入30 μL 10%三氯乙酸溶液,避光反应10 min,待反应结束后在混合反应液中加250 μL 的蒸馏水,再加入50 μL 0.1%的三氯化铁溶液,避光室温反应10 min,然后在700 nm 处测定一系列混合液的吸光度。阳性对照选择相同浓度梯度的系列V溶液。
1.3 数据处理
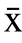
2 结果与分析
2.1 单因素优化实验结果
2.1.1 溶胀加水量对多糖含量的影响 把1.2.2 中获得的多糖粉末按1.2.4 中的步骤,测定吸光度值并计算多糖的含量(多糖测定方法的方法特性:定量方程为A=0.0077C+0.0010,其中C 为葡萄糖溶液的浓度,单位为μg/mL,A 为吸光度值,线性范围为10~60 μg/mL,相关系数为0.9995),溶胀加水量的影响趋势如图1 所示。
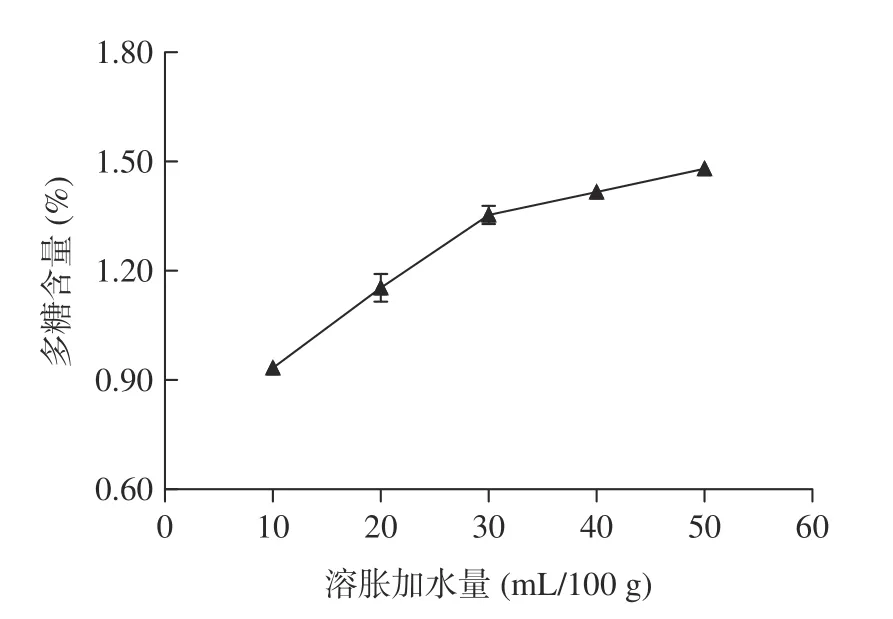
图1 拐枣中多糖的含量随溶胀加水量的变化Fig.1 Variation of the content of polysaccharides in Hovenia dulcis along with water content added
由图1 可以看出,多糖含量随加水量的增加先快速上升,当加水量大于30 mL/100 g 时,含量的增加趋于平缓,原因可能是当溶胀加水量达到30 mL/100 g后,细胞吸水量达到饱和,进一步加大含水量不会起到增强效果。溶胀的拐枣粉末中的水在冻结时形成冰晶体,可以产生张力,从而破坏细胞壁的组织结构,有利于多糖释放到溶液中。可以初步把较佳溶胀加水量定为30 mL/100 g。
2.1.2 冻结时间对多糖含量的影响 冻结时间对多糖含量的影响如图2 所示。
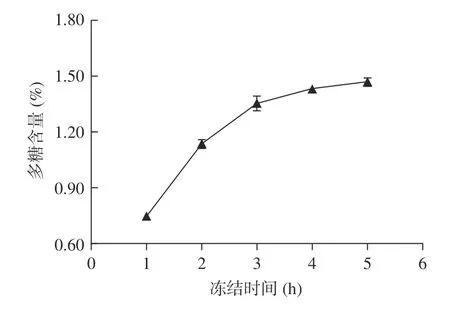
图2 拐枣中多糖的含量随冻结时间的变化Fig.2 Variation of the content of polysaccharides in Hovenia dulcis along with freezing duration
从图2 可以看出,在一定范围内,随着冻结时间的延长,多糖含量明显增大,但当冻结时间超过3 h后,多糖含量的增加趋于平缓。随着冻结时间的延长,最终可以造成植物细胞壁三维网状结构的完全破坏和多糖的完全释放,本实验结果显示冻结时间达到3 h 后,细胞内冰晶增长趋于饱和,这个规律和同类提取方法体现的规律较为一致,所以可以初步把较佳冻结时间定为3 h。
2.1.3 解冻温度对多糖含量的影响 解冻温度对多糖含量的影响如图3 所示。
图3 拐枣中多糖的含量随解冻温度的变化Fig.3 Variation of the content of polysaccharides in Hovenia dulcis along with defrosted temperature
从图3 可以看出,在实验考察的温度范围内,从30 ℃开始,当解冻温度逐步升高时,多糖的含量也逐步增加,当解冻温度为50 ℃时,多糖含量最高,当温度超过50 ℃后,多糖含量稍微有所减低;本实验中高于一定温度后含量有所降低的原因可能是:虽然增加温度一般有利于待提取组分从植物中溶解出来,然而过高的解冻温度可能导致样品解冻时样品内部温度均匀性变差从而增大传质阻力,从整体上在溶解动力学上不利于待提取组分的溶出,另一个可能的原因是超过50 ℃的温度加速了微量热不稳定性多糖的分解,该规律与冻融法提取枸杞中多糖的规律相似。可以初步把较佳解冻温度定为50 ℃。
2.1.4 冻融次数对多糖含量的影响 冻融次数对多糖含量的影响如图4 所示。
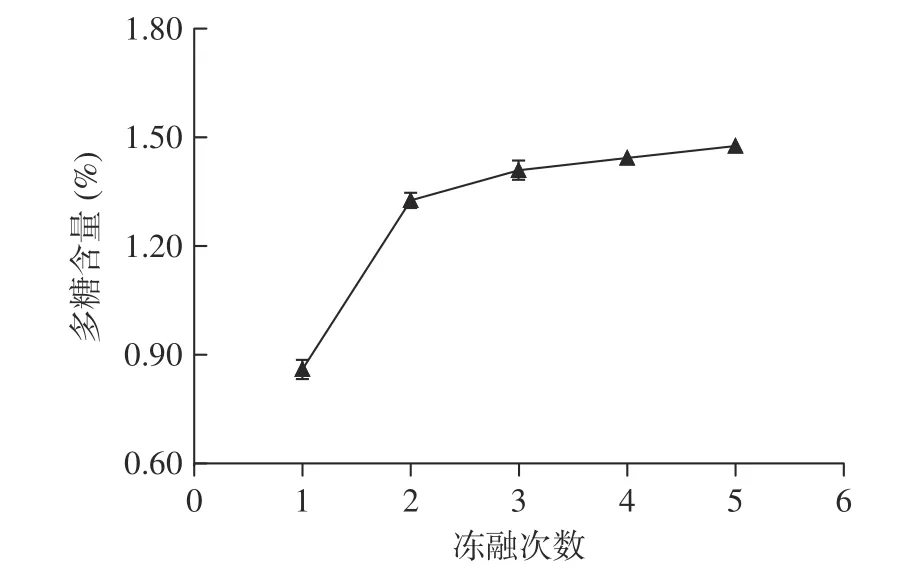
图4 拐枣中多糖的含量随冻融次数的变化Fig.4 Variation of the content of polysaccharides in Hovenia dulcis along with the times for freezing-melting repetition
从图4 可以看出,在一定范围内,随着冻融次数的增多,多糖含量逐渐增大,但超过3 次以后多糖含量增加并不明显,可能是因为多次冻融后细胞壁结构基本被破坏所致。可以初步把较佳冻融次数定为3 次。
2.2 正交试验优化结果
为进一步优化拐枣多糖提取工艺的最佳条件,避免单因素轮换优化法中因素组合不够均匀等弊端,在单因素轮换法初步优选的基础上,以多糖含量为考查指标,采用L(3)正交设计对溶胀加水量、解冻温度、冻融次数、冻结时间等四个因素在不同水平的组合进行了考察,试验结果见表2。
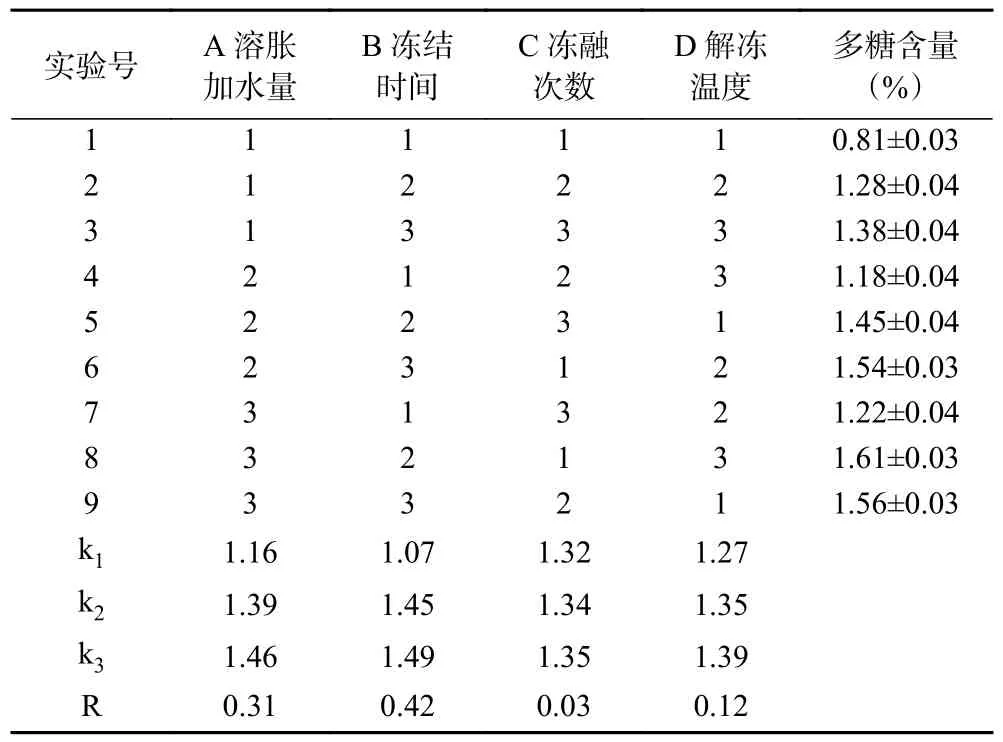
表2 正交试验结果Table 2 Results of orthogonal test
由表2 可知,各考察因素对拐枣多糖含量的影响程度是不同的,R 越大说明在考察的水平范围某因素对考察指标的影响越大,从而四个因素对拐枣中多糖含量的影响大小顺序依次为:B>A>D>C。对于因素C,由于不同水平影响的区别非常小,从效率和成本出发,选择最低水平,而其它三个因素选择考察指标Y最大值对应的水平。最终反复冻融回流法提取拐枣多糖工艺的最佳条件组合为ABCD,即:溶胀加水量40 mL/100 g,冻结时间4 h,冻融次数2 次,解冻温度60 ℃时,此时多糖含量较高。在此组合下进行验证试验3 次,多糖含量为1.68%±0.03%,高于正交试验最高组即第8 组结果(1.61%±0.03%),说明正交试验最佳条件组合的优选结果(ABCD)可靠。
2.3 拐枣多糖提取物的红外光谱表征
拐枣多糖提取物的FT-IR 光谱如图5 所示,主要吸收峰归属如下:3373 cm处的吸收峰来自多糖的羟基伸缩振动;2930 cm处的吸收峰也是多糖的特征吸收之一,这是由烷基的C-H 伸缩振动引起的;1610 cm处的吸收峰是羰基的特征峰,表明多糖中有糖醛酸的存在;1080 cm处的吸收峰往往是吡喃糖环的特征吸收峰,表明吡喃糖的存在。这些红外吸收信号都是多糖典型结构的特征吸收,在一定程度上验证了多糖的存在。
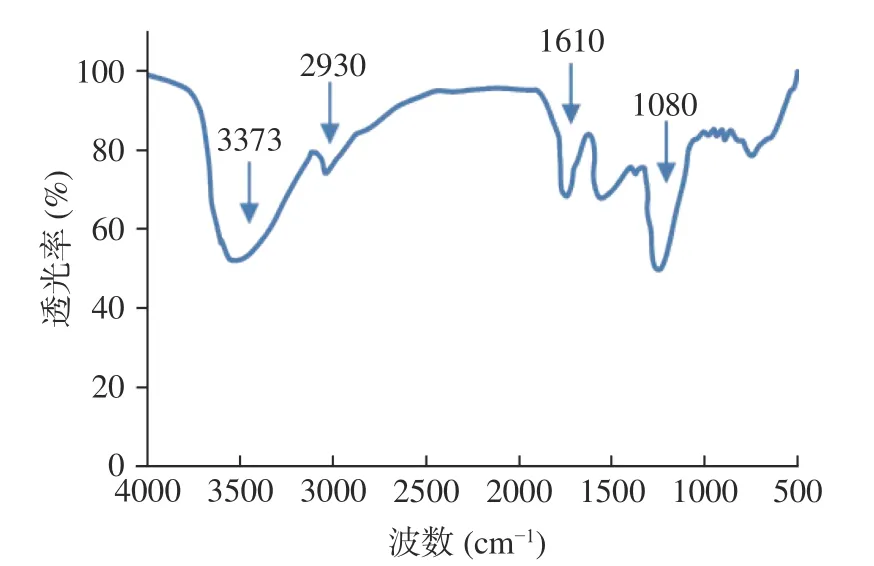
图5 拐枣多糖提取物的红外光谱图Fig.5 Infrared spectrum of the polysaccharide extract from Hovenia dulcis
2.4 拐枣多糖提取物的抗氧化活性
2.4.1 拐枣多糖提取物对DPPH 自由基的清除能力DPPH 法是测定物质抗氧化性的常用方法。图6为拐枣多糖提取物溶液对DPPH 自由基的清除率随提取物溶液浓度的变化图,由图可以看出,拐枣多糖提取物溶液对DPPH 自由基的清除率随着提取物溶液浓度升高而增强,但当多糖提取物浓度高于0.02 mg/mL 后,清除率的增加趋于平缓,与同样浓度的V溶液相比,拐枣多糖提取物的清除能力比V稍弱。当浓度达到0.10 mg/mL 时,V和拐枣多糖提取物对DPPH 自由基的清除率可分别达到98.12%和86.73%。经过计算,拐枣多糖的IC为0.014 mg/mL,表明其具有较强的抗氧化性活性。
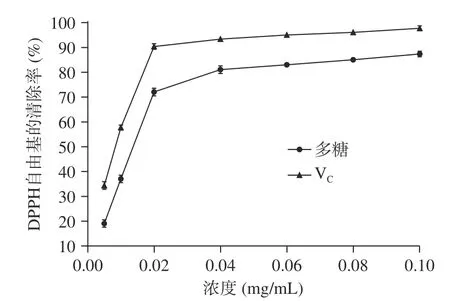
图6 拐枣多糖提取物溶液对DPPH 自由基的清除率Fig.6 Clearance ratios of the polysaccharide extract from Hovenia dulcis to DPPH free radical
2.4.2 拐枣多糖提取物对ABTS 自由基的清除能力ABTS 光度法常用于检测活性物质对自由基的清除能力,特别是基于ET 机制的清除能力。图7 为拐枣多糖提取物溶液对ABTS 自由基的清除率随提取物溶液浓度的变化趋势图,由图7 可以看出,拐枣多糖提取物溶液对ABTS 自由基的清除率随多糖提取物浓度的升高而增强,但当多糖提取物浓度高于1.0 mg/mL 时,清除率的增加趋于平缓,从图7 还可以看出,拐枣多糖提取物对ABTS 自由基的清除能力与V相当。当提取物溶液浓度达到2.0 mg/mL时,V和拐枣多糖提取物对ABTS 自由基的清除率可分别达到94.85%和91.33%。
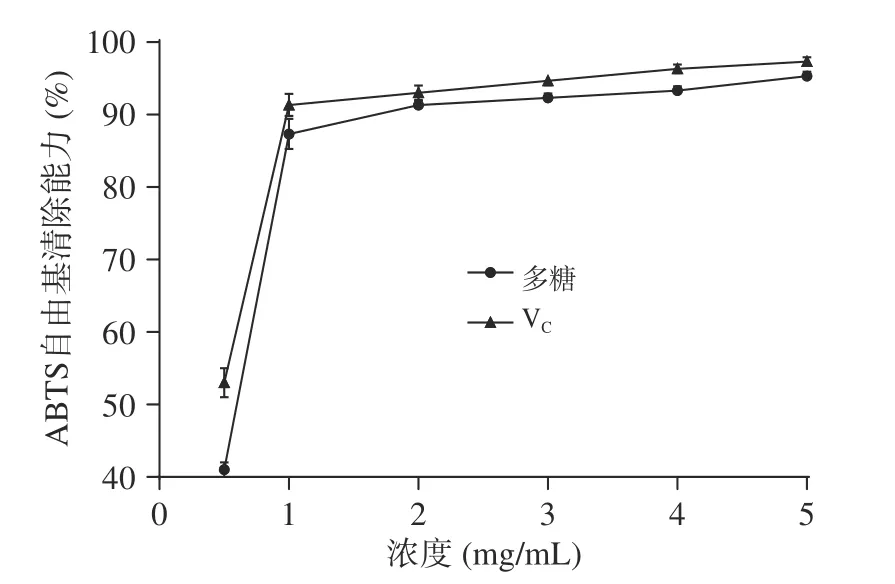
图7 拐枣多糖提取物溶液对ABTS 自由基的清除率Fig.7 Clearance ratios of the polysaccharide extract from Hovenia dulcis to ABTS free radical
2.4.3 拐枣多糖提取物对Fe的还原能力 Fe的还原实验常用来评价物质的总抗氧化能力。拐枣多糖提取物溶液的总抗氧化能力测试实验结果见图8,吸光度值越大表明溶液的抗氧化能力越强,由图8可以看出,吸光度值随拐枣多糖提取物溶液浓度的增大而明显增大,表明拐枣多糖提取物溶液的抗氧化能力随浓度增大而提高,尽管如此,拐枣多糖提取物的抗氧化能力和V相比还有一些差距。当拐枣多糖提取物溶液的浓度为1.0 mg/mL 时,其体现出的抗氧化性能力达到V的80%。
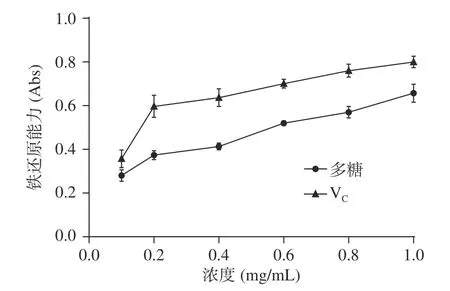
图8 拐枣多糖提取物溶液的抗氧化实验结果Fig.8 Results of anti-oxidation test of the polysaccharide extract from Hovenia dulcis
反复冻融法能够破碎细胞壁,加速细胞内含物的释放,这和文献报道较为一致。关于拐枣中多糖的含量,不同的报道中这一数据差别较大,由于拐枣产地和采收季节等影响实验结果的因素较多,准确定量地评价该工艺提升提取的直接效果还需要更系统的研究;尽管如此,采用该工艺制备的多糖和类似研究获得的提取物具有相媲美的抗氧化活性。
3 结论
反复冻融回流提取法提取拐枣中多糖工艺操作简单、环保,所需条件在现代工业生产中比较容易获得,适合各种破壁工艺提取。该工艺的较佳条件为:溶胀加水量40 mL/100 g,冻结时间4 h,冻融次数2 次,解冻温度60 ℃时,在此条件下拐枣中多糖的含量为1.68%±0.03%;拐枣多糖提取物的红外光谱表明其含有糖醛酸,这也许是该提取物抗氧化性较强的原因之一;拐枣多糖提取物对DPPH 自由基及ABTS 自由基都表现出较强的清除能力,这些抗氧化作用在一定浓度范围内呈现出了浓度依赖性。在最佳工艺条件下获得的拐枣多糖提取物具有显著的抗氧化活性,作为一种天然资源,其市场前景广阔。

