基于iTRAQ技术的小海绵羊肚菌耐镉蛋白定量组学
徐鸿雁
(青海大学农林科学院,青海 西宁 810016)
镉[Cd(II)]是一种常见的环境污染物,主要来自于采矿、燃煤、焚化垃圾、电子镀镉等人为因素[1],它侵入土壤后经生物循环进一步进入生态系统,破坏生物多样性,对人体健康有害[2-3]。长期受Cd污染的环境中,生存着一定数量对其具有较强耐受能力的微生物类群。而此类生物本身也会发生基因突变或自我调整代谢以适应长时间的Cd胁迫环境。
羊肚菌(Morchella),不仅具有较高的营养及药用价值[4],对重金属也有潜在的富集能力[5-8],有研究发现野生羊肚菌Cd元素含量超出国家限定标准[9]。目前对于羊肚菌如何富集、耐受Cd的机理研究才刚刚起步,主要集中在子实体Cd含量测定[9]、Cd富集能力[10]、基因敲除[11]等方面,关于Cd胁迫下羊肚菌蛋白表达情况和响应机制等研究鲜有报道。同位素标记相对和绝对定量(iTRAQ)技术可对不同样本同时进行定量分析,已成为定量蛋白组学中的支撑技术之一,且越来越多被应用到生物中,如水稻[12-13]、植物乳杆菌[14]和细菌[15]等抵抗重金属胁迫机制的研究中。
本研究利用iTRAQ技术平台定量分析Cd胁迫下羊肚菌蛋白质差异表达变化,初步探究羊肚菌在Cd环境下的响应机制,为探究真菌耐镉机理提供理论支撑。
1 材料与方法
1.1 菌种来源
供试小海绵羊肚菌(M.spongiola)M12-10菌株由青海大学极端环境微生物研究室提供。菌株培养用PDA培养基。
1.2 试验方法
1.2.1 小海绵羊肚菌Cd处理菌丝的培养
以PDA培养基为基础,配制最终浓度为0mg/L、0.15mg/L、0.9mg/L、1.5mg/L的CdCl2培养基,对照(CK)组为无其它元素添加的PDA培养基。灭菌后于培养基中央接种一块小海绵羊肚菌菌饼,在离接种块附近斜插3块无菌盖玻片,放置于(20±1)℃黑暗恒温培养箱中培养5d。
1.2.2 扫描电镜观察
Cd处理试验结束后,用2.5%戊二醛固定不同浓度Cd处理的羊肚菌菌丝,经乙醇梯度脱水、置换、预冷、冻干、镀金,采用扫描电子显微镜-X射线光谱仪观察菌丝经不同处理后形态变化。每处理做3个重复。
1.2.3iTRAQ蛋白定量实验
收集菌体样品送至华大基因进行iTRAQ蛋白定量分析,按步骤进行菌丝粗蛋白提取、酶解、iTRAQ标记、质谱分析等流程[16]。
1.2.4 蛋白质的鉴定和生物信息学分析
原始数据上传至数据存储平台ProteomeXchange。定义差异倍数1.2倍及以上(即上调≥1.2和下调≤0.83),且经过显著性统计检验其Q-value值≤0.05的蛋白为显著差异蛋白(DEPs)[17]。利用Gene Ontology、KEGG、STRING数据库对鉴定的蛋白进行功能注释、生物通路信息分析,同时在WoLF PSORT软件中对差异蛋白进行亚细胞定位预测。
1.2.5 蛋白表达的RT-qPCR验证
根据iTRAQ蛋白定量结果,筛选部分差异表达蛋白,对其编码基因进行实时荧光定量,以验证iTRAQ蛋白定量结果的准确性。在线设计引物(表1),18S rRNA为内参。Cd处理第5天收集菌丝,真菌快速抽提总RNA、经反转录后在20μl反应体系进行qRT-PCR反应:引物(10μmol/L)0.4μl,cDNA (1μg/ml) 0.8μl,2×SG Fast qPCR Master Mix 10μl。反应条件:95℃ 180s;95℃ 3s,各引物Tm值30s,40个循环[9]。数据使用2-△△Ct进行相对表达量计算,每待测基因重复3次。

表1 qRT-PCR验证所选蛋白及对应引物信息
2 结果与分析
2.1 Cd对羊肚菌菌丝形态的研究
Cd胁迫处理的羊肚菌菌丝形态如图1所示:对照CK无Cd添加时,菌丝表面光滑,菌丝扁平且直径较宽;浓度在0.15mg/L时菌丝开始出现褶皱且直径变窄;浓度在0.9mg/L时菌丝出现扭曲且表面变的粗糙;浓度在1.5mg/L时菌丝出现明显扭结、弯曲、折叠,菌丝表面褶皱凹陷情况增多。结果表明,Cd会破坏菌丝结构和形态,从而抑制羊肚菌的生长。
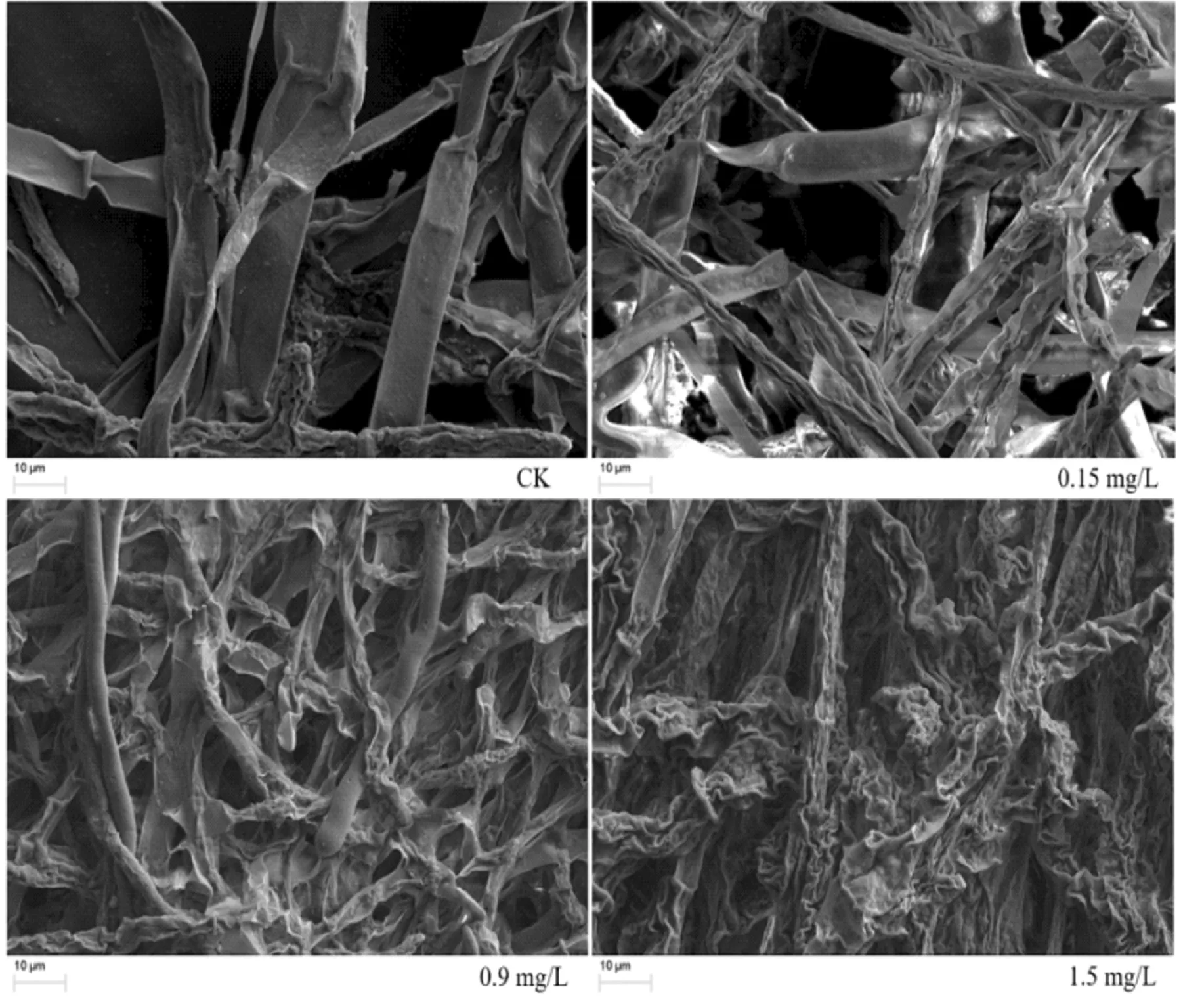
图1 Cd(II)处理下小海绵羊肚菌扫描电镜图像
2.2 Cd对羊肚菌蛋白表达水平的研究
2.2.1 蛋白鉴定及定量分析
M12-10菌丝蛋白SDS-PAGE电泳结果如图2所示,蛋白条带清晰无降解,符合质控标准;菌体蛋白浓度及总量符合iTRAQ实验标准(表2)。在不同浓度Cd胁迫下,共检测鉴定到3629个DEPs,其中144个蛋白对Cd处理呈现显著差异性表达(图3)。0.15mg/L Cd组中有17个DEPs表达上调,18个DEPs表达下调;0.90mg/L Cd处理组有29个DEPs表达上调,38个DEPs表达下调;1.50mg/L Cd处理组有25个DEPs上调表达,17个DEPs下调表达。值得注意的是,在三个Cd处理组的144个DEPs中,共有6个DEPs上下调趋势一致。

图2 总蛋白质定量标准曲线(左)及其SDS-PAGE电泳图(右)注:泳道M为Marker;泳道1-4分别为样品CK,Cd0.15,Cd0.9,Cd1.5。

表2 不同Cd环境下羊肚菌样品中蛋白含量

图3 镉胁迫下羊肚菌菌丝差异表达蛋白
2.2.2 差异蛋白的GO功能富集
表3列出了小海绵羊肚菌在不同Cd浓度处理下DEPs含量最高的6个GO富集功能。0.15mg/L Cd处理组,DEPs显著富集到碳水化合物分解代谢过程,涉及核糖体细胞组件、rRNA结合相关功能的蛋白变化最为显著;0.9mg/L Cd处理下,DEPs显著富集涉及小分子生物合成过程、硫化物代谢过程、硫胺素代谢及生物合成过程等,碳-氮键水解酶活性功能蛋白差异最显著;1.5mg/L Cd处理下,DEPs主要作用于前体代谢物和能量的产生、药物代谢过程、能量耦合质子输运、ATP合成耦合质子传输、细胞呼吸和ATP生物合成过程等。涉及ATP合酶、线粒体或其它相关的膜结构、黄素腺嘌呤二核苷酸结合功能蛋白差异最显著。

2.2.3 差异蛋白的Pathway富集分析
0.15mg/L Cd处理组中DEPs主要参与果糖和甘露糖代谢、核糖体、甲烷代谢、磷酸戊糖途径,其中参与甲烷代谢途径的蛋白质均上调表达;0.9mg/L Cd处理下DEPs主要参与代谢途径、抗生素的合成、硫胺素代谢、氨基酸代谢等通路,参与硫胺素代谢和聚糖降解蛋白质均上调表达;1.5mg/L Cd处理下DEPs主要参与代谢途径,能量代谢、次生代谢产物的合成等通路,参与能量代谢如TCA循环、碳代谢等的蛋白质均上调表达(图4)。
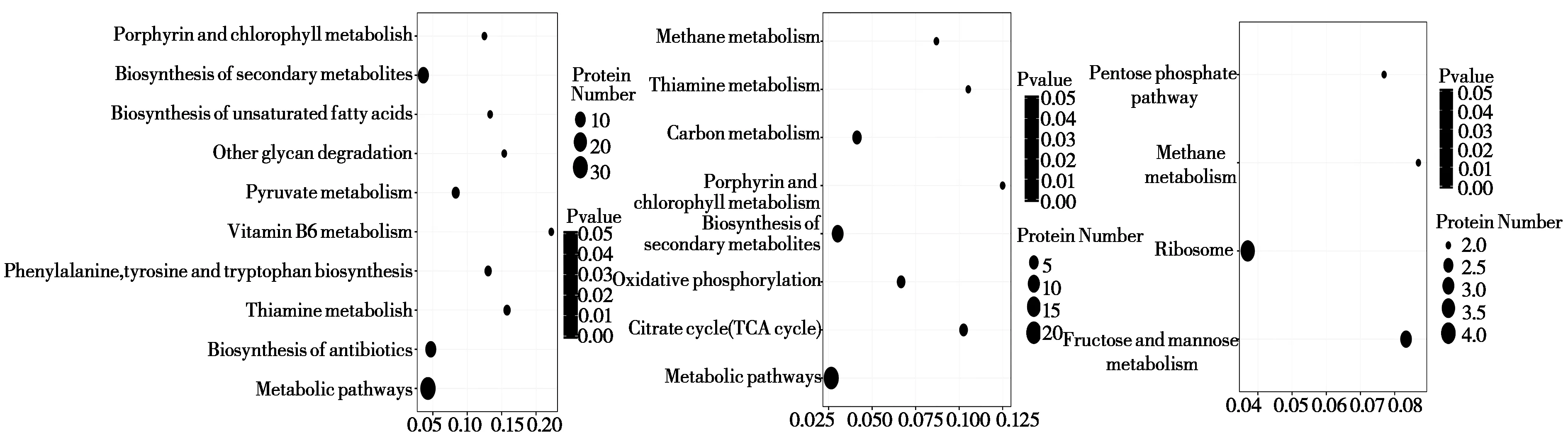
图4 差异表达蛋白Pathway注释富集统计图
2.2.4 差异蛋白亚细胞定位分析
不同Cd处理小海绵羊肚菌DEPs亚细胞定位分布如图5所示:差异蛋白主要集中在胞质溶胶、线粒体、细胞核和细胞外区域。具体来说,0.15mg/L处理组中差异蛋白质主要定位在细胞核中,0.90mg/L处理组中定位于胞质溶胶、线粒体和细胞核的差异表达蛋白较多,1.5mg/L处理组差异蛋白在胞质溶胶、线粒体和细胞外基质中大量表达。

图5 差异表达蛋白亚细胞定位统计图注:extr-胞外基质,plas-质膜,cysk-细胞骨架,cyto-细胞溶质,mito-线粒体,ER-内质网,nucl-细胞核,cytonucl-胞质及核。
2.2.5 qRT-PCR验证
使用2-△△Ct法计算3种浓度镉胁迫下亚硝酸还原酶、甘油醛 3 磷酸盐脱氢酶、核糖蛋白、NADH依赖黄素氧化物酶、含TBP域蛋白等5个基因的表达水平(图6),其与蛋白组数据库丰度变化表现一致,说明蛋白组数据可信。
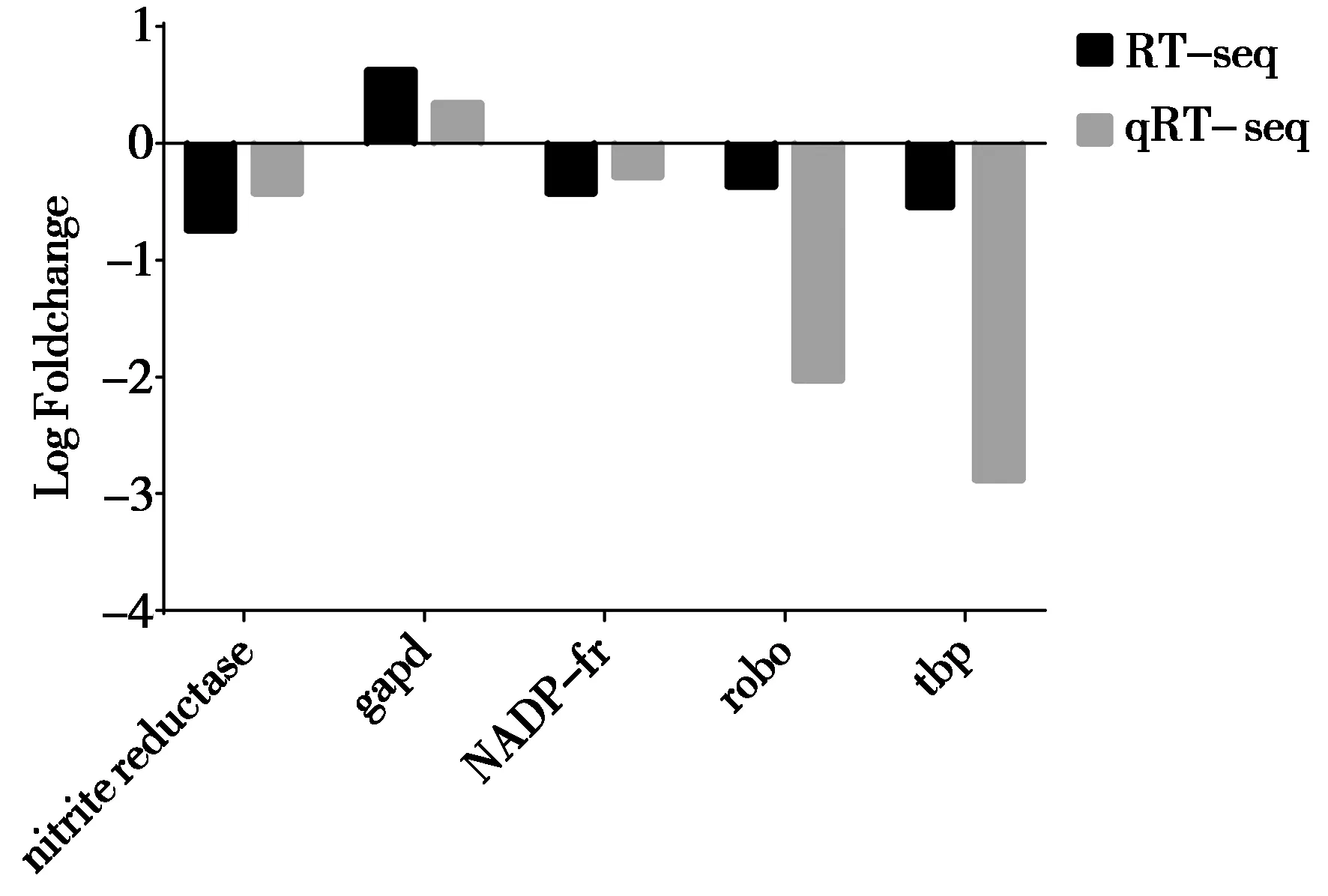
图6 qRT-PCR相对定量分析结果注:nitrite reductase:亚硝酸还原酶;gapd:甘油醛-3-磷酸盐脱氢酶;robo:核糖蛋白;NADP-fr:NADH依赖黄素氧化物酶;tbp:含TBP域蛋白
3 讨论与结论
3.1 小海绵羊肚菌应对Cd环境的关键蛋白
不同浓度Cd胁迫下小海绵羊肚菌有6种蛋白均表现出显著差异,其中β-半乳糖苷酶、延伸因子1-α和细胞色素c氧化酶装配蛋白样蛋白cox15表现为持续上调表达,醛酮还原酶和两个NAD(P)-结合蛋白则表现为持续下调表达。细胞色素c氧化酶被认为是线粒体呼吸的限速步骤,其上调表达可能是一种补偿机制,可以恢复线粒体活性的下降,从而限制Cd对细胞的损伤[18]。ROS是导致细胞损伤的原因之一,外源刺激会阻止胞内正常的电子传递,进一步导致线粒体ROS的形成,而细胞色素c氧化酶作为电子传递链末端的酶复合体的重要组成部分,很容易被ROS攻击导致电子传递中断[19]。由此我们认为,镉胁迫下小海绵羊肚菌细胞色素c氧化酶蛋白的上调表达,有助于中和胞内过量的ROS,减少线粒体内呼吸链上的电子泄漏,防止镉促进的氧化应激。类似由镉胁迫引起的细胞色素c氧化酶I上调表达的情况在双壳类和鲫鱼肾脏细胞中也被发现[20-21]。延伸因子1-α可促进多肽链延伸,参与蛋白翻译、信号传导、细胞凋亡等重要的细胞过程[22]。文献指出,水稻延伸因子1-α基因的转录可被多种外源环境因子所诱导,而外源镉和铜胁迫则容易诱导表达黄孢原毛平革菌菌丝体中的延伸因子1-α亚基[23-24]。本研究中,镉胁迫下小海绵羊肚菌延伸因子1-α被三种浓度镉持续性诱导上调表达,表明延伸因子1-α在小海绵羊肚菌应对外源镉引起的蛋白转录中起到关键作用。β-半乳糖苷酶在很多生物中都有分布,且在生物体内起着重要作用,是大肠杆菌在葡萄糖饥饿条件下乳糖代谢所必需的,也与细胞衰老相关[25-26]。衰老会使生物体β-半乳糖苷酶活性升高,而自由基积累及DNA损伤是细胞衰老最常见的诱因[27-28]。文献指出,外源刺激导致胞内积累过量的ROS,扰乱内质网的正常氧化还原动态平衡,诱导内质网应激,导致细胞自噬、凋亡或衰老[29]。有研究表明,外源氯化镉促进了裂殖酵母中β-半乳糖苷酶的合成[30]。一定浓度氯化镉培养真养产碱杆菌,发现在两个突变菌株中都诱导了β-半乳糖苷酶的表达[31]。小海绵羊肚菌在镉胁迫下,β-半乳糖苷酶持续性的上调表达,可能重点参与应对镉引起的胞内自由基及ROS积累所导致的细胞损伤甚至凋亡、衰老。醛酮还原酶是多元醇代谢通路途径中限速酶之一,参与葡萄糖生成山梨醇的过程,此催化过程需要消耗NADPH,而GR催化生成GSH时也需消耗NADPH,AKR会与GR竞争NADPH,导致减少GSH生成量,影响GSH清除自由基,进一步加剧氧化应激[32-34]。
本研究中,镉胁迫下小海绵羊肚菌醛酮还原酶持续性下调表达,这不仅有利于降低与GST的NADPH竞争,也可能通过限制多元醇代谢通路,进一步减少葡萄糖的消耗,维持细胞正常代谢来应对镉的毒害。此外,多元醇代谢通路第二步是山梨醇脱氢酶将山梨醇氧化成对应的果糖,这会致使氧化应激的出现,因为此过程会消耗NAD+,生成NADH,而NADH是生成ROS的重要底物[35]。在镉胁迫下,小海绵羊肚菌菌丝体中的NAD(P)-结合蛋白持续下调,正是为减少ROS的生成,防止氧化损伤。
3.2 镉胁迫下小海绵羊肚菌菌丝体蛋白调控机制
不同初始浓度Cd胁迫下小海绵羊肚菌菌丝比较蛋白组学分析发现,某些蛋白以及代谢通路的调控呈现出特殊的浓度依赖性,不同浓度处理组差异蛋白数量、代谢通路以及差异蛋白在细胞内的定位都有所不同。首先,膜组分、氮利用以及果糖和甘露糖代谢等生物学过程相关的蛋白主要在0.15mg/L处理组差异上调表达,如肌动蛋白A3b,微管蛋β链,抗增殖蛋白等;通过对0.15mg/L处理组的DEPs进行亚细胞定位,发现该组大多数显著差异蛋白定位到细胞核(图5),表明在0.15mg/L低浓度Cd处理时细胞表面主要利用细胞膜来隔离环境中的Cd,同时也通过加速胞内代谢等方式来保证细胞自身的生长发育。这一阶段细胞对外源Cd调控应答可总结为“胞膜防御应答模式”。其次,抗氧化活性、刺激应答、信号转导等功能的蛋白在0.90mg/L处理组被显著上调表达,其中包括硫氧还原蛋白、HMP合成酶以及glycoside hydrolase/deacetylase,Fructose-bisphosphate aldolase,Methyltransf_25等;亚细胞定位也表示0.90mg/L Cd胁迫下细胞内溶胶、线粒体等的蛋白被差异表达(图5),这表明0.90mg/L Cd已经超出了小海绵羊肚菌细胞膜对环境中Cd的清除能力,部分Cd已穿越细胞膜进入胞内,细胞通过产能合成刺激应答、信号转导以及抗氧化相关蛋白,应对胞内Cd导致的ROS积累以及脂质过氧化等,同时细胞也能产生硫氧还蛋白与胞内游离的Cd结合,改变其毒性价态,以达到缓解胞内氧化损伤的目的。因此,这一阶段细胞对外源Cd调控应答可总结为“胞质代谢应答模式”。最后,1.5mg/L Cd胁迫处理组小海绵羊肚菌菌丝细胞内参与能量代谢、次生代谢产物合成、损伤修复等生物学过程的蛋白被上调表达,与细胞成分及生物发生相关的蛋白均被下调表达,这表明1.5mg/L Cd胁迫环境下,大量Cd进入细胞,导致细胞内积累了大量ROS,诱导细胞产能(TCA循环、氧化磷酸化、叶绿素代谢等)促进各类氧化还原反应,并通过加速次生代谢产物如胞外多糖等的分泌,转移胞内过量的游离Cd。亚细胞定位也验证了次生代谢产物在1.5mg/L处理组的重要作用(图5)。因此这一阶段细胞对外源Cd调控应答可总结为“外排修复应答模式”。

