超声联合血清OPN、IL-1β诊断乳腺癌骨转移的研究
宋 军, 刘 翔
四川省医学科学院·四川省人民医院超声科, 四川 成都 610072
乳腺癌是女性最常见的恶性肿瘤,多年来发病率居高不下,占全身恶性肿瘤的8%~12%[1]。由于早期乳腺癌没有明显的特征,往往被患者忽视,容易错过最佳治疗期。因此,在临床实践中,对乳腺癌的发生提倡“早发现、早治疗”。骨转移是乳腺癌最常见的转移部位,骨转移与预后不良有关,并且在确诊后预期寿命显著缩短至2~3年[2]。超声(US)是诊断恶性肿瘤最常用的影像学方法,具有安全、简便、敏感性高的特点[3],然而,US无法及时检查出微小病变。据报道,肿瘤微环境的组成在肿瘤发展过程中发生变化,并且在不同部位有所不同,监测这种变化有利于肿瘤的早期诊断[4]。肿瘤微环境的组成在肿瘤发展过程中不断发生变化,对癌症进展也有不同的影响。多种信号分子参与了骨转移错综复杂的信号通路网络,包括白细胞介素-1β(IL-1β)、骨桥蛋白(OPN)等,这些信号通路协调了癌细胞和周围间质之间的通信,其中,IL-1β是一种促炎细胞因子,其在原发肿瘤中的表达已被确定为预测乳腺癌患者发生骨转移风险增加的潜在生物标志物[5],同时,乳腺癌患者肿瘤组织和血浆中OPN的高表达与患者的不良预后和生存率降低有关[6]。因此,本研究对US联合血清OPN、IL-1β在乳腺癌骨转移中的诊断价值进行探讨,旨在为乳腺癌的骨转移诊断提供理论依据。
1 资料与方法
1.1 一般资料
2013—2016年,本研究共纳入60例我院确诊并治疗的患者,年龄21~73岁,平均年龄47.65岁。所有患者术前均未接受化疗或放疗。详细记录患者的临床信息。从手术当天开始记录随访时间。该研究得到医院伦理委员会的批准,并根据《赫尔辛基宣言》进行。所有患者签署知情同意书。病理类型分别为:53例浸润性导管癌,3例乳腺导管内癌,2例浸润性小叶癌,2例黏液癌。
1.2 方法
患者均行US检查。使用美国GE LOGIQ-E9型彩色超声波诊断仪进行超声检查,探头频率为3~11 MHz。患者体位根据病变部位调整,通过高频线阵探头扫查,当病变部位范围较大或处于深处时用低频探头补充扫查。全面扫查患者各个部位,充分显示骨肿瘤病变。扫查过程中仔细观察病变的大小、形态、血流、内部回声及周边软组织浸润情况。之后通过彩色多普勒成像观察肿瘤内部及周边血供。将US结果分为4个等级,M0:US未见异常;M1:1~2个骨转移灶;M2:3~5个骨转移灶;M3:大于5个骨转移灶。
诊断骨转移,分为以下几种情况:(a)穿刺活检证实为骨转移;(b)具有恶性肿瘤病史;(c)US检查中显示多发异常放射性浓集灶,多见于中轴骨,随访复查时显示病灶不消退;(d)有骨质破坏或病理性骨折。满足a或b+c、b+d,诊断为骨转移。
血清OPN和IL-1β检测。通过酶联免疫吸附分析法(ELISA)测定患者血清OPN和IL-1β水平,OPN ELISA试剂盒购自青岛捷世康生物科技有限公司,IL-1β ELISA试剂盒购自武汉菲恩生物科技有限公司。
1.3 统计分析
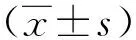
2 结果
2.1 US检查结果
60例乳腺癌患者中,34例证实为骨转移,26例未发现骨转移,骨转移发生率为56.67%(34/60)。34例乳腺癌骨转移患者中,US阳性28例,阴性6例,敏感性为82.35%(28/34)。26例未骨转移患者中,US阴性21例,阳性5例,特异性为80.77%(21/26)。US检查准确性为81.67%(49/60)。
2.2 骨转移和未骨转移患者血清中的OPN和IL-1β水平比较
如表1所示,与未骨转移患者相比,骨转移患者血清OPN和IL-1β水平均显著升高(P<0.001)。

表1 骨转移和未骨转移患者血清中的OPN和IL-1β水平
2.3 US阳性组和阴性组患者血清中的OPN和IL-1β水平
如表2所示,与US阴性组患者相比,US阳性组患者血清OPN和IL-1β水平均显著升高(P<0.001)。

表2 US阳性组和阴性组患者血清中的OPN和IL-1β水平
2.4 不同US分级患者血清中的OPN和IL-1β水平比较
根据US分级将患者分为M0、M1、M2和M3亚组,如表3所示,随着US分级的升高,患者血清OPN和IL-1β水平均逐渐升高(P<0.05)。

表3 不同US分级患者血清中的OPN和IL-1β水平比较
2.5 OPN和IL-1β对骨转移的诊断价值
通过ROC曲线分析OPN和IL-1β对骨转移的诊断价值,OPN诊断骨转移的ROC曲线下面积(AUC)为0.777,敏感性为52.94%,特异性为96.15%;IL-1β诊断骨转移的AUC为0.826,敏感性为82.35%,特异性为84.62%;OPN和IL-1β联合诊断骨转移的AUC为0.857,敏感性为79.41%,特异性为80.77%。见图1。

图1 OPN、IL-1β及二者联合诊断骨转移的ROC曲线
3 讨论
骨转移是一种病理过程,约70%的乳腺癌患者随着疾病的进展而发生骨转移,导致骨痛、病理性骨折、高钙血症、造血功能改变和脊髓受压等后果[2]。到目前为止,这种疾病的转移期还没有有效的治疗方法。深入了解骨转移的机制,寻找与骨转移相关的特定靶点,将促进特定治疗方法的发展。
超声是检测和诊断乳腺癌的常用方法。它可以从多个平面评估病变的形状、大小、内部结构和边缘,并且在以脂肪为主的乳房和紧凑的腺体结构中具有高分辨率[3]。此外,超声检查也已经应用于骨肿瘤及骨转移的诊断中。正常骨骼表面几乎可以反射全部超声波,在骨质破坏的情况下则可显示病变图像。谷英士等[7]研究显示,US诊断乳腺癌腋淋巴结转移的敏感性为74.0%,特异性为64.7%。林盈等[8]运用高频彩色多普勒超声进行研究,发现分别以淋巴结纵横比≤1.8和淋巴结皮髓比≥1.0为截断值,诊断淋巴结转移的敏感性分别为62.4%和62.7%,特异性分别为75.3%和86.4%。本研究中,US诊断骨转移的敏感性为82.35%,特异性为80.77%。本研究结果与其他文献报道结果稍有差异,其原因可能与不同文献的病例数及患者疾病程度和分类有关。此外,本研究还发现,当良性骨肿瘤骨表面不平整、骨皮质不规则增厚等形态学改变时容易被误诊。另外,超声穿透性欠佳,无法充分显示深处结构。上述结果提示,US在诊断骨转移方面存在缺陷,还应该联合其他手段进行乳腺癌骨转移的诊断。
OPN是一种分泌的胞外糖磷蛋白,分子大小为34 kDa,可在破骨细胞、成骨细胞、血管和骨骼平滑肌细胞、内皮细胞、淋巴细胞、神经细胞和某些癌细胞中表达[9]。因此,OPN存在于矿化组织的细胞外基质中,也存在于血液、牛奶、胆汁、精液和唾液等体液中[9]。有研究报道,乳腺癌患者肿瘤组织和血浆中OPN的高表达与这些患者的不良预后和生存率降低有关[6,9]。OPN在骨重建中发挥作用,并介导破骨细胞和骨骼中的矿物质基质之间的相互作用[10]。它与整合素和CD44受体结合,参与细胞-基质相互作用,包括细胞信号传递,并与肿瘤生长和发展以及癌症骨骼转移有关[10]。本研究显示,乳腺癌患者血清中的OPN水平在骨转移患者中明显升高,并且与US阳性和分级有关。结合本研究结果,提示OPN在骨转移中具有重要作用,有可能作为乳腺癌骨转移的早期诊断指标及治疗靶点。
原发乳腺癌细胞IL-1β的表达与疾病复发和骨转移密切相关。一项研究显示,150例初诊II/III期乳腺癌患者的组织阵列中,肿瘤中IL-1β高表达的患者中有37%发生骨转移,而IL-1β阴性的患者中有7%发生骨转移,使用IL-1受体拮抗剂Anakinra抑制IL-1R信号可以减少乳腺癌的骨转移[11]。本研究显示,乳腺癌患者血清中的IL-1β水平在骨转移患者中明显升高,并且与US阳性和分级有关。最近的体外数据表明,IL-1β是与乳腺癌细胞休眠相关的细胞因子。与成骨细胞共培养的人乳腺癌细胞系中,在IL-1β和TNF-α的刺激下,乳腺癌细胞附着在成骨细胞所形成的基质上的生长速度更快[12]。IL-1β已被确定为骨髓间充质干细胞(MSCs)产生趋化因子的主要调节因子。在转移性乳腺癌细胞中的抑制IL-1β导致MSCs不产生趋化因子,而在非转移性乳腺癌细胞中过表达IL-1β会增加MSCs中趋化因子的水平。因此,IL-1β是在肿瘤微环境中驱动趋化因子产生的主要候选因子,而这些趋化因子反过来又维持肿瘤的发展[13]。结合本研究结果,提示IL-1β在骨转移中具有重要作用,有可能作为乳腺癌骨转移的早期诊断指标及治疗靶点。
本研究中,US、IL-1β诊断骨转移的敏感性更高,OPN诊断骨转移的特异性更高,IL-1β诊断骨转移的敏感性和特异性与US相当。因此,US、OPN和IL-1β在诊断乳腺癌骨转移中均具有不同的作用,上述三种参数的联合可能更有利于乳腺癌骨转移的早期诊断。

