黄芩苷抑制脂多糖促巨噬细胞氧化应激损伤作用的研究
黄伟琨 徐秋艳 周婷
贵州省人民医院口腔科 贵阳 550002
牙周炎是成年人缺失牙的重要原因[1],同时也是威胁人类健康的重要疾病[2]。牙周炎的治疗方式主要包括非手术治疗与手术治疗[3],以及局部药物辅助治疗[4]。近年来,中医药在牙周炎局部辅助治疗方面具有独特的优势,受到学者们的重视[5-7]。黄芩苷(baicalin)由于其优良的抗炎及抗氧化应激特性,在心血管疾病[8-9]、肝脏疾病[10-11]的防治方面具有重要作用。但是由于黄芩苷在牙周炎局部药物治疗领域的相关研究尚不充分[12],极大地限制了黄芩苷在牙周炎领域的广泛应用。因此,加强黄芩苷在牙周炎治疗领域的相关基础研究,对于未来将黄芩苷应用于牙周炎的药物辅助治疗具有重要作用。
鉴于氧化应激反应既是牙周炎发生发展的重要分子机制[13],也是牙周炎治疗领域的一个重要作用靶点[14-16],黄芩苷作为强效的抗氧化应激药物,是否能够调控牙周炎的氧化应激状态,目前尚未见相关报道。因此,本研究采用牙龈卟啉单胞菌(Porphyromonas gingivalis,P.gingivalis)的致病因子脂多糖(lipopolysaccharide,LPS)刺激牙周组织重要细胞之一——巨噬细胞[17],构建牙周炎的体外细胞模型,同时采用不同浓度的黄芩苷进行干预,对黄芩苷在P.gingivalis-LPS促巨噬细胞发生氧化应激反应中的作用及相关分子机制进行初步探讨。
1 材料和方法
1.1 主要材料
黄芩苷(Sigma公司,美国);乳酸脱氢酶(lactate dehydrogenase,LDH)、丙二醛(malondialdehyde,MDA)、超氧化物歧化酶(superoxide diamutase,SOD)酶联免疫吸附试剂盒(南京建成生物工程研究所);P.gingivalis-LPS(sigma公司,美国);核因子E2相关因子2(nuclear factor erythroid 2-related factor 2,Nrf2)抗体(Cell Signaling Technology公司,美国);培养基、胎牛血清(Gibco公司,美国);cDNA合成试剂盒、聚合酶链式反应(polymerase chain reaction,PCR)试剂盒(GeneCopoeia公司,美国)。
1.2 人单核巨噬细胞系(human monocytic-leukemia cell,THP-1)来源的巨噬细胞的诱导及处理
THP-1人单核细胞株,购买于中国科学院典型培养物保藏委员会细胞库。细胞培养于含10%胎牛血清的细胞培养基(dulbecco’s modified eagle medium,DMEM)中,培养条件为37℃、5%CO2、饱和湿度。采用课题组前期研究[17]方法,用佛波酯将其诱导成巨噬细胞。P.gingivalis-LPS浓度为10 ng·mL-1,黄芩苷干预浓度分别为5、10 μmol·L-1,根据实验需求分为对照组(未加入P.gingivalis-LPS和黄芩苷的正常细胞组)、LPS组、LPS+黄芩苷(5 μmol·L-1)组及LPS+黄芩苷(10 μmol·L-1)组,培育时间为72 h。
1.3 细胞活性检测试剂盒(cell counting kit-8,CCK8)检测细胞活性
巨噬细胞以每孔5×103个的密度接种于96孔板,并按照上述分组处理后,参照CCK8的操作说明,加入CCK8混合液100 μL,孵育4 h,采用酶标仪测定450 nm波长处每个组的光密度(optical density,OD)。
1.4 LDH的含量
巨噬细胞以每孔5×103个的密度接种于96孔板,并按照上述分组进行处理,处理结束前1 h,往96孔板加入LDH释放试剂,离心后吸取上清液于另一96孔板中,随后加入LDH检测工作液,在室温条件下,孵育30 min后,采用酶标仪检测上清液的OD值,并通过标准曲线换算成LDH含量。
1.5 细胞内活性氧(reactive oxygen species,ROS)含量的检测
细胞根据分组处理后,采用2,7-二氢二氯荧光黄(2,7-dichlorodihydrofluorescein diacetate,DCFADA)荧光探针对巨噬细胞ROS水平进行检测。实验步骤简述如下:加入10 μmol·L-1的DCFA-DA荧光探针,然后继续培养30 min,采用无血清DMEM洗涤细胞2~3遍,使用流式细胞仪对细胞内ROS含量进行检测。
1.6 MDA及SOD活性的检测
按照实验分组处理细胞后,用磷酸盐缓冲液(phosphate buffer saline,PBS)洗涤收集的细胞并用裂解液对细胞进行裂解,随后使用MDA及SOD试剂盒,严格按照试剂盒说明书操作,采用酶标仪对各组的MDA及SOD活性进行检测。
1.7 细胞凋亡的检测
细胞按照分组条件处理后,收集细胞,加入100 μL Binding Buffer,2 μL Annexin V-FITC和2 μL PI混匀,在室温条件下进行孵育,5 min后采用流式细胞仪检测细胞的凋亡数。
1.8 蛋白质印迹法(Western Blot,WB)检测Nrf2的蛋白表达
细胞按照上述分组处理后,弃去上清液,胰酶消化后离心收集细胞,加入100 μL的裂解液,离心15 min,收集细胞总蛋白、胞质蛋白以及胞核蛋白,蛋白经过定量,依次进行电泳、转膜、封闭,洗膜,随后将Nrf2、甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase,GAPDH)、Histone H3抗体按照说明书进行稀释,孵育过夜。充分清洗后,使用二抗室温孵育2 h。随后清洗后显影,分析条带的灰度值,以GAPDH为内参,计算Nrf2总蛋白及Nrf2胞质蛋白的相对表达量,以Histone H3为内参,计算Nrf2胞核蛋白的相对表达量。
1.9 统计方法
采用GraphPad Prism 8.0.2软件对数据进行处理。计量资料采用均数±标准差表示。采用单因素方差分析对各组之间的差异进行比较,P<0.05则认为各组之间的差异具有统计学意义。
2 结果
2.1 黄芩苷对P.gingivalis-LPS致巨噬细胞损伤的影响
P.gingivalis-LPS(10 ng·mL-1)刺激巨噬细胞72 h后,采用CCK8与LDH试剂盒对P.gingivalis-LPS致巨噬细胞的损伤进行检测。结果显示:巨噬细胞的细胞活性受到P.gingivalis-LPS的显著抑制,同时P.gingivalis-LPS的刺激导致细胞LDH含量的上调;不同浓度黄芩苷(5、10 μmol·L-1)进行干预后,则能够显著减轻P.gingivalis-LPS致细胞活性的下降,同时在黄芩苷干预组LDH含量显著下降(图1)。
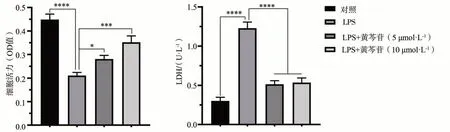
图1 黄芩苷对LPS致巨噬细胞损伤的影响Fig 1 The effects of baicalin on cell injury of LPS on macrophages
2.2 黄芩苷对P.gingivalis-LPS致巨噬细胞氧化应激反应的影响
P.gingivalis-LPS刺激巨噬细胞72 h后,采用DCFA-DA荧光探针、MDA及SOD试剂盒,检测P.gingivalis-LPS对巨噬细胞氧化应激相关指标的影响。结果显示:P.gingivalis-LPS能够显著上调细胞内ROS的含量及MDA的活性,同时导致SOD活性显著下调。通过不同浓度黄芩苷干预后,均能够显著抑制P.gingivalis-LPS导致的ROS和MDA升高,且在浓度为10 μmol·L-1的黄芩苷干预时,SOD活性较LPS组有显著升高(图2)。

图2 黄芩苷对LPS致巨噬细胞氧化应激反应的作用Fig 2 The effects of baicalin on oxidative stress of LPS on macrophages
2.3 黄芩苷对P.gingivalis-LPS致巨噬细胞凋亡的影响
P.gingivalis-LPS刺激巨噬细胞72 h后,采用流式细胞仪检测P.gingivalis-LPS对细胞凋亡的影响。结果显示:P.gingivalis-LPS能够诱发巨噬细胞发生细胞凋亡,不同浓度黄芩苷干预,均能够显著降低P.gingivalis-LPS对细胞凋亡的促进作用(图3)。
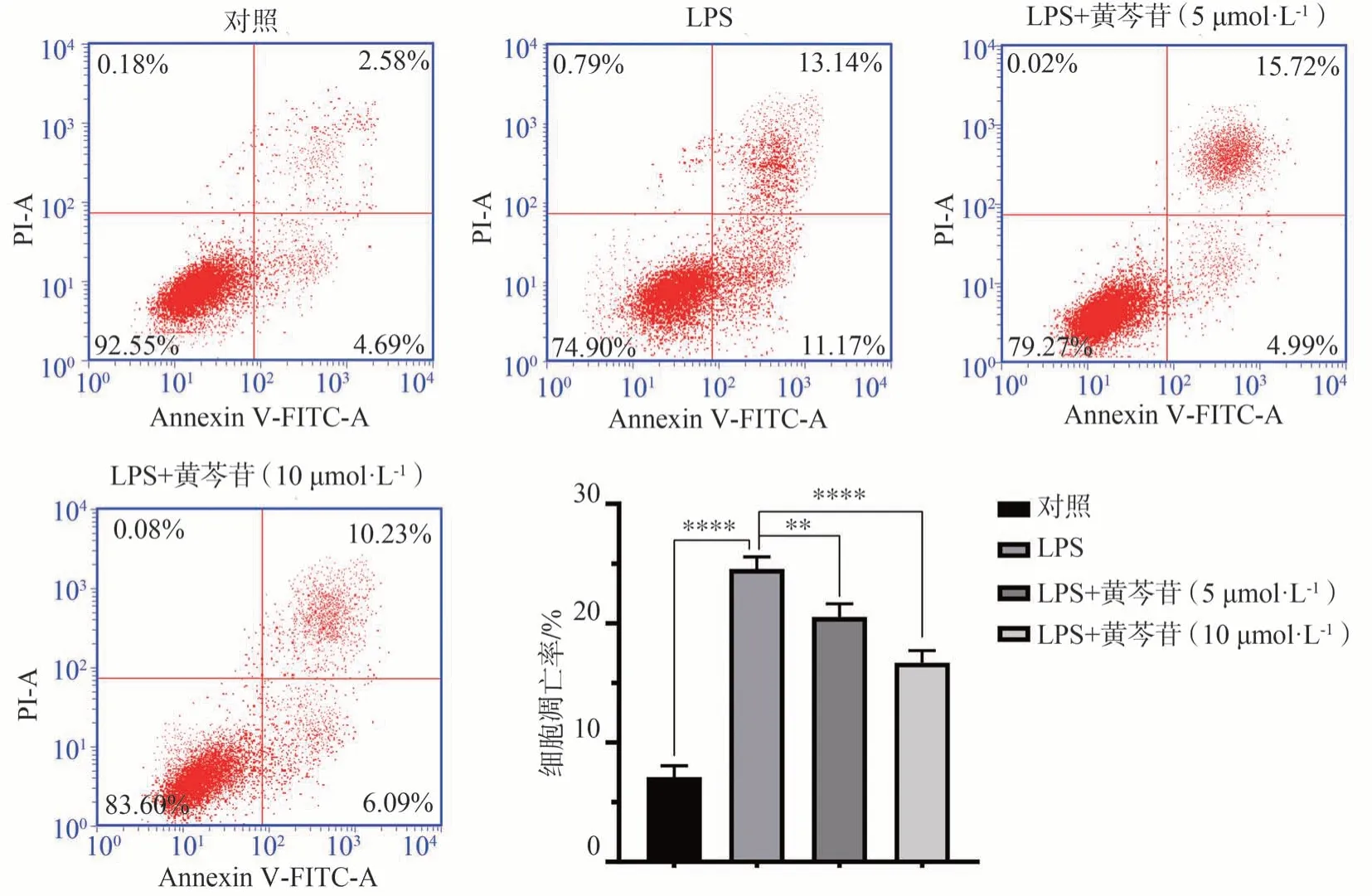
图3 不同浓度黄芩苷对LPS致巨噬细胞凋亡的影响Fig 3 The effects of baicalin on apoptosis of LPS on macrophages
2.4 黄芩苷抑制P.gingivalis-LPS促细胞氧化应激损伤及细胞凋亡的分子机制
P.gingivalis-LPS刺激巨噬细胞72 h后,采用WB检测P.gingivalis-LPS对细胞抗氧化应激重要分子Nrf2表达的影响。结果显示:P.gingivalis-LPS的刺激并不影响细胞Nrf2的总蛋白量、胞质蛋白量及胞核蛋白量的表达。但不同浓度黄芩苷的干预,均能够显著上调细胞胞核的Nrf2表达(图4)。

图4 黄芩苷抑制LPS致巨噬细胞氧化应激损伤及细胞凋亡的分子机制Fig 4 The mechanisms underlying baicalin attenuating LPS-induced oxidative injury of macrophages
3 讨论
本研究采用P.gingivalis-LPS刺激THP-1来源的巨噬细胞来构建牙周炎细胞模型,同时采用不同浓度的黄芩苷对上述细胞模型进行干预,并随后对氧化应激损伤及细胞凋亡相关指标进行了检测。研究结果显示:P.gingivalis-LPS能够促进巨噬细胞发生氧化应激损伤(图1、2),同时促进细胞发生凋亡现象(图3)。现有的研究[18-20]显示:LPS能够促进牙周相关细胞发生氧化应激损伤,最终导致细胞的成骨功能紊乱。在本研究中,黄芩苷的干预能够使ROS的含量下降及MDA的活性减低,且随着干预浓度的增加,ROS的含量和MDA的活性有逐渐降低的趋势,同时在高浓度黄芩苷(10 μmol·L-1)干预时SOD的活性有显著增加,表明黄芩苷能减轻P.gingivalis-LPS对巨噬细胞所造成的氧化应激损伤。研究显示:黄芩苷是强效的抗氧化剂,能够减轻出血性脑损伤的氧化应激水平[21],减轻缺氧缺糖所导致的神经元细胞损伤[22]。抑制高糖导致肾脏的氧化应激损伤[23]。本研究结果与上述研究结果基本一致,提示黄芩苷能够有效抑制牙周炎的氧化应激水平,但黄芩苷的有效干预浓度还需要进一步的研究。
细胞凋亡是一种不同于细胞坏死的死亡方式,它由特定的信号分子启动,在基因调控下,遵循自身的程序而自我消亡的过程。细胞凋亡在牙周病的发生和发展中也起着重要作用。目前认为,氧化应激反应的过度激活会导致细胞凋亡的发生,氧化应激反应激活后产生过多的ROS,ROS通过激活核因子κB(nuclear factor kappa-B,NF-κB)通路、激活丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)途径、造成线粒体损伤、损伤细胞DNA等途径诱导细胞凋亡[24]。本研究结果显示:黄芩苷的干预能显著抑制P.gingivalis-LPS刺激巨噬细胞发生的细胞凋亡,同时ROS的含量也相应下降,提示黄芩苷可能通过抑制氧化应激反应中ROS的产生从而起到抑制细胞凋亡的作用,其具体作用机制还需要进一步的研究。也有研究[25]表明:黄芩苷能够诱导THP-1细胞发生细胞凋亡,可能由于此研究使用的是THP-1单核细胞,并且黄芩苷浓度较高,而本研究的实验条件是P.gingivalis-LPS刺激佛波酯诱导的THP-1巨噬细胞,而且黄芩苷浓度较低,所以本研究没有出现黄芩苷促进细胞凋亡的现象。课题组将在今后的研究中,探讨不同浓度黄芩苷对THP-1单核细胞及THP-1来源巨噬细胞增殖及凋亡的影响。那么黄芩苷对P.gingivalis-LPS促巨噬细胞氧化应激损伤的抑制机制是什么呢?
研究显示:黄芩苷主要通过磷脂酰肌醇激酶/丝氨酸/苏氨酸激酶/Forkhead转录因子FoxO1[26-27]、MAPK/低氧诱导因子-1(hypoxia inducible factor-1,HIF-1)[23,28]、Nrf2[29]等信号通路抑制氧化应激反应。其中Nrf2是抗氧化应激损伤的重要分子[30],同时也是慢性疾病治疗的重要靶点[31]。研究显示:Nrf2既是黄芩苷发挥其生物学效应的重要作用靶点[29],同时也是调控牙周炎发生发展的关键基因[32]。但是黄芩苷是否通过调控牙周组织的Nrf2表达,发挥其抑制牙周炎氧化应激反应的作用,目前尚未见相关报道。因此,课题组对黄芩苷干预下巨噬细胞Nrf2表达的水平变化进行了检测。结果显示:黄芩苷的干预能够显著促进Nrf2的胞核蛋白表达,提示黄芩苷促进了Nrf2的核转位。Nrf2核转位后,能够激活细胞的抗氧化应激系统,从而抑制外界刺激对细胞造成的氧化应激损伤,也抑制了氧化应激反应对细胞其他重要功能的有害影响[33-34]。但P.gingivalis-LPS的刺激对Nrf2的表达没有影响,可能跟本实验采用的LPS浓度较低有关。有研究显示:其他中药也能够通过Nrf2信号通路治疗牙周炎。例如姜黄素能够通过上调Nrf2表达,促进牙周膜干细胞的成骨分化[35];丹参能够通过调节Nrf2信号通路,抑制氧化应激反应[36];橙皮素、丹皮酚也能够通过上调Nrf2的表达,抑制牙周炎的牙槽骨吸收[20,37]。本研究结果与上述研究基本一致。
综上所述,通过本研究能够进一步丰富黄芩苷发挥生物学功效的分子机制,同时也为将黄芩苷应用于牙周炎防治领域提供理论依据。但其抗氧化的具体分子机制,如黄芩苷是如何促进Nrf2核转位,对Nrf2信号通路上的关键信号分子有何影响仍有待进一步的研究。
利益冲突声明:作者声明本文无利益冲突。

