吡咯替尼治疗对老年HER-2阳性晚期乳腺癌患者临床疗效、肿瘤标记物、免疫球蛋白水平及1年生存率的影响
苏 华,赵玉梅,陈 静,蔡莉娜,吴树彪
(1.兰考第一医院,河南 开封 475300;2.郑州大学第二附属医院,河南 郑州 450003)
乳腺癌属于临床发病率较高的一种恶性肿瘤,女性较为常见,大多表现为人类表皮生长因子受体(HER-2)阳性,据统计,有20%左右的乳腺癌患者HER-2呈高表达状态[1]。HER-2阳性晚期乳腺癌具有侵蚀性强的特点,对化疗等治疗存在一定抵抗作用,容易出现肿瘤转移问题,且复发率较高,严重影响患者生活质量[1,2]。本文对90例老年HER-2阳性晚期乳腺癌患者进行研究,旨在探讨吡咯替尼对临床疗效、肿瘤标记物、免疫球蛋白水平及1年生存率的影响,详情如下。
1 资料与方法
1.1 一般资料
选取兰考第一医院2020年1月~2021年10月收治的90例老年HER-2阳性晚期乳腺癌患者作为研究对象,随机分为两组。观察组平均年龄(75.06±5.23)岁,乳腺肿瘤TNM分期:Ⅱb 24例,Ⅲa 12例,Ⅲb 9例,原发肿瘤灶:PR或ER阳性且HER-2阳性28例,PR或ER阴性而HER-2为阳性13例,PR、ER、HER-2阳性而转移灶PR阴性、ER阴性、HER-2阳性4例,内脏转移部位:脑转移11例,肝转移18例,肺转移16例;对照组年龄平均年龄(75.12±5.25)岁,乳腺肿瘤TNM分期:Ⅱb 26例,Ⅲa 11例,Ⅲb 8例,原发肿瘤灶:PR或ER阳性且HER-2阳性30例,PR或ER阴性而HER-2为阳性12例,PR、ER、HER-2阳性而转移灶PR阴性、ER阴性、HER-2阳性3例,内脏转移部位:脑转移10例,肝转移20例,肺转移15例。两组基线资料方面比较无统计学差异(P>0.05),具有可比性。
1.2 方法
两组患者均给予多西他赛注射液(江苏奥赛康药业股份有限公司,国药准字H20103653)治疗,加入至250 mL 0.9%氯化钠溶液中混匀后静脉滴注,滴注时间控制在24 h内,用药频率为3周/次,用药剂量为100 mg/m2。对照组给予注射用曲妥珠单抗(上海罗氏制药有限公司,国药准字J20110020)治疗,加入至0.9%氯化钠溶液中混匀,以静脉滴注的方式进行用药,用药频率为4周/次,用药剂量为根据体重进行确定,8 mg/kg。观察组给予马来酸吡咯替尼片(江苏恒瑞医药股份有限公司,国药准字H20180013)治疗,餐后30 min口服,用药频率为1次/d,用药剂量为320 mg/次。两组均连续用药4个疗程,共4个月。
1.3 观察指标[3,4]
临床疗效:完全缓解(CR):肿瘤病灶完全消失,临床症状明显改善;部分缓解(PR):肿瘤病灶直径缩小>50%,临床症状明显改善;疾病稳定(SD):肿瘤病灶直径缩小<50%或增大<25%,临床症状轻微缓解或无变化;疾病进展(PD):肿瘤病灶明显增大,临床症状明显加重。疾病控制率(DCR)=(CR+PR+SD)/例数×100%。肿瘤标记物:治疗前及治疗4个月后对两组患者晨起空腹静脉血(5 mL)进行采集,设置离心机转速为3 000 r/min,半径设置为40 cm,时间设置为15 min,将血液标本置于离心机中进行离心反应后将上层清液取出,使用多模式微孔板酶标仪(生产厂家:En-SightTM,型号:PerkinElmer)以酶联免疫吸附法对血清中:糖类抗原19-9(CA19-9)、糖类抗原125(CA125)、糖类抗原153(CA153)、癌胚抗原(CEA)水平进行测定;使用全自动酶免疫分析仪(生产厂家:美国Beckman,型号:AIA-1800型)通过电化学发光微粒子免疫分析法对血清中组织多肽特异性抗原(TPS);使用全自动酶标仪(生产厂家:美国Bio-Kinetics仪器公司,型号:FL-312e)通过酶联免疫吸附法对血清中骨桥蛋白(OPN)水平进行测定;使用散射比浊仪(生产厂家:德国都灵,型号:BN2)通过免疫散射比浊法测定血清β2-微球蛋白(β2-MG)。免疫球蛋白水平:分别抽取两组患者晨起空腹静脉血3 mL,以3 000 r/min转速离心15 min后取出上层清液,置于-20℃冰箱内冷藏、保存,使用发光免疫分析仪(生产厂家:贝克曼,型号:DXI800)通过免疫透射比浊法对血清中免疫球蛋白M(IgM)、免疫球蛋白G(IgG)、免疫球蛋白A(IgA)水平进行测定。1年生存率:观察并记录两组患者1年生存率,生存率=生存例数/例数×100%。
1.4 统计学方法
2 结果
2.1 两组临床疗效比较(见表1)
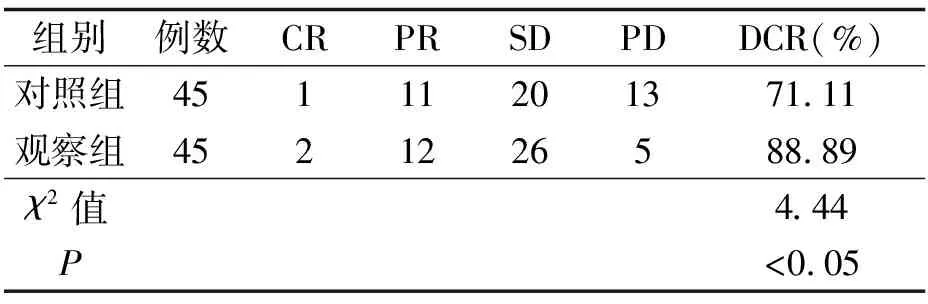
表1 两组临床疗效比较 例
2.2 两组肿瘤标记物比较(见表2)

表2 两组肿瘤标记物比较
2.3 两组免疫球蛋白水平比较(见表3)

表3 两组免疫球蛋白水平比较 g/L
2.4 两组1年生存率比较(见表4)

表4 两组1年生存率比较 例
3 讨论
在乳腺癌的治疗中,曲妥珠单抗为常用药物,虽然能够对HER-2的表达发挥一定的抑制作用,但易导致耐药性的产生,影响治疗效果,部分患者还会出现恶心、腹泻等一系列不良反应,对患者肿瘤的控制效果不佳。吡咯替尼作为小分子酪氨酸激酶抑制剂,能够全面地对HER家族同/异源二聚体下游通路进行阻断,其作用机制与曲妥珠单抗不同,即使患者存在曲妥珠单抗存在耐药性,使用吡咯替尼也可产生较强的抗肿瘤效果[1,3]。本研究中,在DCR上,观察组与对照组相比明显更高;在1年生存率上,观察组与对照组相比更高,说明吡咯替尼在提高临床疗效、1年生存率上效果更好。
恶性肿瘤的发生与发展与机体免疫功能存在密切关系,通过免疫功能的高低能够对机体抵抗病原菌的入侵能力进行有效判断。通过观察IgM、IgG、IgA水平能够对乳腺癌的病情进行有效判断。本研究结果显示,在IgM、IgG、IgA水平上,两组治疗后与治疗前相比更低,观察组与对照组相比更低,充分说明吡咯替尼能够促进患者免疫球蛋白水平的改善,促进患者免疫功能的提高。
在肿瘤发展过程中,由于恶性肿瘤细胞的刺激及分泌能够使宿主细胞发生反应,在肿瘤患者的血液组织及排泄物中产生一定物质,该类物质能够对肿瘤患者的病情进行有效评估,因此被称为肿瘤标记物。常见的肿瘤标记物包括CA19-9、CA125、CA153、CEA等。本研究结果显示,在CA19-9、CA125、CA153、CEA、TPS、OPN、β2-MG水平上,两组治疗后与治疗前相比明显更低,观察组水平与对照组相比明显更低,提示吡咯替尼更有利于肿瘤标志物水平的改善。究其原因,吡咯替尼能够同时对HER-1、HER-2、HER-3三个靶点发挥抑制作用,加之具有共轭双键结构,能够与ATP结合位点产生永久反应,且作用无法逆转,可起到较强的抗肿瘤作用。
综上所述,HER-2阳性晚期乳腺癌患者给予吡咯替尼治疗,能够促进临床疗效的提高,改善肿瘤标记物及免疫球蛋白水平,提高1年生存率,值得临床推广。

