经肛门取标本的腹腔镜直肠癌根治术治疗中高位直肠癌的临床效果
洪晓哲
(揭阳市人民医院普通外科一区,广东 揭阳,522000)
结直肠癌是常见的消化道恶性肿瘤,其发病与遗传、社会环境、饮食习惯及生理状态等因素相关,临床症状有大便习惯改变、粘液便、便血及肛门坠胀,也有部分患者因合并肠梗阻就诊时才确诊结直肠癌。随着国人饮食习惯逐渐向高热量、高脂肪、少纤维素的方向转变,我国结直肠癌的发病率及病死率有上升的趋势。目前,恶性肿瘤的治疗有手术治疗、放疗、化疗、靶向治疗及免疫治疗等手段,但手术治疗仍是直肠癌最主要的治疗方法。上世纪80年代,全系膜切除术(TME)理论首次提出,如今已经被广泛应用于直肠癌根治术中[1],腹腔镜直肠癌TME术的应用尤为广泛。经自然腔道取标本(NOSES)技术是直肠癌手术的一个新进展,其与腹腔镜直肠癌TME术相结合后更好地凸显了“微创”“无切口”等优势,整体技术渐趋成熟,临床开展越来越多。本研究探讨了经NOSES腹腔镜直肠癌根治术的临床疗效,报告如下。
1 资料与方法
1.1 一般资料
选取2017年7月至2021年6月揭阳市人民医院普通外科收治的直肠癌患者40例,其中20例接受经NOSES癌根治术切除手术治疗,归为观察组;20例接受腹腔镜辅助小切口直肠癌根治性切除术,归为对照组。
2组性别、平均年龄、肿瘤距肛门距离、肿瘤最大直径、肿瘤病理分期(pTNM)、体重指数(BMI)等基线资料比较,差异无统计学意义(P>0.05),具有可比性,见表1。
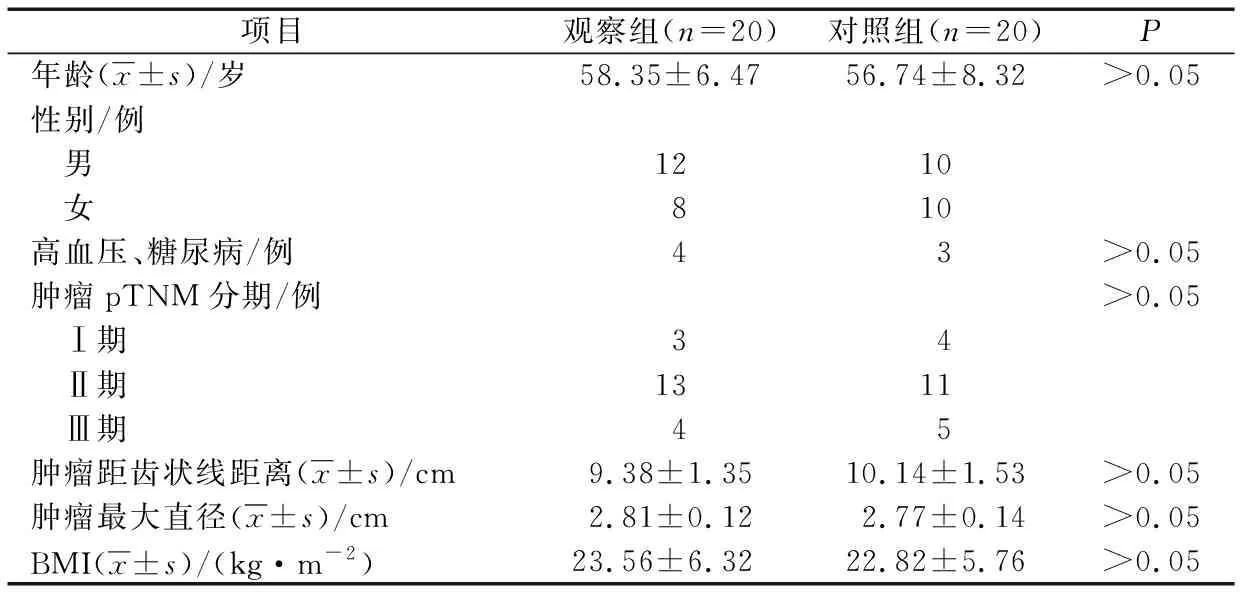
表1 2组基线资料比较
纳入标准:1)手术前结肠镜及病理检查确诊为直肠癌;2)肿瘤距离齿状线≥5 cm;3)术前CT检查排除肺部、肝脏等远处转移,同时影像学评估肿瘤可以手术切除;4)心、肺、肝、肾等重要脏器功能正常;5)未经放疗或新辅助化疗;6)病灶直径不超过3 cm。排除标准:1)结直肠多发恶性肿瘤者;2)低位直肠癌或结肠癌者;3)肿瘤有肺部、肝脏等远处转移者,影像学评估显示肿瘤难以手术者;4)心、肺、肝、肾等重要脏器功能不全,无法耐受手术者;5)有腹部手术史、肿瘤新辅助化疗史者;6)体型肥胖者(BMI>30)。
1.2 治疗方法
1.2.1 术前准备
2组手术前均予完善相关检查(血常规、粪便隐血试验、肝肾功能、凝血功能、心电图、胸腹部CT、肿瘤标志物等),并评估心肺功能。手术前1 d晚上口服泻药以清洁肠道,手术当天早晨留置尿管,手术前30 min使用抗生素。
1.2.2 麻醉、体位及Trocar位置
2组均使用气管内插管麻醉,采用改良截石位。脐上缘置入10 mm Trocar作为观察孔,右髂前上棘内侧1~2 cm处置入12 mm Trocar作为主操作孔,脐水平右腋前线处、左侧反麦氏点各置入5 mm Trocar作为副操作孔。
1.2.3 手术治疗方法
观察组给予经肛门取标本腹腔镜直肠癌根治术。先探查有无腹腔内种植、转移,确定肿瘤位置、大小,评估肠系膜厚度、长度。于骶骨岬下方将系膜切开,进入Toldts间隙,向上游离直到肠系膜下动脉及其分支可以充分显露,结扎并切断肠系膜下动脉、静脉,并清扫周围的淋巴组织。按照腹腔镜直肠癌TME手术规范分离乙状结肠系膜、左侧侧腹膜,充分游离直肠、乙状结肠、降结肠,必要时游离结肠脾曲。在距肿瘤上缘10 cm、下缘约3~5 cm预切线处切开肠系膜,并祼化该处的肠管,同时修剪好肠系膜。于肿瘤近端10 cm处切断乙状结肠,碘伏消毒肠腔,周围垫纱布以免污染。会阴组手术医师充分扩肛,以碘伏冲洗肛门、直肠,腹腔内切开肿瘤远端直肠,经肛门送入吻合器底钉座,底钉座置入乙状结肠近断端,尖端从断端近端3 cm处肠壁穿出,后以可弯曲的直线型切割闭合器闭合乙状结肠残端。再从肛门置入保护套,伸入卵圆钳将肿瘤、肠管及其系膜拖至肛门外,于肿瘤远端3~5 cm处切断直肠,标本完整切除。闭合直肠残端,经肛门置入吻合器主杆,将其与底钉座对合套紧后扣动板手,完成吻合。
对照组给予小切口辅助肠腔镜直肠癌根治术。肿瘤及肠管的游离、淋巴组织的清扫方法与观察组相同。待肠管游离及淋巴组织清扫完成后,于肿瘤下3~5 cm处以直线型切割闭合器切断直肠,并裸化肠管。取下腹正中5~7 cm切口进入腹腔。将肿瘤及游离好的肠管拖出体外,于肿瘤上15 cm处切断乙状结肠,断端置入吻合器底钉座并荷包缝合固定,裁剪好肠系膜后将乙状结肠放回腹腔,缝合切口。肛门以碘伏消毒,置入吻合器主杆,将其与底钉座对合套紧后扣动板手,完成吻合。
1.2.4 术后处理
2组术后常规予吸氧、心电监护,预防性使用抗生素至术后72 h,行肠外营养。胃肠恢复蠕动后,逐步从少量流质饮食至半流质饮食。注意观察引流液体情况,并依引流情况决定拔除引流管时间。
1.3 观察指标
记录2组手术相关指标(手术时间、肛门恢复排气时间、术中出血量、淋巴结清扫数目)、并发症发生情况(吻合口漏、肠梗阻、吻合口出血、腹腔内感染)以及术后第1、3、5 d切口的疼痛视觉模拟评分(VAS)。
1.4 随访
所有患者出院后定期随访,采用门诊及微信方式进行随诊。微信随访的内容包括患者的饮食、大便情况,询问有无腹胀、腹痛等症状。门诊随访时,行腹部体格检查及肛门指检,复查胸片、血常规、肿瘤标志物等,每半年行腹部CT扫描1次。
1.5 统计学方法
2 结果
2.1 2组手术相关指标及VAS评分比较
观察组手术时间明显长于对照组,但肛门回复排气时间短于对照组(均P<0.05);观察组术后第1、3 d VAS评分显著低于对照组(P<0.05)。观察组术后第5天VAS评分、术中出血量、清扫淋巴结数量与对照组比较,差异无统计学意义(P>0.05)。见表2。
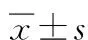
表2 2组手术相关指标及VAS评分比较
2.2 2组并发症比较
观察组出现1例吻合口漏、2例腹腔内感染;对照组出现2例吻合口漏、3例腹腔内感染,2组均无肠梗阻及吻合口出血病例。吻合口漏及腹腔内感染患者经保守治疗(保持引流通畅,加强营养,使用抗生素)后,均痊愈。2组术后并发症发生率比较,差异无统计学意义(P>0.05)。见表3。

表3 2组并发症比较 n(%)
3 讨论
相较于传统开腹手术,腹腔镜下直肠癌根治术具有创伤小、恢复快、并发症少等优点,同时还兼具保持手术部位美观的作用,二者在手术疗效及预后方面并无差异。传统的腹腔镜辅助直肠癌根治术需要在腹部作小切口进行辅助操作,即使是完全腹腔镜直肠癌根治术也需要切开腹部取出标本,对腹壁仍存在创伤,同时影响术后患处美观。
NOSES术式的特点是通过人体自然腔道取出标本,这避免了从腹部切开取标本给患者带来的创伤,降低切口感染、切口疝、切口下肠粘连及肿瘤细胞切口种植等次生风险[2-4]。NOSES主要有经肛门取标本和经阴道取标本两种途径。《结直肠肿瘤经自然腔道取标本手术专家共识》(2019版)中指出,经肛门途径相对于经阴道途径更为实用、可靠,可以避免取标本对女性阴道的额外损伤,更加符合微创手术的要求[5]。
本研究发现观察组手术时间长于对照组,赵丹等[6]认为其原因在于NOSES术中对肠管的裸化、肠系膜的修剪、标本的取出等手术操作较为繁琐,笔者认为术者的学习曲线较长也是原因之一。张陈等[7]指出NOSES的术后患者疼痛程度比腹腔镜辅助手术更轻,本研究数据显示术后第1、3 d观察组的VAS评分明显低于对照组,与其观点一致。这可能是因为体表神经对切割更为敏感,腹壁切口的存在加重了患者的疼痛程度。观察组术后肛门恢复排气时间短于对照组,这与多数学者观点一致[8-10]。其原因考虑有以下2点:1)术后早期活动是促进胃肠道功能恢复的重要因素,而腹部切口引起的疼痛限制了患者下地活动;2)腹部切口增加了腹腔内肠管暴露于空气中的时间,可能增加肠管炎症介质的产生,影响肠管的蠕动。在术后吻合口漏、腹腔感染、吻合口出血及淋巴结清扫数目方面,观察组与对照组没有差异,表明NOSES术式在围手术期的安全性及肿瘤手术治疗的根治性方面与腹腔镜辅助手术方式差别不大,结论与尹义学等[11]观点相同.
虽然经肛门手术有增加围手术期感染的可能,但NOSES术前进行充分肠道准备、围手术期预防性使用抗生素、手术中用碘伏稀释后进行肛门及腹腔冲洗等方法,可以有效降低发生腹腔感染的风险[12]。术中避免对肿瘤进行挤压,标本及时放入保护袋可以减少肿瘤种植的概率。虽然本研究只对经肛门NOSES术式的近期疗效进行了探索,未涉及长期预后,但已经有学者研究证明,NOSES术式患者在术后无病生存率及总生存率上,与经典的腹腔镜辅助直肠癌根治术无差异[13-14]。
综上所述,在中高位直肠癌的手术治疗中,腹腔镜下经肛门NOSES术较小切口腹腔镜辅助直肠癌根治术对患者创伤更小,术后恢复更快,疼痛程度更轻,同时具有相同的安全性及肿瘤根治性。

