水稻发芽期和芽期耐冷性QTL定位
赵宏伟,王 皓,陈子琪,郑洪亮,刘化龙,韩笑,2,杨洛淼,辛威,王敬国
(1.东北农业大学,寒地粮食作物种质创新与生理生态教育部重点实验室,哈尔滨 150030;2.黑龙江省农业科学院佳木斯水稻研究所,黑龙江 佳木斯 154026)
水稻是重要粮食作物,具有较高产量潜力,对满足我国粮食需求非常重要[1]。直播稻作为轻简化栽培方式,免去育苗、移栽等操作,具有节约土地面积、降低劳动成本等优点,占我国水稻播种面积10%以上[2]。由于直播稻长期处于淹水条件,播种期较早,对品种耐低氧和耐低温能力要求较高,易受发芽期和芽期低温冷害影响,常出现发芽率低、成苗率低和出苗不整齐现象,影响水稻直播技术应用[3]。定位影响水稻发芽期和芽期耐冷性基因位点,对解析耐冷性遗传基础、开发特异分子标记、创制耐冷新种质、保证水稻安全生产具有积极意义。
数量性状个体间差异微小,呈连续变异,受环境因素影响较大[4]。杨梯丰等研究表明,水稻耐冷性受多个QTL控制,不同时期可能存在不同耐冷性QTL[5]。姚晓云等以龙稻5号和中优早8为亲本构建RIL群体,在2、7、8、11、12号染色体上检测到5个与发芽率相关QTL,表型贡献率为6.41%~9.41%[6]。王琪等利用泸恢99和沈农265杂交衍生重组自交系群体,以发芽率为指标,检测到2个与发芽期耐冷性相关QTL位点,其中qLTG-5表型贡献率最大(14.07%)[7]。宋佳利用295个水稻品种组成的自然群体为试验材料,在第4、6、8号染色体上共检测到4个与相对发芽势相关QTL,其中qLTGP4-1贡献率最大(10.87%)[8]。任永梅利用IR36和J07-23为亲本构建回交重组自交系群体,在第1、2、3、5、6、7、9、11号染色体上,检测到12个与平均发芽天数相关QTL[9]。杨洛淼等以粳稻品种空育131和东农422为亲本,构建190个家系重组自交系群体,在6号和12号染色体上分别检测到1个与发芽峰值和发芽系数相关QTL[10]。张露霞等以Asominori和IR24为亲本构建重组自交系群体,在第5、12号染色体上检测到3个与芽期耐冷性相关QTL[11]。Luo等利用229个株系回交重组自交系,检测到15个与低温存活率和死亡率相关QTL,分别位于6、7、8、11、12号染色体上,可解释5.99%~40.07%表型变异[12]。刘欣等以耐冷性差异明显的藤坂5号和江西丝苗为亲本,构建137个株系F2代分离群体,在8号和11号染色体上检测到2个与耐冷级别相关QTL[13]。Chen等利用Zhenshan97B和AAV002863构建DH群体,以发芽率为指标,在1号和10号染色体上检测到一对上位性QTL,占表型变异5.96%[14]。刘睿琦等利用五丰B和昌恢T025杂交衍生重组自交系群体,以芽期存活率为指标,检测到12对上位性互作QTL,贡献率为4.68%~4.76%[15]。
综上,前人对水稻发芽期和芽期耐冷性研究已取得一定进展,主要以籼粳杂交衍生RIL群体为试验材料,对粳粳杂交衍生RIL群体相关研究较少。本试验以耐冷性较强粳稻品种空育131为母本和耐冷性较弱粳稻品种小白粳子为父本杂交衍生含有195个株系的RIL群体为试验材料,结合遗传图谱,检测发芽期和芽期耐冷性QTL,以期发现控制水稻发芽期和芽期耐冷性QTL,为解析耐冷性遗传基础、开发特异分子标记、创制耐冷新种质提供依据,推动水稻直播生产发展。
1 材料与方法
1.1 试验材料
本研究以粳稻品种空育131为母本,粳稻品种小白粳子为父本,通过“单粒传”法杂交衍生含有195个株系RIL群体为试验材料。
1.2 遗传图谱构建
采用CTAB法提取RIL群体和亲本DNA[16],由博睿迪生物公司采用10K Array基因芯片进行分析,去除冗余标记,将基因型相同且连续的单核苷酸多态性标记记为一个Bin标记。使用QTL Ici-Mapping 4.2软件MAP功能构建遗传图谱。
1.3 发芽期耐冷性鉴定
采用高温干燥方法打破RIL群体和亲本休眠,1%次氯酸钠浸种消毒30 min并用蒸馏水清洗2~3次,选取100粒饱满种子置于垫有滤纸培养皿中,放入13℃恒温培养箱中低温处理,另选取100粒饱满种子采用相同处理作为对照,设置3次重复。种子萌发标准参考Wang等方法[17],记录每日发芽数,直至连续3 d发芽数为0结束。参照周志彬等方法测定相对发芽率、发芽势、平均发芽天数和发芽系数[18]。
1.4 芽期耐冷性鉴定
从RIL群体和亲本中分别选取100粒饱满种子置于垫有滤纸培养皿中,于30℃恒温培养箱中催芽,待芽长5~8 mm时,选取长势一致种子48粒,参考陈子琪等方法播种[19],放入3℃培养箱中低温处理10 d,再放入26℃光照培养箱中恢复7 d,设置3次重复。采用韩龙植等方法测定成苗率[20],采用姜树坤等方法测定耐冷级别[21]。
1.5 QTL分析
利用QTL IciMapping4.2软件进行QTL定位,以LOD值≥2.5作为判断加性QTL是否存在的阈值,以LOD值≥5作为上位性QTL是否存在的阈值,采用McCouch方法作QTL命名[22]。
1.6 数据处理与分析
采用SPSS 22.0作单因素方差分析,使用Origin 2021绘制图表。
2 结果与分析
2.1 遗传连锁图谱构建
基于527个Bin标记,使用JoinMap 4.0构建长度为1 875.57 cM连锁图谱,标记间距离平均值为3.56 cM。3号染色体标记数最少,1号染色体标记数最多,分别为24个和79个;12号染色体上标记间平均距离最短,仅为2.27 cM,3号染色体上标记间平均距离最长,为8.13 cM(见图1和表1)。
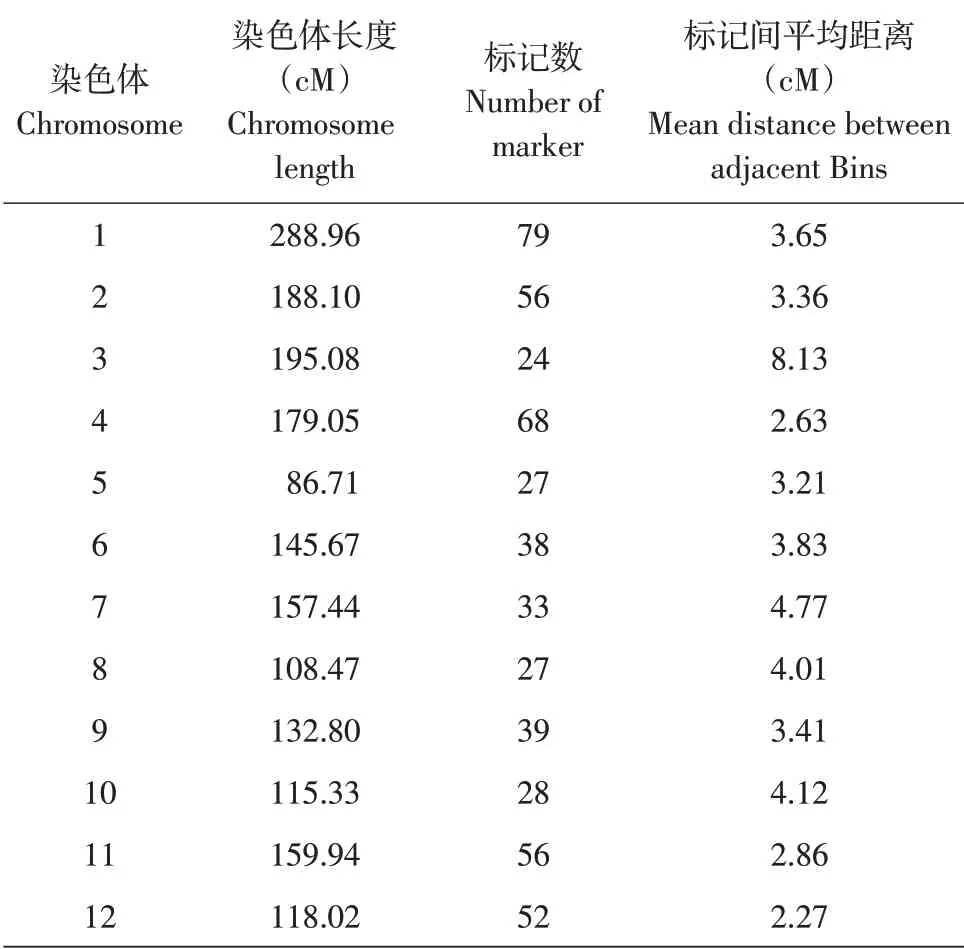
表1 染色体标记信息Table 1 Bin markers locating on chromosomes

图1 耐冷性相关QTL在染色体上分布情况Fig.1 Chromosome distribution of QTL related to cold tolerance
2.2 发芽期和芽期耐冷表型分析
亲本空育131耐冷性强于小白粳子,二者在发芽期相对发芽率、发芽势、平均发芽天数、发芽系数、芽期成苗率、耐冷级别等指标上均差异显著。RIL群体中各株系发芽期和芽期相关指标均呈连续分布,且存在明显超亲分离现象。耐冷级别变异系数最大(27.56%),发芽系数变异系数最小(12.68%)。发芽期相对发芽率、发芽势、平均发芽天数和发芽系数及芽期成苗率、耐冷级别偏度和峰度绝对值大部分小于1,说明各指标表型数据基本符合正态分布规律(见表2和图2)。
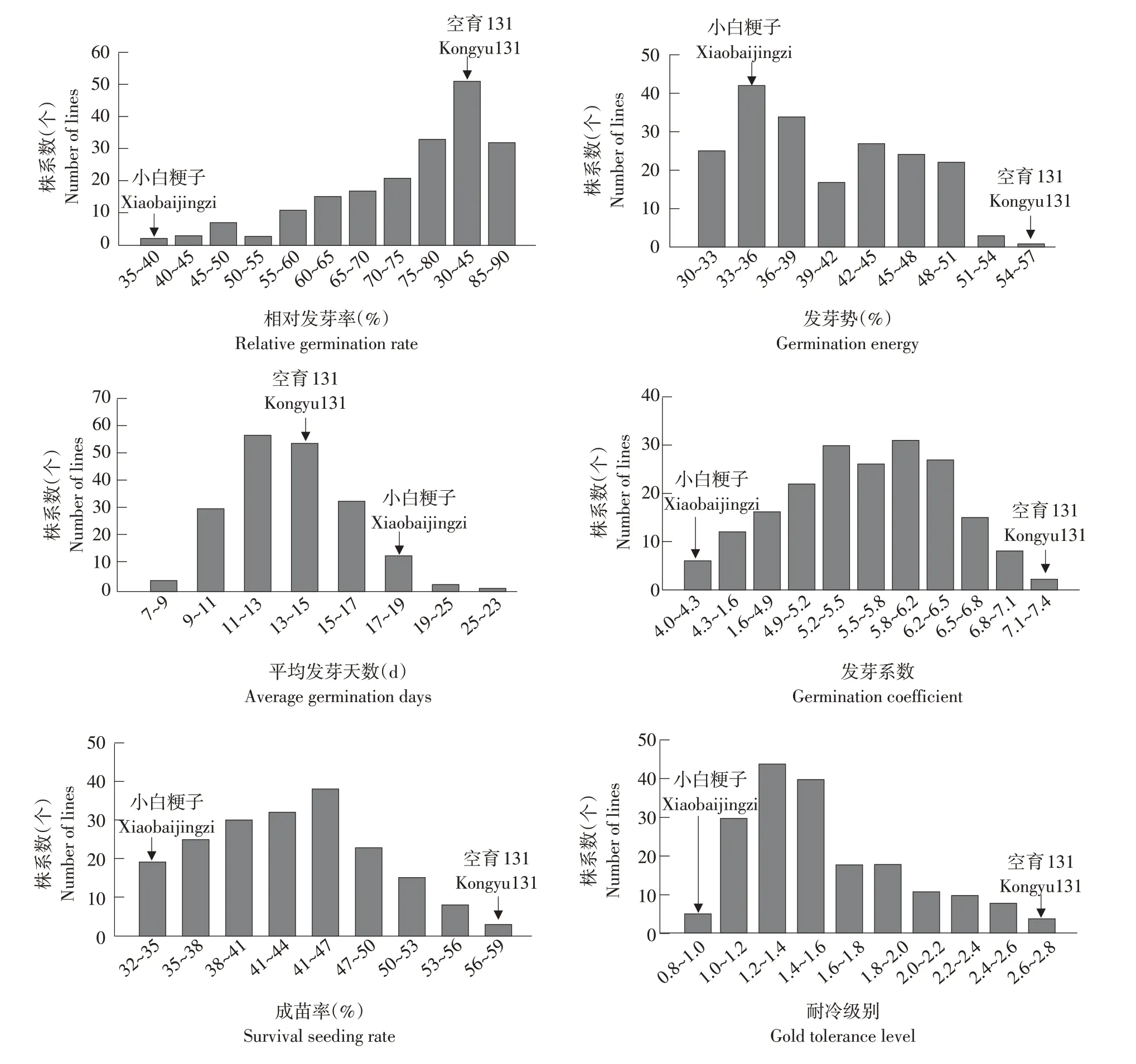
图2 发芽期和芽期耐冷性分布Fig.2 Distribution of cold tolerance at germination and bud stages

表2 发芽期和芽期耐冷性在亲本和RIL群体中分布情况Table 2 Distribution of cold tolerance in parents and RIL populations at germination and bud stages
2.3 发芽期和芽期耐冷性表型相关分析
发芽期和芽期耐冷性各性状间相关分析表明:相对发芽率、发芽势和发芽系数间均呈极显著正相关,与发芽天数呈极显著负相关。成苗率和耐冷级别均与相对发芽率、发芽势和发芽系数呈负相关,与平均发芽天数呈正相关。成苗率与耐冷级别呈极显著正相关(见图3)。

图3 发芽期和芽期耐冷性相关分析Fig.3 Correlation analysis of cold tolerance between germination and bud stages
2.4 发芽期和芽期耐冷性QTL定位
发芽期和芽期耐冷性相关分析结果如表3所示。检测到7个与发芽期耐冷性相关QTL,分别控制芽期相对发芽率、发芽势、平均发芽天数和发芽系数,可解释4.25%~8.30%表型变异。qRGR3和qGE6分别控制相对发芽率和发芽势,可解释8.30%和7.38%表型变异,增效等位基因均来源于空育131。控制平均发芽天数的4个QTL中,qAGD1和qAGD2增效等位基因来源于小白粳子,qAGD7和qAGD11增效等位基因来源于空育131,以上4个位点可解释表型变异26.09%。与发芽系数相关qGC3可解释表型变异7.03%,增效等位基因来源于空育131。
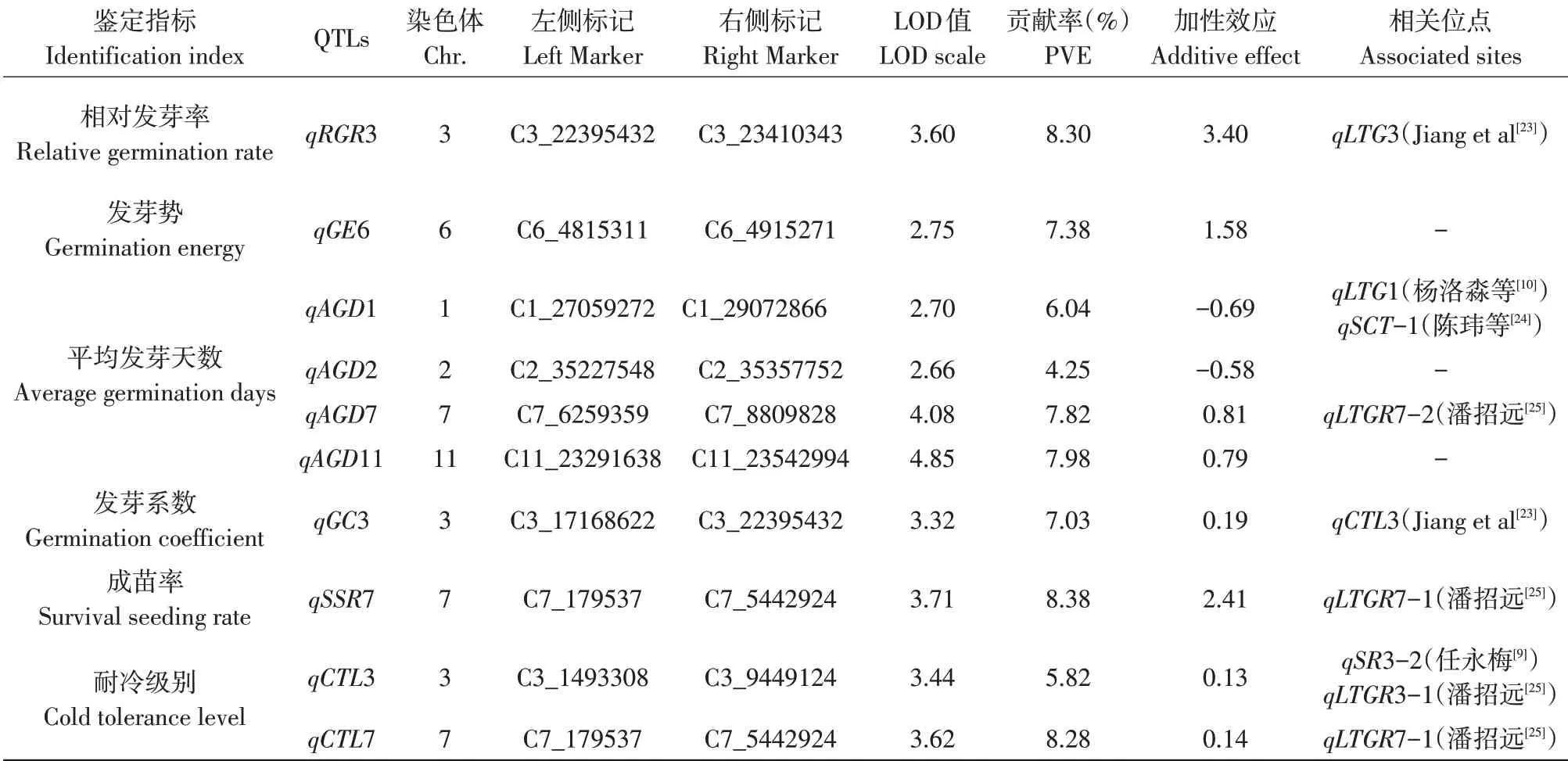
表3 水稻发芽期和芽期耐冷性相关QTLTable 3 QTL related to cold tolerance at germination and bud stages of rice
检测到3个与芽期耐冷性相关QTL,分别控制水稻成苗率和耐冷级别,其中1个与成苗率有关,2个与耐冷级别有关。控制芽期成苗率qSSR7,其增效等位基因来源于空育131,可解释8.38%表型变异。控制耐冷级别的qCTL3和qCTL7,可解释14.1%表型变异,其增效等位基因均来源于空育131(见表3)。发芽期和芽期共检测到10个耐冷性相关QTL,其中贡献率大于7.00%有7个,说明水稻耐冷性由多个具有加性效应QTL控制。控制成苗率的qSSR7及控制耐冷级别的qCTL7均位于7号染色体C7_179537~C7_5442924区间,说明该区间同时调控芽期成苗率和耐冷性。
2.5 上位性QTL定位
检测到1对与发芽期发芽系数相关上位性位点,表型贡献率为14.26%,可使发芽系数降低0.29。检测到3对与芽期相关上位性位点,其中1对与成苗率有关,表型贡献率为17.04%,上位性效应为3.96。另2对与耐冷级别有关,表型贡献率分别为4.52%和5.24%,上位性效应值分别为-0.37和0.14(见表4)。

表4 水稻发芽期和芽期耐冷性上位性位点Table 4 Epistatic sites of cold tolerance at germination and bud stages of rice
3 讨论
水稻发芽期和芽期低温胁迫影响水稻产量和直播生产发展[26]。本试验利用培养箱模拟空气低温,处理重组自交系群体,探究低温胁迫对水稻发芽期相对发芽率、发芽势、平均发芽天数、发芽系数和芽期成苗率、耐冷级别的影响,挖掘耐冷性相关QTL,有利于耐冷性品种选育,保障水稻安全生产。Wang等在研究水稻耐冷性时,常将发芽期和芽期统称为芽期[27],本试验对两个时期分别研究耐冷性,以期发现共同位点。籼稻和粳稻生物学下限温度分别为12℃和10℃,因此以往研究中常以籼粳杂交的重组自交系群体为试验材料[7],而本试验以黑龙江省大面积种植粳稻品种为亲本,使鉴定的耐冷性位点更适用于黑龙江省水稻育种。
发芽期和芽期耐冷基因挖掘已取得一定进展,但低温处理的温度和时间差异较大。Wang等以IR28和Daguandao衍生RIL群体为试验材料,在14℃条件下处理23 d,检测与发芽率和发芽势相关位点[27]。邓浩东等以籼稻9311和日本晴为亲本构建的CSSLs群体为试验材料,在7℃条件下处理7 d,检测与存活率相关位点[28]。本研究设置发芽期12、13和14℃和芽期2、3、4℃预试验,结果表明RIL群体在较高温度下发芽率和成苗率差异较小,而在较低温度下发芽率和成苗率过低,因此发芽期13℃和芽期3℃为本试验耐冷性鉴定最适条件。姜树坤等以LTH和SN265衍生的144个株系重组自交系为试验材料,于2℃条件下处理2 d,转移至20~30℃条件下恢复10 d,调查成苗率[21]。本试验分别设置芽期2、3和4℃下低温处理10 d,在26℃下恢复7 d并测定成苗率,试验结果表明3℃条件下成苗率较高且株系间差异显著。
本试验共检测到7个与发芽期耐冷性相关QTL,分别位于第1、2、3、6、7、11号染色体C1_27059272~29072866、C2_35227548~35357752、C3_17168622~23410343、C6_4815311~4915271、C7_6259359~8809828和C11_23291638~23542994区间。其中控制相对发芽率的qRGR3和控制发芽系数的qGC3均位于3号染色体C3_17168622~23410343区间,与Jiang等检测到低温发芽率qLTG-3位点部分重合,重合片段长度为5.95 Mb[23]。控制平均发芽天数的qAGD1位点位于C1_27059272~29072866区间,杨洛淼等检测的低温发芽率qLTG1位于该区间内[10],该区间与陈玮等检测芽苗存活率qSCT-1位点部分重合[24],qSCT-1位点位于C1_23971321~27335176,重合片段长度为275.9kb,其中包含39个基因。本试验中影响平均发芽天数的qAGD7位于潘招远检测到的qLTGR7-2区间之内[25]。本研究检测到控制发芽势的qGE6、控制平均发芽天数的qAGD2和qAGD11,以往研究中未见报道。
本试验共检测到3个与芽期耐冷性相关QTL,分别位于第3号染色体C3_1493308~9449124区间和第7号染色体C7_179537~5442924区间。位于7号染色体C7_179537~5442924区间的qSSR7和qCTL7,在芽期成苗率和耐冷级别中均被检测到,潘招远检测到的低温发芽率qLTGR7-1也位于该区间内[25]。控制芽期耐冷级别的qCTL3位于C3_1493308~9449124区间,该区间包含任永梅[9]检测到的qSR3-2和潘招远[25]检测到的qLTGR3-1,其中qLTGR3-1为控制水稻种子低温萌发的主效位点,可能通过物质代谢与合成影响种子萌发[25]。本研究检测到10个与发芽期和芽期耐冷性相关QTL位点中,除控制平均发芽天数的qAGD1和qAGD2增效等位基因来源于小白粳子外,其他增效等位基因均来源于空育131。
在数量性状遗传中上位性效应普遍存在,上位性互作受位点基因型和环境共同影响[29],本研究以发芽系数为耐冷性鉴定指标,在发芽期检测到6号染色体C6_3070977~4805565区间和11号染色体C11_1609876~4416248区间存在上位性效应,与平均发芽天数相关的qAGD11加性位点位于11号染色体区间内,说明该加性效应QTL参与上位性效应。本研究在芽期共定位到3对上位性位点,其中以芽期成苗率为指标,在4号和7号染色体间检测到一对上位性位点,其表型贡献率在3对上位性位点中最大(17.04%);以耐冷级别为指标,在1号染色 体C1_32601806~33102009和C1_37540821~42208479之间、3号染色体C3_1493308~9449124和7号染色体C7_179537~5442924之间分别检测到1个上位性位点,3号和7号染色体这两个区间同时检测到耐冷级别加性QTL。
4 结论
在发芽期检测到7个与发芽期耐冷性相关QTL位点,其中与发芽势相关的qGE6、与平均发芽天数相关的qAGD2和qAGD11暂无报道。检测到3个与芽期耐冷性相关QTL位点,其中控制成苗率的qSSR7和耐冷级别的qCTL7均位于C7_179537~5442924区间。10个与发芽期和芽期耐冷性相关QTL位点中,除控制平均发芽天数的qAGD1和qAGD2增效等位基因来源于小白粳子外,其他增效等位基因均来源于空育131。检测到4对上位性位点,其中1对与发芽期耐冷性相关,其贡献率为14.26%,另有3对与芽期耐冷性相关,贡献率分别为17.04%、4.52%和5.24%。

