管纹艳虎天牛糖苷水解酶基因家族的鉴定和表达谱分析
糯淑梅,王政全,吴 春,杨安锦,刘乃勇
(西南林业大学,云南省森林灾害预警与控制重点实验室,昆明 650224)
管纹艳虎天牛Rhaphumahorsfieldi是一种杂食性的蛀干害虫,其寄主包括豆科、樟科和胡桃科植物,不同寄主植物可能促使其体内植物细胞壁降解相关的酶在数量、表达水平、基因结构等方面呈现多样化,如糖苷水解酶(Glycoside hydrolase,GH;EC 3.2.1)基因家族(云南省林业厅等,1987;尹宁娜等,2019)。GH是一大类广泛存在于动物、植物、细菌、真菌、线虫等生物体内催化糖苷键水解的酶,负责裂解糖分子与生物分子之间的糖苷键,其催化水解过程不需要任何辅酶或辅因子的参与。在植食性天牛昆虫体内,GH主要将纤维素、纤维二糖等多糖水解为可供昆虫消化吸收的低聚糖或单糖(Watanabe and Tokuda,2010;Pauchetetal.,2010;Fischeretal.,2013)。因此,GH基因对于取食木本植物的天牛科昆虫的生长发育尤为重要。
根据序列相似性和基因功能,昆虫GH基因超家族可划分为多个家族(如GH1、GH9、GH28、GH45等),同一物种不同GH家族基因间相似性较低,而不同物种同一GH家族的同源基因间相似性较高(Bourne and Henrissat,2001;Palomares-Riusetal.,2014)。在桑天牛Aprionagermari和桑树黄星天牛Psacotheahilaris中,同源的GH5基因具有89%的氨基酸一致性(Weietal.,2006)。在鞘翅目昆虫中,赤拟谷盗Triboliumcastaneum(Willisetal.,2011)、光肩星天牛Anoplophoraglabripennis(Mckennaetal.,2016)、叶甲Gastrophysaviridula(Buschetal.,2018)、白蜡窄吉丁Agrilusplanipennis(登录号:XP_025831030.1)、萤火虫Photinuspyralis(Fallonetal.,2018)和椰子犀角金龟Oryctesrhinoceros(Matanetal.,2019)的GH9基因具有60%的氨基酸一致性。然而,光肩星天牛的AglaGH9基因与所有AglaGH1s基因均具有较低的氨基酸一致性(<15%)(Mckennaetal.,2016)。由于鞘翅目不同昆虫间GH家族数量存在差异,因此导致了它们的基因数量变化较大。从玉米根萤叶甲Diabroticavirgiferavirgifera卵、初孵幼虫和3龄幼虫中肠的转录组中鉴定到8个GH家族的78个基因(Eyunetal.,2014);在大足象Cyrtotrachelusbuqueti中,从不同发育阶段的转录组中鉴定到55个GH家族的309个基因(Luoetal.,2018);基于基因组数据,从赤拟谷盗(Tribolium Genome Sequencing Consortium,2008)、中欧山松大小蠹Dendroctonusponderosae(Keelingetal.,2013)、光肩星天牛(Mckennaetal.,2016)和红棕象甲Rhynchophorusferrugineus(Hazzourietal.,2020)中分别鉴定到27个(5个GH家族)、70个(7个GH家族)、86个(6个GH家族)和224个(19个GH家族)GH基因。因此,鞘翅目不同昆虫间GH基因在家族大小和数量上均存在不同程度的差异,推测其可能与不同昆虫的寄主范围有关。
昆虫GH基因主要在与糖类物质消化吸收有关的肠道中表达,此外在不同发育阶段的组织中也有表达。桑天牛的AgerGH5、GH45-1和GH45-2基因均在中肠中特异表达(Leeetal.,2004;Leeetal.,2005;Weietal.,2006);类似地,光肩星天牛中肠中也存在大量的GH基因(Scullyetal.,2013);长须罗蛉Lutzomyialongipalpis的GH基因在幼虫、蛹、成虫或成虫头部等组织中均有不同程度的表达(Moraesetal.,2014)。昆虫GH基因超家族下的家族成员数量众多,不同家族的基因功能也有所不同。在光肩星天牛中,GH1和GH5家族的酶主要具有纤维素酶活性;而GH28、GH45和GH48家族的酶则主要具有多聚半乳糖醛酸酶活性(Mckennaetal.,2016)。类似的关于GH降解糖类物质的研究在日本桑天牛Aprionajaponica(Pauchetetal.,2014)、云斑天牛Batocerahorsfieldi(Xiaetal.,2013;Meietal.,2015)、叶甲G.viridula(Buschetal.,2018)、赤拟谷盗(Willisetal.,2011)等鞘翅目昆虫中也有报道。
管纹艳虎天牛是一种取食木本植物的蛀干害虫,其体内存在大量GH家族基因,但是至今尚未有该家族基因的相关报道。因此,本研究基于测序的转录组数据,采用转录组学、生物信息学、蛋白同源建模等方法研究管纹艳虎天牛的GH基因。研究结果可为后续管纹艳虎天牛GH基因的功能研究奠定基础,同时为该天牛寄主取食及适应机制的研究提供借鉴。
1 材料与方法
1.1 供试昆虫
管纹艳虎天牛收集自寄主植物三台核桃Juglanssigillata受害木段。首先,野外采集受害核桃木段(云南省楚雄州大姚县三台乡:N26°00′01.6″,E101°04′04.7″)至室内进行饲养,树干两端用凡士林和封口膜进行保湿,饲养条件:25±3℃,相对湿度50%±10%,光周期12 L ∶12 D;其次,待天牛成虫羽化后根据腹部形态特征区分雌雄虫(尹宁娜等,2019),分开饲养,并提供10%的蜂蜜水、核桃枝干和树叶;最后,分别收集3~5 d的雌雄虫触角、跗节、不含触角和跗节的残体用于转录组测序,每个组织收集两套生物学模板和进行两次重复测序(Zhaoetal.,2020a)。
1.2 实验方法
1.2.1基因的鉴定
为了尽可能鉴定管纹艳虎天牛的GH基因,选取光肩星天牛、赤拟谷盗、中欧山松大小蠹、马铃薯甲虫Leptinotarsadecemlineata等具有基因组的鞘翅目昆虫GH蛋白序列(Tribolium Genome Sequencing Consortium,2008;Pauchetetal.,2010;Keelingetal.,2013;McKennaetal.,2016;Buschetal.,2019),构建GH蛋白序列本地数据库。根据测序的管纹艳虎天牛转录组数据(Zhaoetal.,2020a),将其导入Geneious 10.1.3软件(https://www.geneious.com/)中。以构建的GH蛋白序列本地库为靶标,采用TBLASTN同源搜索的方法搜索经Trinity v2.5.1软件组装的转录组(Trinity.fasta)(Grabherretal.,2011)(搜索参数:BLOSUM62矩阵,E值设定为1e-5,每条序列最大搜索比对数为20),鉴定RhorGHs基因。采用相同的方法搜索经Corset v1.05软件聚类处理后有注释信息的转录组(Unigene.fasta)(Davidson and Oshlack,2014)。以鉴定的RhorGHs蛋白为靶标序列,分别搜索Trinity.fasta和Unigene.fasta两个数据库,鉴定种间一致性较低但种内一致性较高的RhorGHs基因;最后,在NCBI NR蛋白序列数据库(National Center for Biotechnology Information Non-redundant protein sequence database)中进行BLASTP比对,完成亚家族划分和保守域确定。
1.2.2序列及进化分析
为了确定RhorGHs基因是否是全长序列,根据以下两个标准进行判断:(1)NCBI BLAST比对结果,即与其他昆虫中具有全长序列的GH进行长度比较;(2)昆虫不同GH家族基因的序列特征,包括糖基化位点、信号肽和保守域。不同GH家族基因的氨基酸序列比对采用ClustalW软件进行,比对完成后分析不同GH间的氨基酸一致性(Larkinetal.,2007)。序列编辑采用Jalview v2.8软件进行(Waterhouse,2009)。分子量(Molecular weight,Mw)和等电点(Isoelectric point,pI)预测利用在线工具Compute pI/Mw(https://web.expasy.org/compute_pi/)完成。采用SignalP 4.1 Server预测GH的信号肽序列(Petersenetal.,2011)。N-糖基化位点(N-glycosylation predicted sites,NPS)利用NetNGlyc 1.0 Server在线软件(http://www.cbs.dtu.dk/services/netnglyc/)预测。
在进化分析中,主要选取鞘翅目昆虫、细菌和真菌的GH序列,其中GH9家族也选取了其他 5个目12种昆虫的蛋白序列:半翅目的桃蚜Myzuspersicae、豌豆蚜Acyrthosiphonpisum、大豆蚜Aphisglycines、雪松长足大蚜Cinaracedri和褐飞虱Nilaparvatalugens;蜚蠊目的达尔文澳白蚁Mastotermesdarwiniensis、内华达古白蚁Zootermopsisnevadensis、北美散白蚁Reticulitermesflavipes和美洲大蠊Periplanetaamericana;螳螂目的薄翅螳螂Mantisreligiosa;竹节虫目的竹节虫Timemacristinae;膜翅目的大蜜蜂Apisdorsata。利用MAFFT v7.450软件进行蛋白序列比对(Katoh and Standley,2013)。采用PhyML 3.0软件中的最大似然法(Maximum-likelihood method)构建进化树(Guindonetal.,2010)。采用FigTree v1.4.4软件对进化树进行编辑和可视化分析(http://tree.bio.ed.ac.uk/software/figtree/)。
1.2.3基因的表达谱研究
为了明确RhorGHs基因在不同组织的表达情况,根据测序获得的FPKM(fragments per kilobase of transcript per million mapped reads)值构建它们的表达谱。先采用Bowtie 2软件将Clean reads比对到Unigene转录组(Langmead and Salzberg,2012);利用RSEM软件统计比对到基因上的Reads数(Dewey and Li,2011),并用FPKM值方法进行标准化处理,计算每个基因在不同组织的表达水平(Trapnelletal.,2010);然后用RhorGHs基因搜索Unigene.fasta数据库,找到其对应的基因编号;最后,根据基因编号找到其在不同组织的FPKM值,利用两次重复的平均值绘制表达谱热图。
1.2.4RhorGH28蛋白的同源建模
选取管纹艳虎天牛RhorGH28家族中具有全长序列的5个RhorGH28s基因(RhorGH28-1、GH28-2、GH28-3、GH28-4和GH28-5),在NCBI PDB蛋白晶体结构数据库(NCBI Protein Data Bank protein database)中进行BLASTP比对,比对结果发现5个RhorGH28s均与黑曲霉Aspergillusniger的多聚半乳糖醛酸内切酶(Endo-polygalacturonase,AnigPGA-II)具有最高氨基酸一致性;根据序列比对结果截取与AnigPGA-II对应长度的RhorGHs的C端区域;以AnigPGA-II蛋白的晶体结构(PDB ID:1CZF)为模板(Vanetal.,2016),采用MODELLER 9v7软件分别构建5个RhorGH28s蛋白的三级结构(Sali and Blundell,1993)。三级结构的编辑和可视化分析采用PyMOL软件进行(https://pymol.org/)。
2 结果与分析
2.1 管纹艳虎天牛RhorGHs基因的鉴定
基于已测序的转录组数据(Zhaoetal.,2020a),从管纹艳虎天牛中鉴定到7个GH基因家族:GH1、GH9、GH13、GH16、GH28、GH31和GH45,共56个基因;除RhorGH1-13基因仅存在于Trinity转录组外,其余55个基因在Trinity和Unigene数据库中均检测到。其中,GH1包含23个基因,有8个基因(RhorGH1-1~GH1-8)具有全长序列,编码484~505个氨基酸;除RhorGH1-2接近中性外,其余7个均偏酸性;分子量在55.02~58.62 kDa之间;8个RhorGH1s蛋白间糖基化位点在数量和位置上均存在一定差异,其中RhorGH1-4、GH1-5和GH1-6均有5个糖基化位点,而RhorGH1-1只有1个。其余15个基因(RhorGH1-9~GH1-23)为片段,编码216~505个氨基酸(表1)。
在GH9家族中,只有1个基因(RhorGH9),为片段,编码437个氨基酸。在GH13家族中,4个基因均为片段,编码235~366个氨基酸。在GH16家族中,2个基因(RhorGH16-1和GH16-2)均为片段。在GH28家族中,鉴定到10个基因,其中RhorGH28-1~GH28-5基因具有全长序列,编码364~369个氨基酸;除RhorGH28-3和GH28-4偏碱性外,其余3个均接近中性;糖基化位点数量相对较少(1~3个),但是其位置相对保守。RhorGH28-6~GH28-10等5个基因为片段,编码182~373个氨基酸(表1)。
在GH31家族中,鉴定到12个基因,其中RhorGH31-1~GH31-6基因是全长序列,编码632~1 020个氨基酸;分子量在72.23~116.02 kDa之间;RhorGH31-4糖基化位点最多,有16个,其余5个基因均有6个糖基化位点,但位置变化较大。RhorGH31-7~GH31-12等6个基因为片段,编码282~725个氨基酸。在GH45家族中,RhorGH45-1~GH45-4基因都是全长序列,编码234~240个氨基酸;除RhorGH45-3偏碱性外,其余3个均偏酸性;4个RhorGH45S均只有1个糖基化位点(表1)。
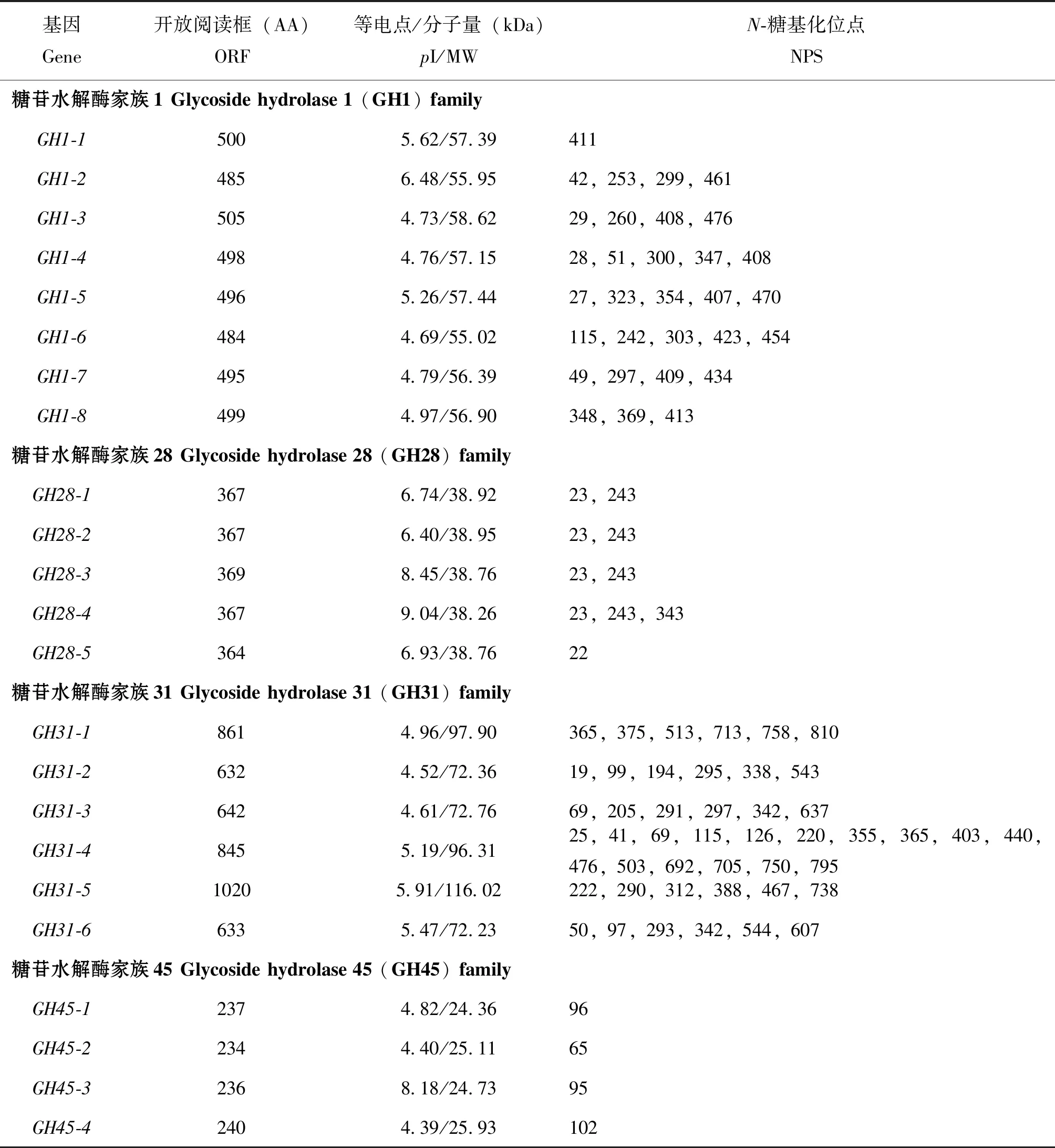
表1 管纹艳虎天牛全长RhorGHs基因的信息Table 1 Information for full-length RhorGH genes of Rhaphuma horsfieldi
2.2 RhorGH1家族基因的序列及进化特征
选取GH1家族中具有全长序列的8个RhorGH1s进行序列比对和分析。结果表明,所有RhorGH1s在N端均具有信号肽序列,长度为17~23个氨基酸。不同蛋白间氨基酸一致性变化范围较大(38.31%~73.49%),平均一致性为47.19%,其中RhorGH1-7与GH1-8一致性最高(73.49%),而RhorGH1-6与GH1-8一致性最低(38.31%)。在功能区域内所有RhorGH1s具有高度保守的氨基酸残基,如质子供体(E/Q:谷氨酸和谷氨酰胺)和催化亲核残基(E)(图1)。

图1 管纹艳虎天牛RhorGH1s蛋白的氨基酸序列比对Fig.1 Alignment of amino acid sequences of RhorGH1 proteins in Rhaphuma horsfieldi注:N端黑色方框内的氨基酸为信号肽序列。黑色三角形标示的是质子供体(E/Q)和催化亲核残基(E)。Note:Signal peptide sequences at N-termini were boxed in black.Putative residues for the proton donors (E/Q) and catalytic nucleophiles (E) were marked in black triangles,respectively.
选取4种鞘翅目昆虫(光肩星天牛、中欧山松大小蠹、赤拟谷盗和管纹艳虎天牛)、3种细菌(解糖热解纤维素菌Caldicellulosiruptorsaccharolyticus、热纤梭菌Hungateiclostridiumthermocellum和热解糖热厌氧杆菌Thermoanaerobacteriumthermosaccharolyticum)和4种真菌(黑曲霉、尖孢镰刀菌Fusariumoxysporum、灰腐质霉Humicolagrisea和长柄木霉Trichodermalongibrachiatum)GH1家族的 119个蛋白构建进化树。结果表明,鞘翅目昆虫的GH1具有物种或科特异聚类的特点,其中3个分支仅包含天牛科昆虫光肩星天牛和管纹艳虎天牛的GH1,而且管纹艳虎天牛具有2个种特异的扩增(RhorGH1-1/GH1-4/GH1-7~GH1-10/GH1-16和RhorGH1-6/GH1-11~GH1-15)。此外,3个分支呈种特异的聚类,包括2个中欧山松大小蠹和1个赤拟谷盗的GH1分支;1个混合分支与细菌和真菌的亲缘关系较近,其中管纹艳虎天牛在该分支中仅有RhorGH1-2(图2)。

图2 鞘翅目、细菌和真菌GH1蛋白的进化树Fig.2 Phylogenetic tree of GH1 proteins in Coleoptera,bacteria and fungi注:管纹艳虎天牛的RhroGH1s蛋白用黑色箭头标示。用细菌的GH1作为进化树的根。Agla,光肩星天牛;Dpon,中欧山松大小蠹;Rhor,管纹艳虎天牛;Tcas,赤拟谷盗;Csac,解糖热解纤维素菌;Hthe,热纤梭菌;Tthe,热解糖热厌氧杆菌;Anig,黑曲霉;Foxy,尖孢镰刀菌;Hgri,灰腐质霉;Tlon,长柄木霉。Note:RhorGH1 proteins from Rhaphuma horsfieldi were indicated with black arrows.GH1 members of bacteria were used to root the tree.Agla,Anoplophora glabripennis;Dpon,Dendroctonus ponderosae;Rhor,Rhaphuma horsfieldi;Tcas,Tribolium castaneum;Csac,Caldicellulosiruptor saccharolyticus;Hthe,Hungateiclostridium thermocellum;Tthe,Thermoanaerobacterium thermosaccharolyticum;Anig,Aspergillus niger;Foxy,Fusarium oxysporum;Hgri,Humicola grisea;Tlon,Trichoderma longibrachiatum.
2.3 RhorGH9/GH13/GH16家族基因的序列及进化特征
在GH9、GH13和GH16蛋白的进化分析中,3个家族的成员各自聚类到不同的分支中。其中,管纹艳虎天牛的RhorGH9与其他昆虫的GH9具有较高的支持率(>0.70)和中等的氨基酸一致性(平均值为58.19%);4个RhorGH13s聚类到鞘翅目昆虫的1个小分支;2个RhorGH16s聚类到鞘翅目昆虫的GH16家族,在该分支中的GH16主要以物种特异的形式聚成不同的小分支(图3)。

图3 昆虫、细菌和真菌GH9、GH13和GH16蛋白的进化树Fig.3 Phylogenetic tree of GH9,GH13 and GH16 proteins in insects,bacteria and fungi注:管纹艳虎天牛的RhroGH9、GH13和GH16蛋白用黑色箭头标示。用细菌的GH16作为进化树的根。Ador,大蜜蜂;Agly,大豆蚜;Apla,白蜡窄吉丁;Apis,豌豆蚜;Aver,沙漠铁包甲虫;Cced,雪松长足大蚜;Dvir,玉米根萤叶甲;Gvir,叶甲;Ldec,马铃薯甲虫;Mdar,达尔文澳白蚁;Mper,桃蚜;Mrel,薄翅螳螂;Nlug,褐飞虱;Orhi,椰子犀角金龟;Pame,美洲大蠊;Ppyr,萤火虫;Rfla,北美散白蚁;Tcri,竹节虫;Tmol,黄粉虫;Znev,内华达古白蚁;Amac,麦氏交替单胞菌;Gjoo,单胞菌;Pfla,金黄色假交替单胞菌;Bbas,球孢白僵菌;Cmil,蛹虫草菌;其余物种缩写见图2。Note:RhorGH9,GH13 and GH16 proteins from Rhaphuma horsfieldi were indicated with black arrows,respectively.GH16 members of bacteria were used to root the tree.Ador,Apis dorsata;Agly,Aphis glycines;Apla,Agrilus planipennis;Apis,Acyrthosiphon pisum;Aver,Asbolus verrucosus;Cced,Cinara cedri;Dvir,Diabrotica virgifera virgifera;Gvir,Gastrophysa viridula;Ldec,Leptinotarsa decemlineata;Mdar,Mastotermes darwiniensis;Mper,Myzus persicae;Mrel,Mantis religiosa;Nlug,Nilaparvata lugens;Orhi,Oryctes rhinoceros;Pame,Periplaneta americana;Ppyr,Photinus pyralis;Rfla,Reticulitermes flavipes;Tcri,Timema cristinae;Tmol,Tenebrio moliter;Znev,Zootermopsis nevadensis;Amac,Alteromonas macleodii;Gjoo,Gayadomonas joobiniege;Pfla,Pseudoalteromonas flavipulchra;Bbas,Beauveria bassiana;Cmil,Cordyceps militaris.The abbreviation of other species was listed in Fig.2.
2.4 RhorGH28家族基因的序列及进化特征
在昆虫GH28家族的进化分析中,考虑到鞘翅目每个物种具有较少数量的GH28基因,选取了更多鞘翅目昆虫的蛋白构建进化树。结果表明,鞘翅目昆虫的GH28家族主要以种特异的形式聚类,其中管纹艳虎天牛的GH28被分散到3个分支中(RhorGH28-10、RhorGH28-6/GH28-9和RhorGH28-1~GH28-5/GH28-7~GH28-8),第3个分支呈现物种特异的扩增;其他种特异的聚类还包括光肩星天牛(1个分支)、四纹豆象Chrysomelatremula(1个分支)、中欧山松大小蠹和米象Enterococcussaccharolyticus(2个分支)。此外,叶甲科昆虫的GH28具有2个大的聚类分支,其中管纹艳虎天牛有2个分支分别与它们具有较近的亲缘关系(图4)。

图4 鞘翅目、细菌和真菌GH28蛋白的进化树Fig.4 Phylogenetic tree of GH28 proteins in Coleoptera,bacteria and fungi注:管纹艳虎天牛的RhroGH28蛋白用黑色箭头标示。用细菌的GH28作为进化树的根。Cmac,四纹豆象;Ctre,山杨叶甲;Pcoc,辣根猿叶虫;Sory,米象;Esac,解糖肠球菌;Pfon,细菌;Skue,细菌;Chig,菜炭疽菌;Lmac,油菜茎基溃疡病菌;Tter,太瑞斯梭孢壳霉;其余物种缩写见图2和图3。Note:RhorGH28 proteins from Rhaphuma horsfieldi were indicated with black arrows.GH28 members of bacteria were used to root the tree.Cmac,Callosobruchus maculatus;Ctre,Chrysomela tremula;Pcoc,Phaedon cochleariae;Sory,Sitophilus oryzae;Esac,Enterococcus saccharolyticus;Pfon,Paenibacillus fonticola;Skue,Saccharibacillus kuerlensis;Chig,Colletotrichum higginsianum;Lmac,Leptosphaeria maculans;Tter,Thielavia terrestris.The abbreviation of other species was listed in Fig.2 and Fig.3.
以黑曲霉AnigPGA-II的晶体结构为模板,采用同源建模的方法构建了RhorGH28家族中RhorGH28-1、GH28-2、GH28-3、GH28-4和GH28-5 等5个蛋白的三级结构。根据黑曲霉AnigPGA-II晶体结构的氨基酸序列,选取5个RhorGH28s蛋白C端相应区域的氨基酸(346~350个)进行序列比对。结果表明,5个蛋白相互间具有高的氨基酸一致性(57.14%~74.43%),但它们与AnigPGA-II均只具有中等的一致性(39.66%~43.35%)(图5-A)。

图5 管纹艳虎天牛5个RhorGH28s蛋白的三级结构Fig.5 Three-dimensional (3D) structures of five RhorGH28 proteins from Rhaphuma horsfieldi注:(A)管纹艳虎天牛5个RhorGH28s与黑曲霉AnigPGA-II的氨基酸序列比对。根据黑曲霉AnigPGA-II的晶体结构,质子供体(D182)、催化亲核残基(D161和D183)和参与底物结合的关键氨基酸(N159、H204、H205、R240、K242和Y276)被标示。参与二硫键形成的8个半胱氨酸用数字标示;此外,第5对可能的二硫键用虚线标示。(B)管纹艳虎天牛5个RhorGH28的三级结构。在图5-A中的关键氨基酸和4对二硫键在三级结构上被标示。Nt,N端;Ct,C端。Note:(A) Alignment of five RhorGH28s and AnigPGA-II amino acid sequences.Based on the crystal structure of AnigPGA-II,the residues for the proton donor (D182),catalytic nucleophile (D161 and D183) and substrate binding (N159,H204,H205,R240,K242 and Y276) were shown,respectively.Eight cysteines involving the formation of disulfide bridges were numbered 1 to 4.The fifth putative disulfide bridge was indicated with a dashed line.(B) 3D models of five RhorGH28s.In Fig.5-A,key amino acids and four disulfide bridges were labeled on their respective 3D structures,respectively.Nt,N-termini;Ct,C-termini.
同源建模结果表明,5个RhorGH28s的三级结构主要由β折叠组成,每个蛋白包括28个折叠片、1个α螺旋、N端和C端,其中三级结构主要由4对二硫键和1对可能的二硫键稳定。所有RhorGH28s的大部分β折叠间一致性较低,但质子供体和催化亲核残基则高度保守。在第一个亲核残基中,除RhorGH28-5是天冬酰胺(N)外,其余5个均为天冬氨酸(D);所有6个蛋白的第二个亲核残基均为天冬氨酸(D);此外,它们也具有相同的质子供体氨基酸(D)。除以上3个关键氨基酸位点外,在RhorGH28s和AnigPGA-II中还具有高度保守的底物结合位点,如N159、组氨酸(H204、H205)、精氨酸(R240)、赖氨酸(K242)和酪氨酸(Y276)(图5-B)。
2.5 RhorGHs基因的组织表达特征
除RhorGH1-13基因在Unigene数据库中未检测到外,研究了7个GH家族共55个基因在雌雄虫触角、跗节和残体的表达情况。结果表明,在RhorGH1家族中,RhorGH1-1、GH1-3和GH1-20基因在所有组织中均呈现高表达的特点,其余基因主要在残体中特异或高表达。在RhorGH13家族中,RhorGH13-2和GH13-3两个基因在6个组织具有广泛且高表达的特征,而RhorGH13-4基因在所有组织中的表达量均较低。RhorGH9基因在所有组织中均具有高表达。RhorGH16-1基因在6个组织中均具有较高表达,尤其是在雌雄虫触角和跗节。大部分RhorGH28s基因主要在两性残体中特异或高表达,包括RhorGH28-1~GH28-7和GH28-9基因。在RhorGH31家族中,除RhorGH31-1基因外,其余基因在测试的至少两个组织中有表达。RhorGH45-1基因在所有组织中均具有较高表达,RhorGH45-3和GH45-4基因在雌雄虫残体中高表达(图6)。

图6 管纹艳虎天牛RhorGHs基因在雌雄虫不同组织的表达谱Fig.6 Expression profile of RhorGHs in different tissues of both sexes from Rhaphuma horsfieldi注:不同颜色表示两次重复的FPKM平均值。FA,雌虫触角;MA,雄虫触角;FTa,雌虫跗节;MTa,雄虫跗节;FB,不含触角和跗节的雌虫身体;MB,不含触角和跗节的雄虫身体。Note:Different colors represented an average FPKM value of two replicates.FA,Female antennae;MA,Male antennae;FTa,Female tarsi;MTa,Male tarsi;FB,Female bodies without antennae and tarsi;MB,Male bodies without antennae and tarsi.
3 结论与讨论
管纹艳虎天牛是一种杂食性的蛀干害虫,先前报道的寄主植物仅有豆科的香须树Albiziaodoratissima和樟科的木姜子属Litsea(云南省林业厅等,1987)。2014年,Wickham等采用天牛性信息素(2,3-己二醇2,3-Hexanediol和(2R*,3R*)-2,3-辛二醇(2R*,3R*)-2,3-Octanediol)作为诱芯,在云南林间诱捕到大量的管纹艳虎天牛,暗示其寄主植物很可能具有多样性(Wickhametal.,2014)。2017年,本课题组从三台核桃受害木段中首次发现管纹艳虎天牛,进一步增加了其取食寄主植物的范围。作为一种以幼虫蛀食树木为生的害虫,不同的寄主植物可能促使昆虫与其体内参与植物细胞壁降解相关的酶呈现协同进化。关于该种天牛已有其形态特征、主要化感组织感器种类、基因家族(化感基因和解毒代谢酶)等的报道(尹宁娜等,2019;王政全等,2020;Zhaoetal.,2020a;Zhaoetal.,2020b;李根层等,2021),但缺乏植物细胞壁降解酶基因家族(如GH)的相关研究。昆虫GH基因是其体内一类庞大的水解酶家族,可将植物中的糖类化合物转化为昆虫消化和吸收的低聚糖或单糖,在植食性昆虫的取食和寄主适应性进化中起着重要作用(Pauchetetal.,2010;Watanabe and Tokuda,2010;Fischeretal.,2013)。因此,本研究基于发表的转录组(Zhaoetal.,2020a),鉴定和研究了管纹艳虎天牛中参与植物细胞壁降解的重要酶:GH。研究结果有助于了解管纹艳虎天牛寄主植物范围与GH家族的相关性,为其寄主偏好性和适应性机制研究奠定基础。
与同科的光肩星天牛(6个GH家族:86个基因)相比,管纹艳虎天牛具有7个GH家族共56个基因;通过分析发现两种天牛仅有4个GH家族相同(GH1、GH9、GH28和GH45),基因数量的差异主要存在于GH1(管纹艳虎天牛:23个;光肩星天牛:57个)和GH28(管纹艳虎天牛:10个;光肩星天牛:18个)家族;此外,管纹艳虎天牛还具有GH13、GH16和GH31家族,而光肩星天牛还包括GH5和GH48家族(McKennaetal.,2016)。与鞘翅目其他科的昆虫相比,管纹艳虎天牛GH基因的数量多于赤拟谷盗(5个GH家族:27个)(Tribolium Genome Sequencing Consortium,2008),但是明显少于大足象(55个GH家族:309个)(Luoetal.,2018)和红棕象甲(19个GH家族:224个)(Hazzourietal.,2020)。鞘翅目不同昆虫间GH基因数量差异的主要原因可能有:一是基因鉴定的数据库不同,部分物种(管纹艳虎天牛和大足象)是从转录组中鉴定,而部分物种(光肩星天牛、赤拟谷盗和红棕象甲)则是从基因组中鉴定;二是转录组测序组织差异和测序深度不同,虽然都来源于转录组数据,但是由于测序深度和组织的不同使得管纹艳虎天牛的GH基因数量少于其他昆虫;三是基因组测序和组装质量存在差异,导致GH基因未能全部得到鉴定;四是取食寄主植物的差异性,由于GH基因的功能主要与糖类化合物的水解有关,不同寄主植物因糖类物质或糖的浓度不同而导致昆虫GH家族基因的收缩或扩张。
在序列比对分析中,RhorGH1和GH28家族的蛋白在关键氨基酸位点处(如质子供体、催化亲核残基以及底物结合位点)高度保守,暗示它们对糖类物质的水解具有高度的底物特异性和保守性,尤其是5个具有较高相似性的RhorGH28s(RhorGH28-1~GH28-5)。在进化分析中,RhorGH1(RhorGH1-6/GH11~15和RhorGH1-4/GH1-7~GH1-10/GH1-16)和GH28(RhorGH28-1~GH28-5/GH28-7~GH28-8)家族的部分成员以物种特异的形式聚类成小分支,且具有较高的支持率(>0.70),这种物种特异的扩增暗示它们可能起源于基因的复制。据此推测其他物种GH1和GH28聚类分支中的成员也通过基因的复制产生,即它们位于同一条染色体上。在GH1家族中,主要验证了与管纹艳虎天牛两个聚类分支进化关系较近的光肩星天牛AglaGH1s和赤拟谷盗TcasGH1s,与预期结果一致,光肩星天牛的两个聚类分支AglaGH1-6/GH1-8/GH1-10~GH1-12/GH1-15/GH1-17/GH1-48和AglaGH1-5/GH1-13/GH1-22/GH1-28基因均位于Scaffold 278上(McKennaetal.,2016);赤拟谷盗的TcasGH1-6/GH1-7/GH1-9/GH1-11/GH1-12/GH1-16基因在染色体LG7上(Tribolium Genome Sequencing Consortium,2008)。在GH28家族中,光肩星天牛的AglaGH28-7~GH28-13基因位于5条Scaffold上,而AglaGH28-14~GH28-18基因位于同一条Scaffold 206上(McKennaetal.,2016)。因此,分析认为管纹艳虎天牛的两个RhorGH1s聚类分支可能分别位于两条染色体上,且通过基因的复制产生;而RhorGH28s聚类分支的成员是否位于同一条染色体上仍有待进一步研究。
昆虫GH家族的基因主要在与糖类物质消化和吸收有关的肠道中表达,并呈现肠道特异或高表达的特点(Watanabe and Tokuda,2010)。在天牛科昆虫桑天牛(AgerGH5、GH45-1和GH45-2)(Leeetal.,2004;Leeetal.,2005;Weietal.,2006)、光肩星天牛(Scullyetal.,2013)、桑树黄星天牛(PhilGH5)(Sugimuraetal.,2003)、日本桑天牛(AjapGH5和GH45家族基因)(Pauchetetal.,2014)、大足象(Cqbgln5和Cqbgln7)(Luoetal.,2018)、辣根猿叶虫Phaedoncochleariae(PcocGH11、GH28和GH45家族基因)(Kirschetal.,2012)、玉米根萤叶甲(DvirENGaseI)(Valenciaetal.,2013)、金眼竹节虫Peruphasmaschultei(Matanetal.,2014)和豌豆蚜Acyrthosiphonpisum(ApisAPS1)(Priceetal.,2007)中,GH基因均具有中肠特异或高表达的特点。本研究中管纹艳虎天牛的大部分RhorGHs基因在残体中特异或高表达,鉴于先前GH的表达特征和消化水解功能,暗示RhorGHs基因很可能主要在管纹艳虎天牛的肠道中表达,即RhorGHs基因主要参与植物中糖类物质的水解。此外,昆虫GH基因在丝腺、卵、蛹、头部等组织中也有表达,说明该家族基因可能还参与到昆虫其他生理过程(Scharfetal.,2010;Eyunetal.,2014;Moraesetal.,2014;Luoetal.,2018)。在管纹艳虎天牛中,部分RhorGHs基因在化感器官(触角和跗节)中有表达,说明它们可能具有嗅觉或味觉功能。

