多层螺旋CT与微探头超声内镜对胃黏膜下病变内镜切除疗效的评估
李甜,张开光,张明黎 ,王业涛,叶飞,宋继中
胃黏膜下病变(gastrointestinal submucosal tumors, GST)指病变起源于胃壁深层,如黏膜肌层、黏膜下层、固有肌层的各种肿瘤或非肿瘤性疾病[1]。主要有平滑肌瘤、间质瘤、脂肪瘤、异位胰腺、血管瘤等,尤其是固有肌层起源的间质瘤最为常见,是一种潜有在恶变的良性肿瘤[2]。GST活检阳性率低,风险大,对于病变较大者多选择外科或内镜下直接切除。随着内镜治疗技术的发展,选择外科手术越来越少[3, 4]。内镜下切除(endoscopic resection)具有恢复快、创伤小等优势,成为现国内主流切除方法[5]。但内镜切除仍有存在一些缺陷,如切除失败、非整块切除、术中止血困难和难以缝合的固有肌层缺损[6]。
微探头超声内镜(mini-probe ultrasound endoscopy,MPS)已广泛运用于消化道GST的诊断[7],对GST的起源层次和性质显示良好的诊断价值,但受超声频率的影响, 对于体积较大的GST远场边界显示不佳,很难准确提供病变直径、胃腔外生长情况和比邻临界器官的关系。多层螺旋CT(multi-slice spiral CT,MSCT)联合三维重建对充盈良好的胃壁有很好的空间分辨率,可清晰显示GST胃腔内外生长情况和比邻脏器的关系[8]。本文旨在通过胃黏膜下病变MPS及MSCT术前检查结果,预判胃不同部位、直径、性质和生长方式的GST内镜下切除效果和安全性,为GST术前评估提供更精准的临床资料。
1 资料与方法
1.1 一般资料
纳入2015年01月至2021年12月在中国科学技术大学第一附属医院(安徽省立医院)消化内科对292例GST患者行内镜下切除,所有患者术前均行MSCT和(或)MPS检查,且临床资料完整,所有患者及家属均术前签署知情同意书。本研究经中国科学技术大学第一附属医院(安徽省立医院)伦理委员会批准审核后进行(批准号:2022-RE-020)。
1.2 研究方法
收集并整理所有手术患者的详细临床资料,包括性别、年龄、MSCT和(或)MPS结果(包括病变部位、直径、性质、生长方式)及术中情况(包括出血、穿孔和转入外科等)。病变部位按内镜检查分为:贲门、胃底、胃体、胃窦。病变直径为术后测量最长直径(diameter,D),并将直径分为:D≤1 cm、1 cm
1.3 术前MPS及MSCT检查方法
1.3.1 MPS检查方法 采用Olympus cv-260型主机及UM-2R/3R小探头超声内镜,频率为 12 MHz、20 MHz,患者检查前10~15 min口服达克罗宁胶浆10 mL,小探头超声内镜经食管送至病灶处,采用去泡注水充盈法进行超声检查,记录病变直径、边界、回声、生长方式、起源层次等。
1.3.2 MSCT检查方法 采用西门子256排CT(Siemens 256-slice CT)扫描仪行胃对比增强CT扫描,要求所有患者禁食8 h以上,检查前5 min内饮用温开水500 mL,充盈胃腔。协助患者摆好体位,扫描范围从膈肌到耻骨联合,使用自动动力静脉注射器以2.5 mL/s的速率注射碘造影剂(浓度350 mg/mL),进行平扫及多期增强扫描,采用PACS图像处理进行多平面重建(MPR)。
1.4 统计学方法

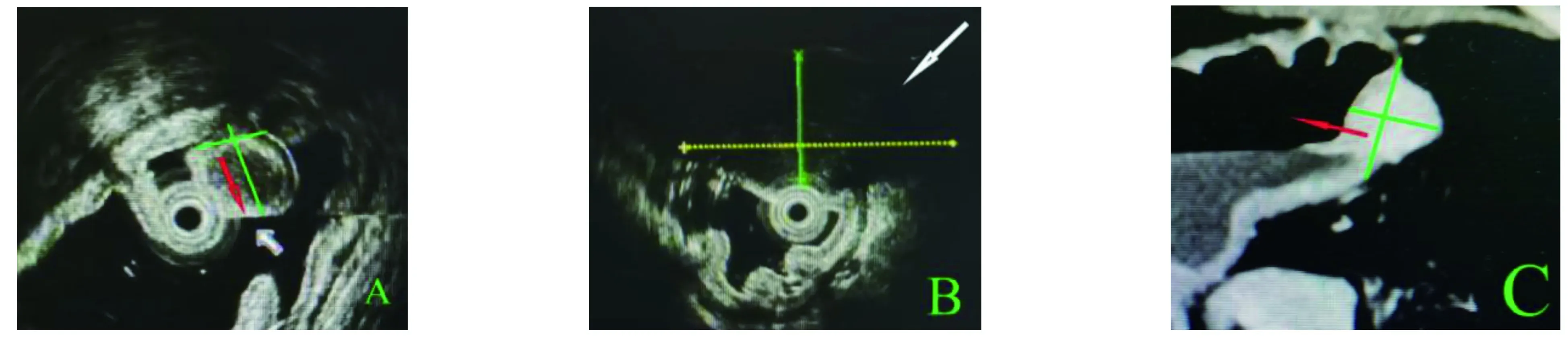
图1 术前MPS及MSCT检查 A:MPS检查,腔内生长;B:MPS检查,远场界限不清;C:MSCT检查,腔外生长
2 结果
2.1 临床特征
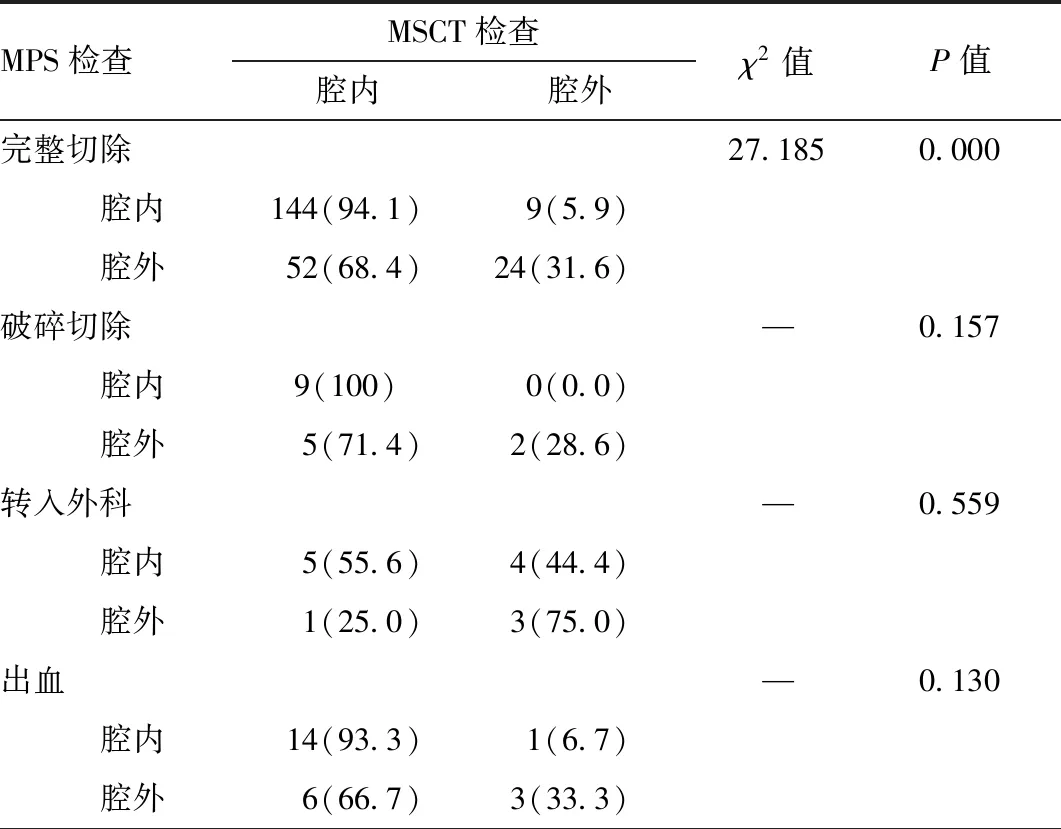
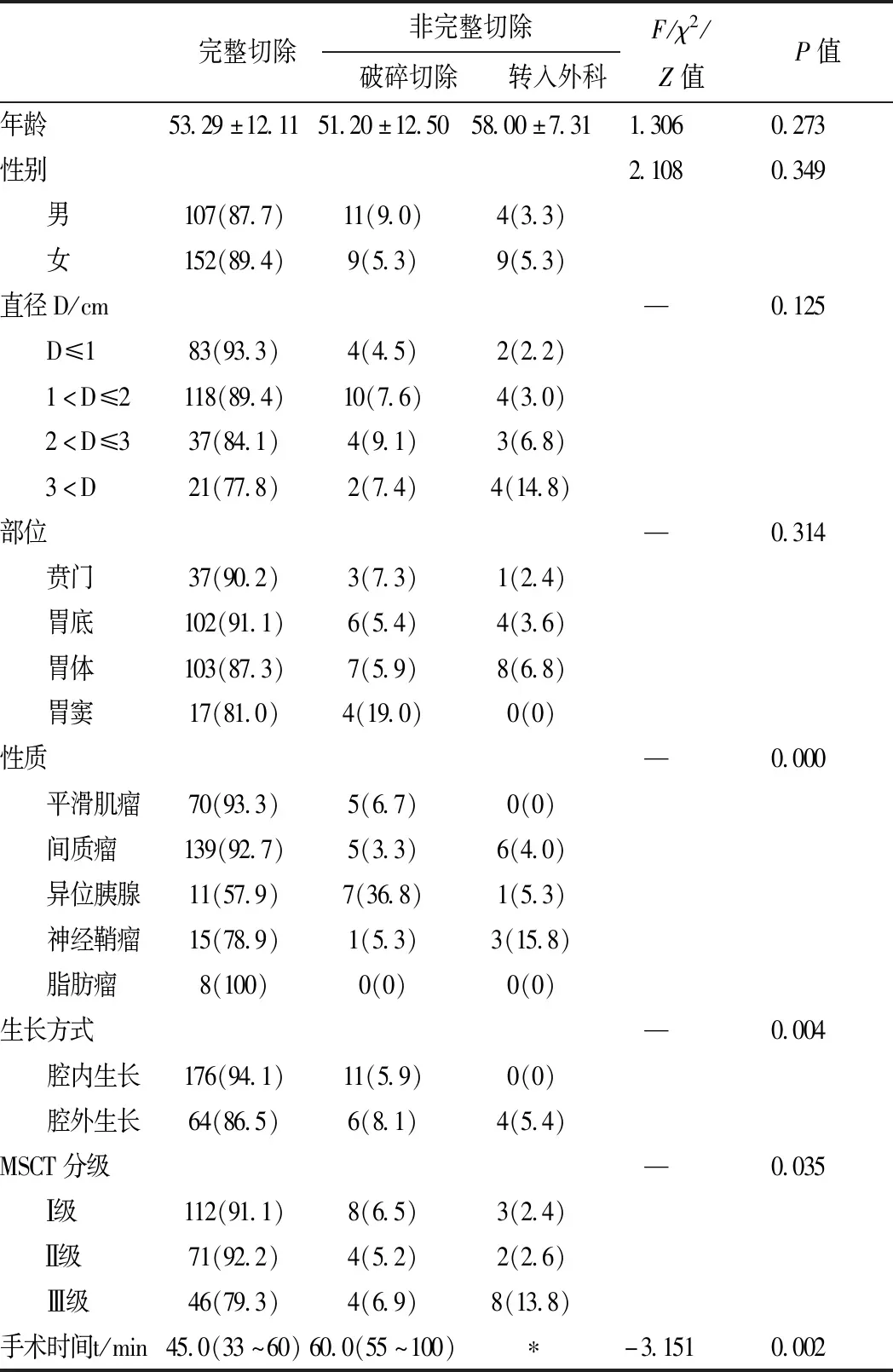
2.1.1 基本情况 纳入研究292例GST,其中男性122例,女性170例,男女比例1∶1.4;年龄22~72岁,平均(53.35±11.99)岁。GST直径大小0.3~7.5 cm,中位数直径为1.5(1.0~2.0)cm,分为 D≤1 cm(89,30.5%)、1 cm GST发病部位以胃体(118,40.4%)最为常见,其次为胃底(112,38.4%)、贲门(41,14.0%)及胃窦(21,7.2%)。GST性质以间质瘤(150,51.4%)为主,其余可见平滑肌瘤(75,25.7%)、异位胰腺(19,6.5%)、神经鞘瘤(19,6.5%)及脂肪瘤(8,2.7%);其中4例炎性纤维性息肉、4例血管瘤、2例增生性息肉、2例纤维性假瘤、1例囊腺瘤、1例颗粒细胞瘤、1例错构瘤、1例黏膜肌层增生归为“其他”性质;GST性质中有5例“未知”为回顾性研究过程中未找到报告及标本。 2.1.2 术前检查 所有患者术前均行MSP检查,行MSCT检查患者258例(88.4%)。 2.1.3 术中情况 内镜手术中判断生长方式共计261例,分为腔内生长(187,71.6%)及腔外生长(74,28.4%)。术中切除效果分为完整切除(259,88.7%)、破碎切除(20,6.8%)及转入外科手术(13,4.5%);其中转入外科手术共计13例,4例近似完全腔外生长,4例出现内镜下难以控制的大出血,5例病变内镜切除困难。术中并发症:除去转入外科13例,共计279例,分为术中穿孔(78,28.0%)、术中出血为(24,8.6%)、复杂缝合为(40,14.3%)。内镜手术时间12~255 min,中位数手术时间为50.0(35.0~60.0)min。 以术中判断生长方式为金标准,比较232例患者术前MSCT及MPS检查对生长方式的判断结果。腔外生长MSCT(14/63,22.2%)与MSP(17/63,27.0%)的判断,两者无显著性差异性(P=0.535);腔内生长MSCT(144/169,85.2%)与MPS(104/169,61.5%)的判断,两者存在显著性差异(P<0.01),且MSCT优于MPS,且MSCT对生长方式的判断与术中判断无统计学差异(P=0.178)。MSCT及MPS对生长方式的判断结果,对病变能否完整性切除及术中缝合难度存在差异性(P<0.05),详见表1。 表1 术前MSCT及MPS生长方式判断对手术切除效果和并发症比较 续表 2.3.1 影响 GST内镜下切除完整性的单因素分析 年龄、性别、直径大小及部位对GST内镜下能否完整切除无统计学差异(P>0.05),病变性质、生长方式及MSCT分级与GST内镜下能否完整切除存在相关性(P<0.05),手术时间的长短与内镜下能否完整切除存在相关性(P<0.05),详见表2。 表2 影响GST切除完整性单因素分析 2.3.1 影响 GST内镜下切除安全性的单因素分析 影响术中安全性的因素中,年龄及性别无统计学差异(P>0.05),GST的直径、部位、性质、生长方式及MSCT分级与术中穿孔存在相关性(P<0.05),术中并发症均与手术时间有关联(P<0.05),GST的直径、部位及生长方式与术中缝合难度存在相关性(P<0.05),详见表3。在术中穿孔患者中,复杂缝合(23/40,57.5%)与简单缝合(55/239,23.0%)两者存在显著性差异(P<0.01)。 把内镜手术中切除效果分为完整切除、破碎切除、转入外科,并将病变性质及MSCT分级纳入二元Logistic回归模型进行分析。异位胰腺为影响完整切除及破碎切除的独立危险因素,GST的MSCT Ⅲ级为术中转外科手术的独立危险因素(OR=9.105;95%CI1.819-45.561;P=0.007),详见表4。 将内镜切除的术中并发症分为:术中穿孔、术中出血、复杂缝合,并将单因素分析中影响术中穿孔及缝合方式的因素纳入二元Logistic回归模型进行分析。随着病变直径大小的增加,术中穿孔几率增加3倍左右(OR=3.825;95%CI1.148-12.741;P=0.029),胃底及胃窦的GST、间质瘤、神经鞘瘤以及MSCT Ⅲ级为术中穿孔的危险因素,GST直径>3 cm为复杂缝合的独立危险因素,详见表5。 GST患者缺乏特异性临床症状,多在影像学或胃镜检查中意外发现。临床上,最常见的病变为间质瘤[12]。本研究中间质瘤占51.4%,其次是平滑肌瘤、神经鞘瘤、脂肪瘤、异位胰腺等,包括间质瘤在内,部分黏膜下肿瘤存在恶性倾向,有手术切除指征[13]。相对于外科手术,内镜切除具有创伤小、时间短、出血量少、患者预后好等优势[14]。但在临床实践中,内镜手术仍存在诸多难题,如术中难以控制出血,缝合困难的穿孔,无法完整性切除和难以切除等[6, 15],尤其是以腔外生长为主的GST,内镜下切除会大大增加切除难度和术中并发症的发生[16, 17]。 因此,内镜切除手术前对GST生长方式进行充分评估显得尤为重要。目前,临床上更多应用MSP进行评估,对于较大病变或高回声病变,无法显示GST远场,难以判断GST腔外生长情况,造成内镜难以切除,增加术中并发症的发生。因而,我们引入胃增强CT联合三维重建检查,可清晰显示GST强化情况和空间结构,有助于对GST性质和生长方式的判断。本研究中MSCT与MPS对GST生长方式的术前判断在完整切除中存在差异性,对于腔外生长的GST,MSCT及MPS的判断,两者无统计学差异。腔内生长的识别率MSCT(85.2%)高于MPS(61.5%),可能因为MPS受超声频率的限制,对于较大且腔内生长的病变,远场回声分辨率降低,很难获得GST的全貌,这使其漏诊率(38.5%,65/169)增加,而MSCT正好弥补了这一缺陷,对GST的腔内外生长情况、周围脏器比邻关系及有无转移显示要优于MPS[18]。有研究报道[19, 20],CT可代替超声内镜对直径≥1 cm的GST进行术前检查,若联合超声内镜可对GST手术方式选择和并发症预防具有良好的预测价值,提高手术疗效。 表3 影响GST切除安全性单因素分析 表4 影响GST切除完整性多因素分析 表5 GST切除安全性多因素分析 MSCT具有良好的空间分辨率,按照MSCT检查将GST腔外占比进行分级,显示腔外占比>40%的病灶,术中转入外科几率增加9倍左右(OR=9.105),术中穿孔几率也增加3倍左右(OR=3.289)。与文献报道的[9] 腔外生长是影响完整切除的显著危险因素相一致。因此术前利用MSCT判断GST腔外生长情况,选择适合内镜切除的GST,会提高内镜切除完整性及安全性。 GST是否都能在内镜下成功切除,是术前评估首要环节。术前对影响内镜可切除性的危险因素充分评估,有助于提高内镜切除的成功率。本研究在可切除性的危险因素分析中,内镜下完整切除率为88.7%,与先前文献报道一致[17, 21, 22]。对于不同性质的GST,异位胰腺为术中能否完整切除及破碎切除的独立危险因素(OR=9.038、OR=9.468)。虽然,超声内镜被广泛用于GST术前病变性质判断,但有相关研究表明未显示超声内镜优于多排增强CT[23, 24],Kim等[25] 在对增强CT检查的研究后提出联合病变位置(如胃窦、十二指肠等)、边界、腔内生长情况、被覆黏膜是否强化及LD(长径)/SD(短径)比值大于1.4诊断异位胰腺的敏感度及特异度可达100%和82.5%。异位胰腺多起源于黏膜下层,有时可延伸至固有肌层或浆膜层[23, 26],与固有肌层强粘连性、缺乏完整包膜给内镜切除带来困难[27]。因此术前可根据MSCT分级及性质预判GST内镜手术能否完整切除。 GST内镜切除手术的安全性是术前评估重要环节,本研究显示年龄与性别对术中并发症无明显影响[28]。穿孔发生率为28.0%(包括主动穿孔与意外穿孔),术中出血为8.6%,与相关文献报道一致[11]。随着病变直径的增加,术中穿孔率及缝合难度均呈现增加趋势,尤其当GST直径>2 cm,并发症发生率明显增加,与文献报道相一致[9, 28]。在术中穿孔患者中,复杂缝合(23/40,57.5%)与简单缝合(55/239,23.0%)两者存在显著性差异(P<0.01),这与出现穿孔的胃壁缺损较未穿孔的创面大有关,增加了缝合难度,多需要采用缝合线联合金属缝合夹进行荷包缝合,尤其适用于胃底及胃窦部穿孔[29, 30]。胃底部穿孔风险较高,主要与胃镜难以靠近病变、切开刀与病变呈垂直、操作难度大且该部位较其他部位的胃壁较薄等有关,是易于发生穿孔的主要因素[31, 32]。间质瘤和神经鞘瘤内镜手术中穿孔几率较高(OR=3.044、OR=12.834)。主要因间质瘤多起源于固有肌层,有的为固有肌深层,向浆膜层生长,在进行整块切除时穿孔是难以避免的[31, 33],神经鞘瘤大多起源于深层肌层,无完整包膜,向浆膜外生长,常与周围组织紧密粘连,多需要胃壁全层切除[34, 35]。 综上所述,术前对GST进行充分评估,选择适合内镜下切除的病变,可以提高内镜下切除成功率和增加手术的安全性。MSCT和MPS是术前评估的主要检查方法,MSCT因其良好空间分辨率,可能更有优于MSP。2.2 MSP和MSCT对生长方式判断的比较

2.3 影响切除疗效的单因素分析
2.4 影响GST内镜下切除完整性的多因素分析
2.5 影响GST内镜下切除安全性的多因素分析
3 讨论