基于网络药理学研究丹参-川芎抗脑缺血再灌注损伤作用机制及试验验证
付雪琴,兰 瑞,邹旭欢,王玮玮,王漫漫
(1.河南中医药大学,郑州 450000;2.河南中医药大学第一附属医院,郑州 450000)
脑卒中是一种复杂的多因素多基因疾病,是全球第二大死亡原因。缺血性脑卒中是最常见的形式,占脑卒中的87%[1]。缺血性脑卒中属于中医“中风”范畴,血瘀是中风的常见病理因素。气血关系密不可分,王清任在《医林改错》中提到:“元气既虚,必不能达于血管,血管无气,必停留而瘀”[2],瘀血的形成阻滞气机,致阴阳失调,气血逆乱,上冲元神之府,出现猝然昏仆、不省人事等症状。基于标本缓急的原则,当以活血化瘀为中风后急则治标之法。丹参-川芎是治疗中风使用频率较高的药对,具有明显效果[3]。二药具有抗炎、抑制细胞凋亡,减少神经细胞损伤等作用,中药制剂丹参川芎注射液由此药对演变而来,且在临床被广泛应用[4-5]。
丹参、川芎始载于《神农本草经》,丹参味苦,微寒,归心、肝经,具有活血调经,祛瘀止痛等功效,川芎味辛,温,归肝、胆、心包经,具有活血行气、祛风止痛的作用。二者相须配伍,协作增效。目前对于丹参-川芎药对治疗缺血性脑卒中的作用机制,目标靶点尚未明确。网络药理学的兴起,为传统中医药的整体观念作用机制提供了理论预测[6]。本研究通过网络药理学角度预测丹参-川芎配伍治疗脑缺血再灌注损伤的可能机制,构建成分信息、靶点、疾病信息三者网络关系,从整体论治探究药物和疾病之间的关联性以及共同关系。
1 材料与方法
1.1 材料
1.1.1 试验动物 50只健康成年雄性SD(Sprague-Dawley)大鼠,体重220~230 g,购自华兴实验动物中心(动物许可证号:SCXK(豫)2019-0002),所有动物饲养于河南省中医院(河南中医药大学第二附属医院)SPF级动物实验中心,(22±1) ℃恒温、60%~75%恒湿、12 h循环照明,自由摄食、饮水。所有动物饲养及其他试验操作均符合相关管理要求准则及试验动物伦理要求(动物伦理号:PZ-HNSZYY-2020-019)。
1.1.2 药物与试剂 丹参、川芎均购自河南中医药大学第一附属医院;4%多聚甲醛、HE染色试剂盒(G1120)均购自北京索莱宝科技有限公司。
1.1.3 主要仪器 HD-300型生物脱水机;HD-310型石蜡包埋机;HD-320型生物切片机;HD-330型摊片烤片机;光学显微镜。
1.2 方法
1.2.1 丹参-川芎有效活性成分收集与筛选 应用中药系统药理学数据库与分析平台 (traditional Chinese medicine systems pharmacology database and analysis platform,TCMSP,http:∥tcmspw.com/tcmsp.php),以丹参、川芎为关键词进行检索,基于口服生物利用度(OB)≥30%、类药性(DL)≥0.18为筛选条件获得各个丹参、川芎所含化学成分,构建丹参-川芎所含化学成分数据库。在Uniprot数据库(https:∥www.uniprot.org)中限定人源“Human”和已认证“Reviewed”的靶点并下载,在已收集好的丹参-川芎有效成分表格中,匹配对应的靶点基因名称,剔除重复值,得到完整的丹参-川芎有效成分潜在靶点列表。
1.2.2 疾病靶点的查找及共同靶点筛选 以“Ischemic stroke”为关键词在GeneCards人类基因数据库(https:∥www.genecards.org)和OMIM在线人类孟德尔遗传数据库(https:∥www.omim.org/)中检索,得到中风疾病靶点。
1.2.3 丹参-川芎药对治疗缺血性脑卒中潜在靶点蛋白互作(PPI)网络构建 利用韦恩图制作软件Venny 2.1.0 (http:∥bioin-fogp.cnb.csic.es/tools/venny/Index.html),将所有筛选出的药物靶点与疾病靶点输入并得到韦恩图,得到疾病与药物的共有靶点,将共有靶点输入STRING数据库(https:∥string-db.org/cgi/input.pl)进行PPI网络构建,将生物种类设定为Homosapiens,得到 PPI网络图。
1.2.4 丹参-川芎有效成分-缺血性脑卒中靶点网络构建 丹参-川芎是活血化瘀的常见药对,为了更加直观的理解丹参-川芎与缺血性脑卒中及相应靶点之间的相互关系,纳入中药活性成分、疾病与药物共有靶点、疾病,构建药物-成分-靶点-疾病网络图,导入Cytoscape 3.7.2(https:∥cytoscape.org/)软件中进行网络图的绘制。
1.2.5 关键成分GO功能与KEGG通路富集分析 将交集靶点输入Metascape 数据库(https:∥metascape.org),设置P<0.01,进行GO功能及KEGG通路富集分析。借助微生信(http:∥www.bioinformatics.com.cn)平台进行可视化分析。
1.3 丹参-川芎药对制备
查阅文献[7-9]将丹参、川芎按照1∶1的比例称取各药,加10倍量的蒸馏水,浸泡、武火煮沸、转文火煎、过滤,再加水煮沸、文火煎煮、滤液,合并2次药液,蒸发浓缩,高压灭菌,-20 ℃冰箱保存备用。
1.4 试验动物分组和给药
将雄性SD大鼠随机分成5组,每组10只,分别是假手术组、模型组、丹参-川芎低剂量组、丹参-川芎中剂量组、丹参-川芎高剂量组。给药剂量参照《人和动物间按体表面积折算的等效剂量比值表》[10],丹参-川芎高、中、低剂量组分别为8.10、4.05和2.025 g/kg,每日1次。造模前3 d丹参-川芎各剂量组予以灌胃给药,假手术组、模型组给予等体积的双蒸水,术后待大鼠清醒最后一次灌胃给药,于造模后24 h取材。
1.5 脑缺血再灌注大鼠模型的制备
参考Longa等[11]报道的线栓法制备脑缺血再灌注模型。将雄性SD大鼠用10%水合氯醛(350 mg/kg)腹腔注射麻醉,剪开左侧颈部皮肤,依次分离颈部肌肉、颈总动脉、颈内动脉、颈外动脉。微动脉夹夹闭颈内动脉,结扎颈外动脉、颈总动脉。距颈总动脉分叉处下端剪一V形切口,将线栓球形端插入颈内动脉,直至线栓标记点进入血管,有轻微阻力即可。插入线栓90 min后,轻柔拔出部分线栓实现再灌注。假手术组仅对上述血管进行剥离。大鼠伤口均匀洒青霉素粉末防感染,回笼饲养,正常供应水和饲料,观察动物状态。
1.6 神经功能缺损评分
采用Zea-longa 法[11]进行神经功能缺损评分。0分,无神经功能缺损,可正常活动;1分,神经功能轻微缺损,不能完全伸展患侧的前爪;2分,神经功能中度缺损,向患侧转圈;3分,神经功能重度缺损,向患侧倾斜;4分,不能自发行走,意识水平下降,甚至意识丧失;5分,死亡。
1.7 HE 染色观察脑组织病理形态
各组大鼠再灌注24 h后,10%水合氯醛腹腔注射麻醉,开胸经心脏灌注生理盐水200~300 mL,待右心耳流出清亮液体,4%多聚甲醛灌注200~300 mL,开颅取脑,4%多聚甲醛固定,石蜡包埋,进行HE染色。石蜡切片脱蜡透明复水,将切片放进苏木素染液染10~15 min后自来水冲洗。加入伊红染色液中15 s,蒸馏水清洗,将切片依次放入75%、85%、95%、100%乙醇梯度脱水2 min,二甲苯透明,中性树胶封片,自然晾干。光学显微镜下观察拍片,图像采集分析。
1.8 统计学分析
应用SPSS 22.0统计软件处理数据,计量资料采用平均值±标准差表示。数据符合正态分布且方差齐,采用t检验或单因素方差分析,若呈偏态分布或方差不齐的计量资料,采用非参数秩和检验。两两比较采用LSD检验,P<0.05表示差异显著。
2 结 果
2.1 丹参-川芎成分获取与筛选
根据TCMSP平台,以OB≥30%、DL≥0.18为条件,筛选丹参-川芎有效成分,本研究纳入72个活性成分,其中丹参活性成分65个,川芎活性成分7个,部分活性成分见表1。
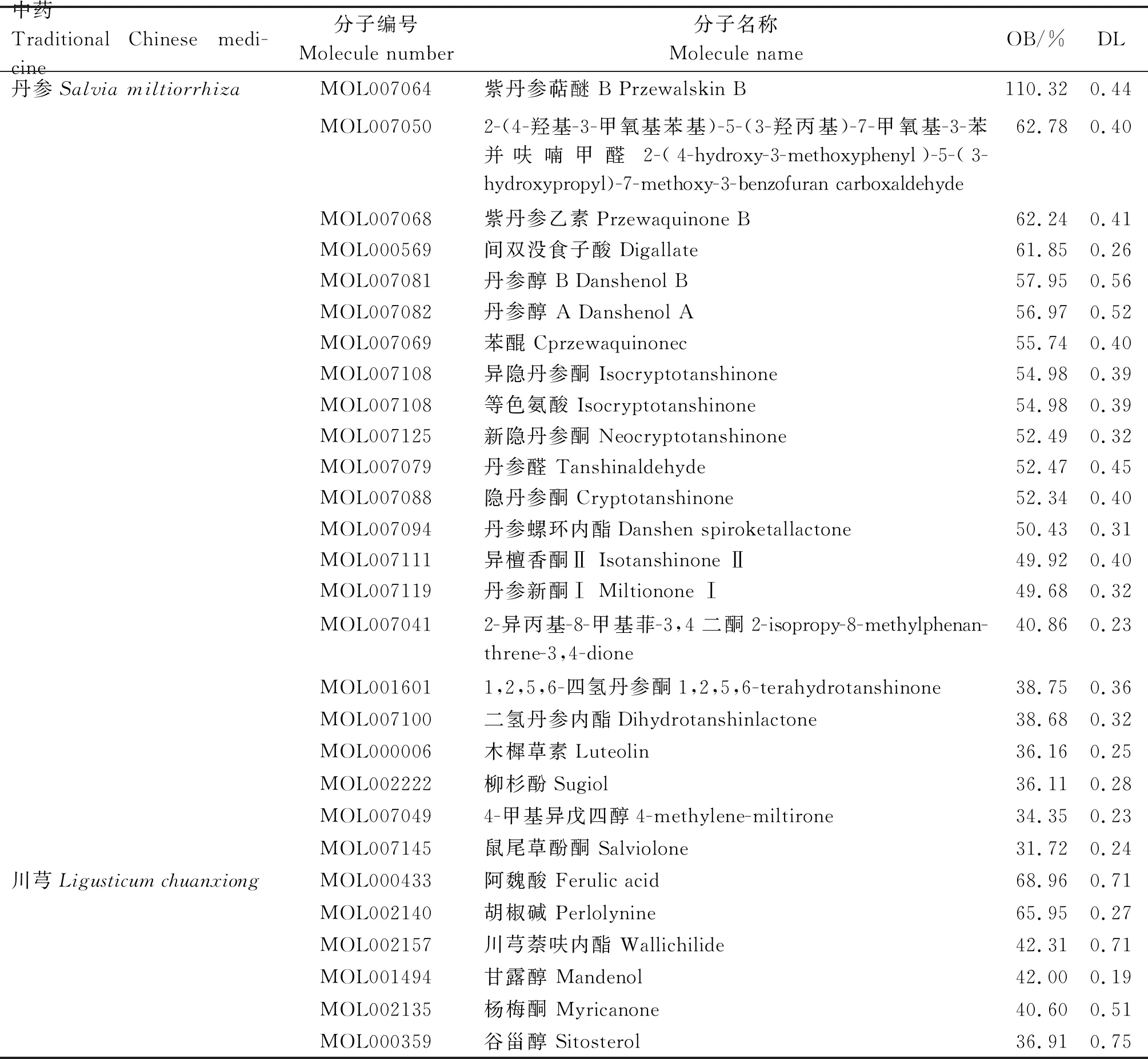
表1 丹参-川芎部分活性成分
2.2 丹参-川芎与缺血性脑卒中共有靶点韦恩图
利用GeneCards、OMIM数据库筛选疾病靶点,汇总并去除重复值,最终获得缺血性卒中疾病靶点1 972个,将139个丹参-川芎药物靶点与疾病靶点输入韦恩图在线制作软件Venny 2.1中,发现共有靶点94个(图1)。

图1 丹参-川芎治疗缺血性脑卒中共有靶点韦恩图
2.3 PPI网络图
采用STRING数据库对94个丹参-川芎潜在治疗缺血性卒中作用靶点进行PPI网络图分析,获得核心靶点PPI网络图(图2)。PPI网络中节点越大、颜色越深,表示该蛋白与其他蛋白的相互作用越密切。根据置信度筛选出前十位核心靶点,构建核心靶点PPI网络图见图3。排在前十位关键节点分别是AKT1、肿瘤坏死因子(tumor necrosis factor,TNF)、白细胞介素6(interleukin 6,IL6)、血管内皮生长因子A(vascular endothelial growth factor A,VEGFA)、肿瘤蛋白p53(tumor protein p53,TP53)、低聚果糖(fructooligosaccharides,FOS)、胱天蛋白酶 3(recombinant caspase 3,CASP3)、信号转导和转录激活因子3(signal transducer and activator of transcription 3,STAT3)、表皮生长因子受体(epidermal growth factor receptor,EGFR)、雌激素受体1(estrogen receptor 1,ESR1),推测其可能为丹参-川芎药对治疗缺血性脑卒中的重要靶点。

图2 药物疾病PPI网络图
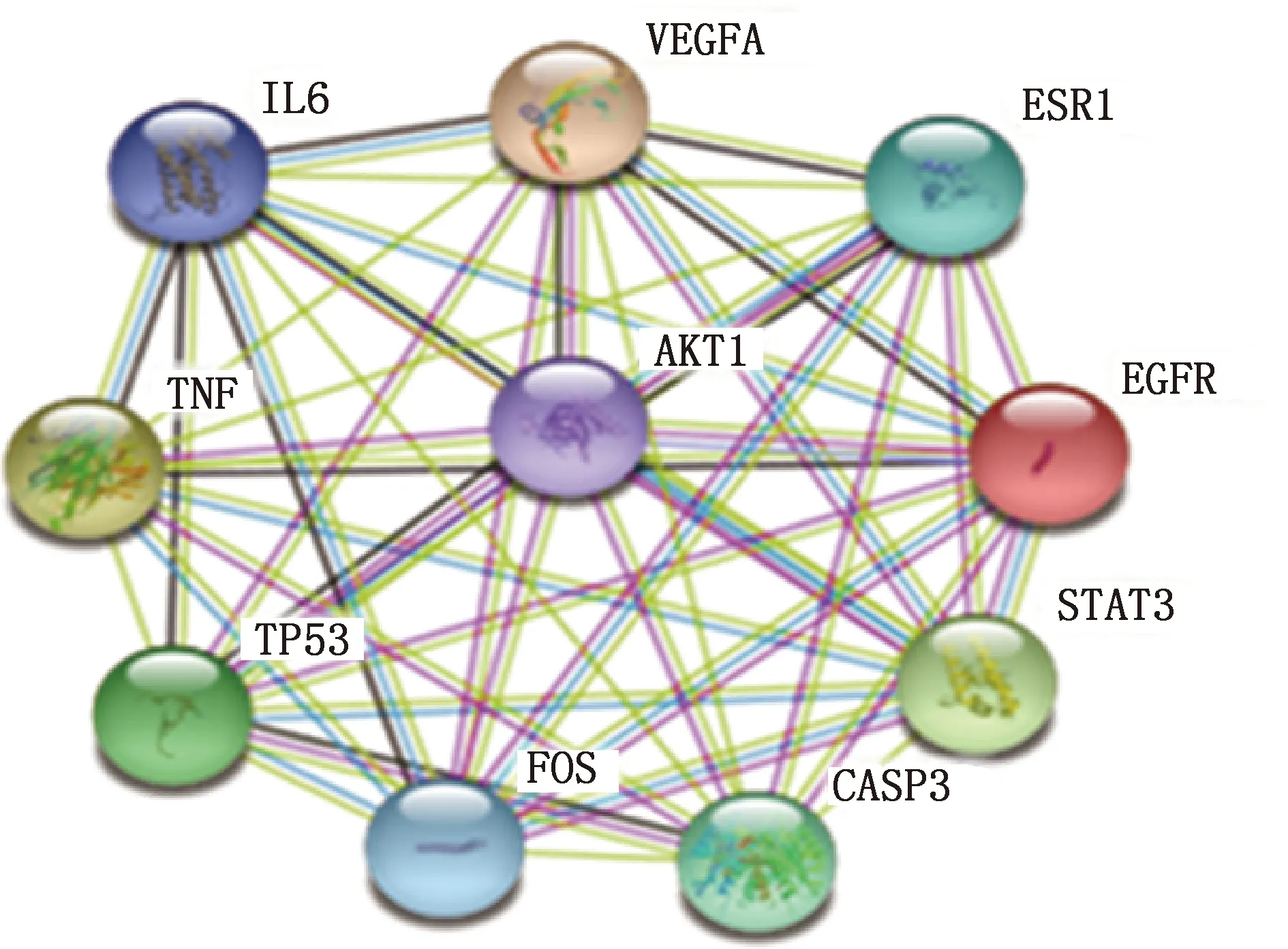
图3 核心靶点PPI网络图
2.4 丹参-川芎治疗缺血性脑卒中的药物-成分-靶点-疾病网络构建
通过Cytoscape 3.7.2软件,对丹参-川芎2味中药活性成分及其94个关键靶点基因进行网络构建及可视化处理。结果显示,丹参-川芎的活性成分的作用靶点均与缺血性脑卒中疾病靶点基因存在关联(图4)。

六边形代表疾病;圆形代表川芎有效活性成分;三角形代表丹参有效活性成分;菱形代表94个缺血性脑卒中与药对丹参-川芎的共同靶点
2.5 丹参-川芎治疗缺血性脑卒中潜在靶点GO功能富集分析
利用Metascape数据库对潜在作用靶点进行GO功能富集分析。以P<0.01作为筛选条件,分别进行生物过程(biological processes,BP)、分子功能(molecular function,MF)、细胞组分(cellular components,CC)分析,共得到GO条目5 587条。生物过程条目4 549条,包括细胞对氮化合物的反应、对激素的反应、蛋白质磷酸化的正调节、外源刺激的反应、循环系统过程、MAPK级联调节、对氧含量降低的反应、细胞迁移的正调控等;分子功能条目627条,包括儿茶酚胺结合、激酶结合、胺结合、蛋白质同源二聚体活性、DNA结合转录因子结合、核受体活性、肽结合、泛素连接酶结合等;细胞组分条目411条,包括膜筏、突触前膜的组成部分、感受器复合、转录调节复合物、核膜、内质网腔、膜侧、细胞投射膜等。富集结果前十个GO条目见图5。
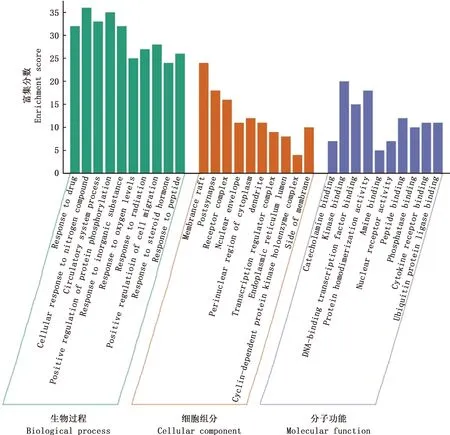
图5 丹参-川芎作用靶点GO功能富集图
2.6 丹参-川芎治疗缺血性脑卒中潜在靶点KEGG富集分析
在KEGG通路富集结果中共富集到114条相关信号通路,PI3K-Akt信号通路、神经活性配体受体相互作用信号通路、cAMP信号通路、cGMP-PKG信号通路等与丹参-川芎治疗缺血性脑卒中的作用机制紧密联系。如AGE-RAGE信号通路、FoxO信号通路、缺氧诱导因子1(HIF-1)、PI3K-AKT-mTOR信号通路在后20条通路中也有体现,也呈现出了一定的相关度。关系最紧密的前20条信号通路气泡图见图6。

图6 丹参-川芎治疗缺血性脑卒中作用靶点参与的信号通路富集信息气泡图
2.7 丹参-川芎对大鼠神经功能评分的影响
大鼠神经功能评分结果见图7,模型组大鼠再灌注24 h神经功能评分均显著高于假手术组(P<0.05),模型组与丹参-川芎低剂量组、丹参-川芎中剂量组之间无显著性差异(P>0.05);与模型组比较丹参-川芎高剂量组显著降低模型大鼠再灌注24 h的Zea-longa评分(P<0.05);丹参-川芎低、中剂量组有降低脑缺血再灌注损伤24 h Zea-longa评分的趋势。

①A,假手术组;B,模型组;C,丹参-川芎低剂量组;D,丹参-川芎中剂量组;E,丹参-川芎高剂量组。下同。②模型组与假手术组相比,*,差异显著(P<0.05)。各剂量组与模型组相比,#,差异显著(P<0.05);无#,差异不显著(P>0.05)
2.8 丹参-川芎对脑缺血再灌注损伤大鼠脑组织病理学的影响
由图8可知,假手术组大鼠缺血半暗带皮层神经细胞形态基本正常,具有完整的结构,排列整齐,细胞核清晰;与假手术组大鼠比较,模型组大鼠神经细胞减少明显,排列紊乱,细胞核固缩深染,形成较多的空泡,周围存在激活的小胶质细胞;与模型组大鼠比较,丹参-川芎给药组神经细胞结构较完整,细胞形态改变较轻,核固缩少,细胞质较饱满丰富,且丹参-川芎对脑组织损伤的改善程度随着丹参-川芎药对剂量增大而逐渐增强,提示丹参-川芎药对可改善脑缺血再灌注大鼠的脑损伤。
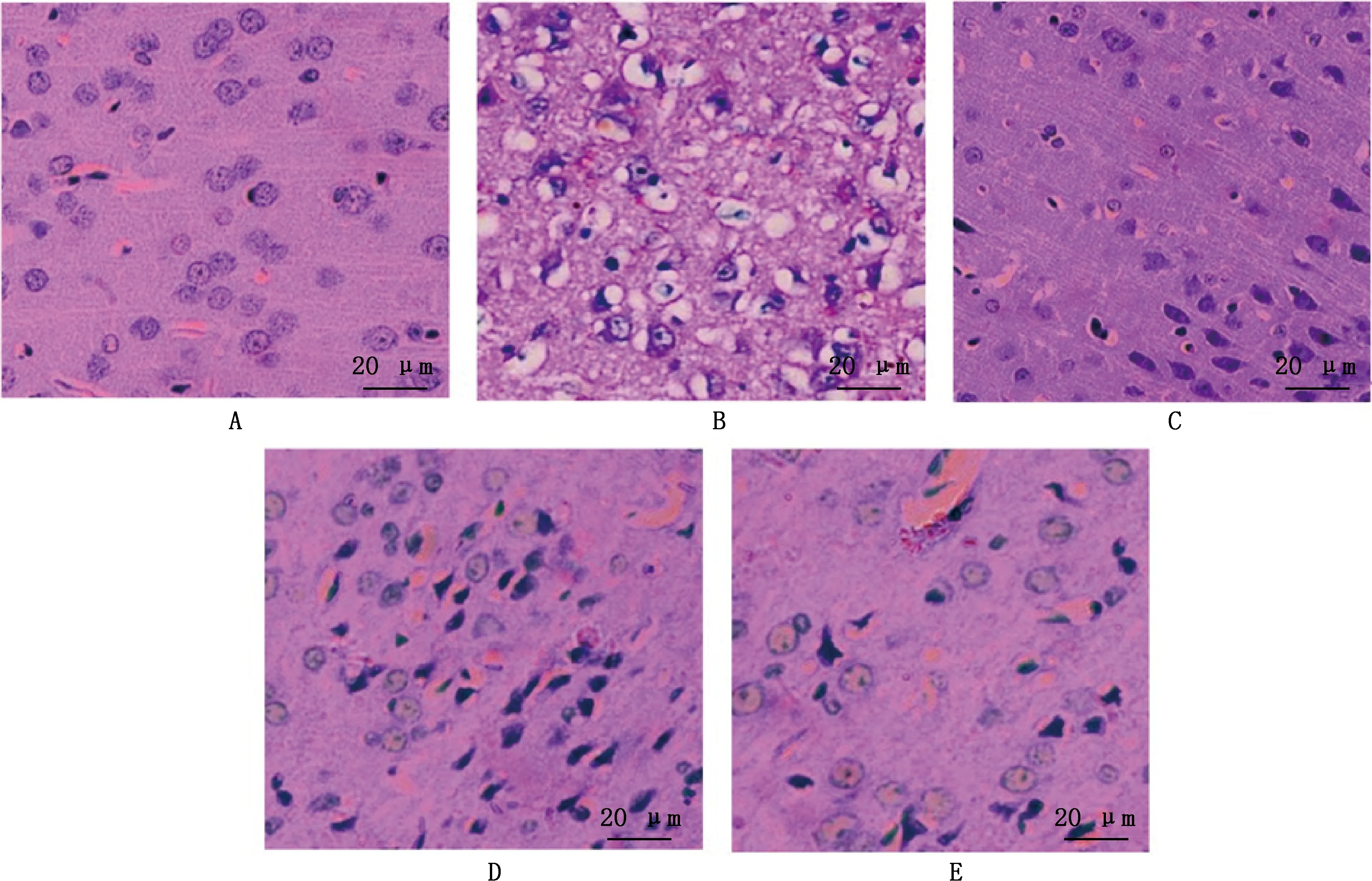
图8 各组大鼠脑组织HE染色观察(400×)
3 讨 论
缺血性脑卒中发病机制复杂,卒中后可引起不同程度的神经损伤症状。研究表明,脑卒中后损伤的关键机制包括神经细胞的凋亡、Ca2+超载、氧化应激和炎症等病理反应相关[12]。针对上述病理机制,现代医学主要采用溶栓、钙通道颉颃剂、自由基清除剂、谷氨酸颉颃剂、细胞膜稳定剂等药物对症治疗,但对于脑缺血后的损伤治疗效果不佳[13]。丹参-川芎作为活血化瘀的良药,临床常用于治疗缺血性脑卒中,但其作用机制不太明确。
丹参-川芎作为活血化瘀的常用药对,在治疗缺血性脑卒中方面发挥较好的疗效。周惠芬等[14]采用氧糖剥夺-复氧法,建立体外脑缺血再灌注损伤模型,发现丹参-川芎有效成分配伍通过减轻氧化应激、炎症损伤和抑制细胞凋亡保护氧糖剥夺海马神经元。惠贤瑞等[15]发现,丹参-川芎中药制剂冠心宁片可降低脑缺血再灌注小鼠神经功能评分、减轻脑梗死面积、改善脑组织病理学形态、神经元损伤及细胞凋亡。杨喜忠等[16]观察50位脑梗死患者发现,冠心宁注射液对早期脑梗死具有较好效果。王丽萍等[17]发现急性脑梗死患者应用丹参-川芎注射液联合依达拉奉治疗优于依达拉奉的临床疗效。丹参-川芎嗪注射液[18]可能通过下调GMP-140和vWF含量,改变血瘀模型大鼠的血液流变学指标。药理学研究发现,丹参[19-20]的活性成分具有抗炎、抗氧化、保护神经功能等作用,川芎[21]有效活性成分具有改善微循环、抗炎、抗氧化、细胞保护等作用。
网络药理学通过PPI网络图分析结果显示,丹参-川芎有效组分配伍作用于缺血性脑卒中的重要靶点包括Akt1、TNF、IL6、VEGFA、ESR1等94个。PI3K的下游关键靶点是Akt,脑缺血后PI3K/Akt信号通的激活对抑制神经元凋亡和神经炎症具有重要作用[22]。本课题组前期研究表明,大鼠脑缺血再灌注后,PI3K/Akt信号通路的激活,诱导Akt磷酸化对神经血管单元具有保护作用[23]。TNF、IL6是介导炎症级联反应的细胞因子,脑缺血时,炎症因子聚集刺激引起NF-κB迅速活化促进炎性因子的表达,引起组织的炎症反应,加重神经元的损伤[24]。在脑缺血后,VEGFA通过促进损伤后的脑内神经血管单元的重构起到保护神经元的作用[25]。ESR1编码雌激素受体的亚型ERα,它们与雌激素结合后发挥生物学效应,脑缺血后,神经保护和认知功能的修复都与ESR1有关,宋先兵[26]发现在大鼠去卵巢局灶性脑缺血模型中,雌激素具有神经保护和认知修复作用。
通过GO功能和KEGG通路富集分析显示,丹参-川芎治疗缺血性脑卒中涉及多种生物过程和多个信号通路,相关性较高的信号通路包括PI3K-Akt、cGMP-PKG、cAMP、VEGF等信号通路,主要在抑制炎症反应、抑制细胞凋亡、保护神经功能、促进血管内皮生成等过程中发挥抗脑缺血损伤作用。缺血性脑卒中是一种多因素多基因的疾病,发病机制错综复杂,脑缺血后损伤是一种迅速而又复杂的过程,细胞的死亡在此过程中意义重大,PI3K-Akt信号通路[27]是脑卒中后细胞程序性死亡的关键靶点。环磷酸鸟苷(cGMP)和环磷酸腺苷(cAMP)作为第二信使调节激素和神经递质的释放,cGMP通过cGMP依赖性蛋白激酶(PKG)对蛋白质磷酸化的作用来介导细胞的生理效应,cAMP通过激活APK使蛋白磷酸化从而调节细胞反应[28]。脑缺血情况下,脑内的环核苷酸被激活,潘建玲等[29]发现在脑缺血再灌注模型大鼠中,cAMP、cGMP的含量对脑缺血后抗氧化应激能力具有重要意义。Akt 是PI3K的下游靶标,PI3K/Akt通路在小脑神经元中介导cGMP依赖性生存作用,PI3K/Akt通路的激活介导了来自脑室下区的成体祖细胞cGMP增强的神经发生[30]。大鼠脑缺血再灌注损伤后,通过激活VEGF介导的PI3K-Akt信号通路缓解脑缺血再灌注的损伤[27,31]。
综上所述,本研究通过网络药理学的方法验证了丹参-川芎治疗缺血性脑卒中的理论依据,通过关键疾病药物的共同靶点预测出丹参-川芎治疗缺血性脑卒中的重要信号通路,主要包括PI3K-Akt、cGMP-PKG、cAMP、VEGF等信号通路,动物试验验证丹参-川芎药对可改善脑缺血再灌注损伤模型大鼠的神经功能损伤,改变脑缺血再灌注损伤后脑组织病理形态变化,从而发挥神经保护作用,并呈现剂量相关性,本研究体现了丹参-川芎多靶点的作用特点,对明确丹参-川芎抗脑缺血再灌注损伤的机制具有重要意义。这些研究结果为丹参-川芎治疗脑缺血再灌注损伤的作用机制提供理论支持,但仍需通过更多的基础试验进行后续验证。
4 结 论
本研究结果显示,丹参-川芎治疗脑缺血再灌注损伤可能是通过参酮ⅡA、隐丹参酮、丹参酮Ⅰ、阿魏酸等药物活性成分,作用于AKT1、TNF、IL6、VEGFA、TP53、FOS、CASP3、STAT3、EGFR、ESR1等核心靶点,通过PI3K-Akt、cGMP-PKG、cAMP、VEGF信号通路对脑缺血再灌注损伤产生治疗作用。丹参-川芎可减轻急性脑缺血再灌注模型大鼠神经功能评分,改善脑缺血再灌注损伤后大鼠脑组织病理形态变化,为丹参-川芎治疗急性脑缺血再灌注损伤提供有力证据。

