蛹虫草培养残基中虫草素的水热回流提取及含量测定
彭志苹,张景艳,郭志廷,王 磊,张 凯,张 康,王贵波,仇正英,王学智,李建喜
(中国农业科学院兰州畜牧与兽药研究所,甘肃省中兽药工程技术研究中心,兰州 730050)
蛹虫草(Cordycepsmilitaris(Linn.) Link.)又称北虫草、蛹草、蛹草菌,为麦角菌科虫草属,性平味甘,入肺、肾二经,具有补精益髓、润肺补肾、止咳化痰等功效[1-2]。研究证明,蛹虫草与冬虫夏草的化学成分和药理作用相似,具有降血糖、降血脂、抗炎、抗肿瘤、抗病毒、抗菌、抗氧化和免疫调节等药理作用[3-5]。蛹虫草最初发现于自然界,目前已实现了规模化人工培养,以固体培养方式为主,培养基由大米、小麦、高粱等组成,子实体采摘后,会剩余大量培养残基[6]。这些培养残基长满菌丝体,内含子实体相同的虫草素、虫草多糖等有效成分,具有二次开发利用价值。实际生产中,蛹虫草培养残基开发利用较少,大部分被丢弃,造成了资源浪费和环境污染,因此迫切需要开展其有效成分的提取研究[7]。据报道,蛹虫草活性成分提取方法主要有水热回流法、浸提法、醇热回流法、超声波法、超声波辅助酶提取法等[8-9],其中水热回流法提取工艺简单,具有不使用有机溶剂、成本低、便于规模化生产等优点。虽然,王英娟等[10]和雷燕妮等[11]分别将水热回流法用于蛹虫草子实体和菌渣中有效成分提取,建立了相关工艺流程和参数,但因蛹虫草培养基配方存在差异,针对不同培养残基中有效成分提取的相关参数还需进一步筛选与优化。影响水热回流法提取中药有效成分的主要因素包括粉碎粒度大小、提取温度、提取时间、提取次数和液料比等[12]。鉴于此,本研究以液料比、提取次数、提取温度、提取时间4个因素进行单因素试验和正交试验,优化水热回流法提取蛹虫草培养残基虫草素的工艺,并利用高效液相色谱测定法(high-performance liquid chromatography,HPLC)对提取物中虫草素含量进行验证,以期为蛹虫草培养残基深入研究和开发利用提供科学依据。
1 材料与方法
1.1 材料
蛹虫草培养残基由山东奥美生物工程有限公司提供。虫草素标准品(纯度≥98%,上海源叶生物科技有限公司);腺苷标准品(纯度≥99%,上海源叶生物科技有限公司);乙腈、甲醇(色谱纯,赛默飞世尔科技(中国)有限公司)。
U-3000高效液相色谱仪(戴安中国有限公司);KQ-600DE型数控超声波清洗器(昆山市超声仪器有限公司);LGJ-10F真空冷冻干燥机(北京松源华兴科技发展有限公司);ZNCLT-500系列磁力搅拌器(上海瑞兹仪器设备有限公司);CS-2000高速多功能粉碎机(永康市天祺盛世工贸有限公司);Allegra X-15R贝克曼台式冷冻离心机(贝克曼库尔特商贸(中国)有限公司)。
1.2 蛹虫草培养残基提取工艺流程
蛹虫草培养残基经粉碎后过40目筛,称取适量粉末于三口烧瓶中,按相应比例加入蒸馏水,置电热套上,加热回流,室温冷却后4 000 r/min离心10 min,取上清液,沉淀按相同程序重复提取。合并上清液,搅拌浓缩至200 mL,冷却至室温后―80 ℃预冻,真空冷冻干燥后备用。
1.3 HPLC测定提取物中虫草素含量
参照行业标准NY/T 2116—2012虫草制品中虫草素和腺苷测定[13-14]。
1.3.2 供试品溶液制备 精密称取0.0500 g样品于容量瓶中,加适量超纯水溶解,超声30 min,定容至10 mL。取1 mL样液过0.45 μm微孔滤膜,滤液供HPLC测定。
1.3.3 标准曲线绘制 精密称取虫草素和腺苷标准品各2.50 mg,超纯水溶解,定容至25 mL,摇匀。该混合标准储备液中虫草素和腺苷的质量浓度均为100 mg/L,4 ℃保存。分别准确取0.1、0.2、0.5、1.0、2.0和5.0 mL混合标准溶液于10 mL容量瓶中,超纯水定容至10 mL,浓度分别为1.0、2.0、5.0、10.0、20.0和50.0 mg/L。依据色谱测定条件,以虫草素质量浓度为横坐标、相应峰面积为纵坐标制作标准曲线。
1.3.4 精密度 吸取1 mL供试品溶液,在相同色谱条件下,连续进样6次,计算峰面积测量值相对标准偏差(RSD),RSD≤2%。
1.3.5 重复性 分别制备供试品溶液6份,在相同色谱条件下各进样1次,计算峰面积测量值RSD,RSD≤2%。
1.3.6 稳定性 吸取1 mL供试品溶液,在相同色谱条件下,于0、2、4、6、8、10、12、18和24 h各进样1次,计算峰面积测量值RSD,RSD≤2%。
1.3.7 准确度 分别制备供试品溶液9份,每份准确吸取5 mL供试品溶液于10 mL容量瓶,分别按照标准品加入量与所取供试品中待测成分量1.5∶1、1∶1、0.5∶1配制,得到浓度分别为150%、100%、50%(M/M)溶液,每个浓度重复3次。在相应色谱条件下分别进样1次,计算回收率。
回收率(%)=(供试品实测成分量―供试品原成分量)/对照品加入量×100%
以护理前后ADL评分、FMA评分为评比项进行对比。日常生活活动能力(ADL)评分,总分100分,>61分表示日常生活活动能力有轻度的功能损害,41~60分表示中度损害,<40分表示重度损害。简式Fugl-Meyer评测法(FMA)评分,进行上肢、下肢运动功能的评定,运动功能程度与分数呈正相关。
1.3.8 结果计算 按照保留时间定性,样品与标准品保留时间RSD≤2%,多点校正外标法定量。根据线性回归方程计算样品质量浓度(mg/L),试验样品中虫草素含量以质量分数ω计,单位以mg/g表示,按以下公式计算。
ω=ρ×V×m2/(m1×M×1000)
式中,ρ,供试品中虫草素质量浓度(mg/L);V,供试品最终体积(mL);m1,供试品质量(g);m2,水提物的质量(g);M,蛹虫草培养残基的质量(g)。
1.4 单因素考察蛹虫草培养残基提取工艺
按照1.2方法分别考察液料比、提取次数、提取温度和提取时间对蛹虫草培养残基提取工艺的影响。各因素考察水平如下:液料比(5∶1、10∶1、15∶1、20∶1、25∶1)、提取次数(1、2、3、4、5次)、提取温度(60、70、80、90、100 ℃)、提取时间(30、60、90、120、150 min),按照1.3方法测定各因素水平下虫草素含量,每个水平重复3次。
1.5 正交试验优化蛹虫草培养残基提取工艺
在单因素试验基础上,利用正交试验对提取工艺进行进一步优化。选用L9(34)正交设计模型,选择4个因素:液料比(A)、提取次数(B)、提取温度(C)、提取时间(D),各因素间不考虑交互作用,每个因素各有3个水平(表1)。分别取9份10.0 g蛹虫草培养残基,按1.2和1.3方法提取并测定提取物中虫草素含量,每个处理重复3次。
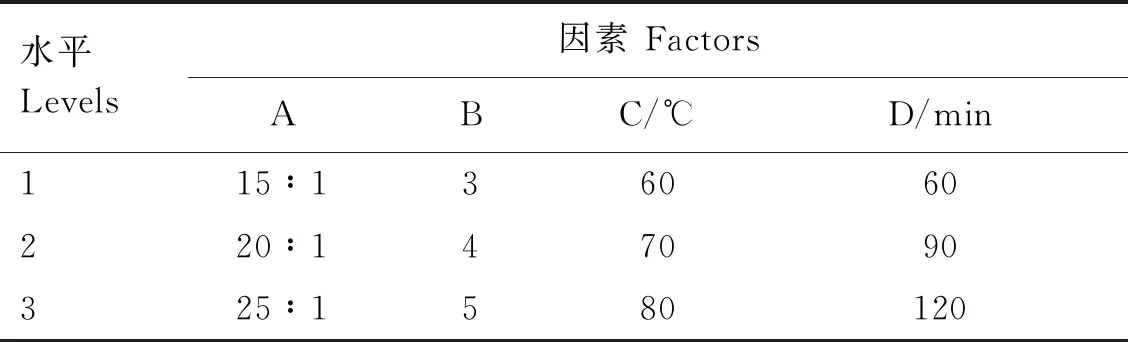
表1 影响蛹虫草培养残基提取的因素及水平
1.6 提取回收率试验
分别称取2.0 g已知含量的蛹虫草培养基12份,按照虫草素对照品加入量与所取供试品中待测成分量之比1.5∶1、1∶1、0.5∶1、0∶1配制,得到浓度分别为150%、100%、50%、0(W/W)的溶液,每个浓度重复3次,根据正交试验结果确定的提取工艺制备供试品溶液。在相应色谱条件下分别进样1次,计算回收率及RSD。
1.7 数据统计分析
采用SPSS 26.0统计软件中单因素方差分析和正交设计方差分析进行数据统计处理,数值以平均值±标准差表示。P<0.05表示差异显著;P<0.01表示差异极显著。
2 结 果
2.1 方法学考察
2.1.1 系统适应性 各取3份混合对照品溶液、蛹虫草培养残基供试品溶液和空白溶剂,分别开展HPLC试验,结果见图1。由图1可知,样品中虫草素的分离度和理论塔板数良好,分离度>1.5,理论塔板数>12 000,不对称因子在1.00~1.20之间,且没有阴性干扰。

图1 混合标准品(A)、供试品(B)和空白溶剂(C)的HPLC色谱图
2.1.2 线性范围 以虫草素质量浓度为横坐标、峰面积为纵坐标绘制标准曲线,结果见图2。由图2可知,虫草素的线性回归方程为:y=0.6888x-0.1629,R2=0.9999。表明虫草素质量浓度在1.00~100 mg/L范围内线性相关性良好。
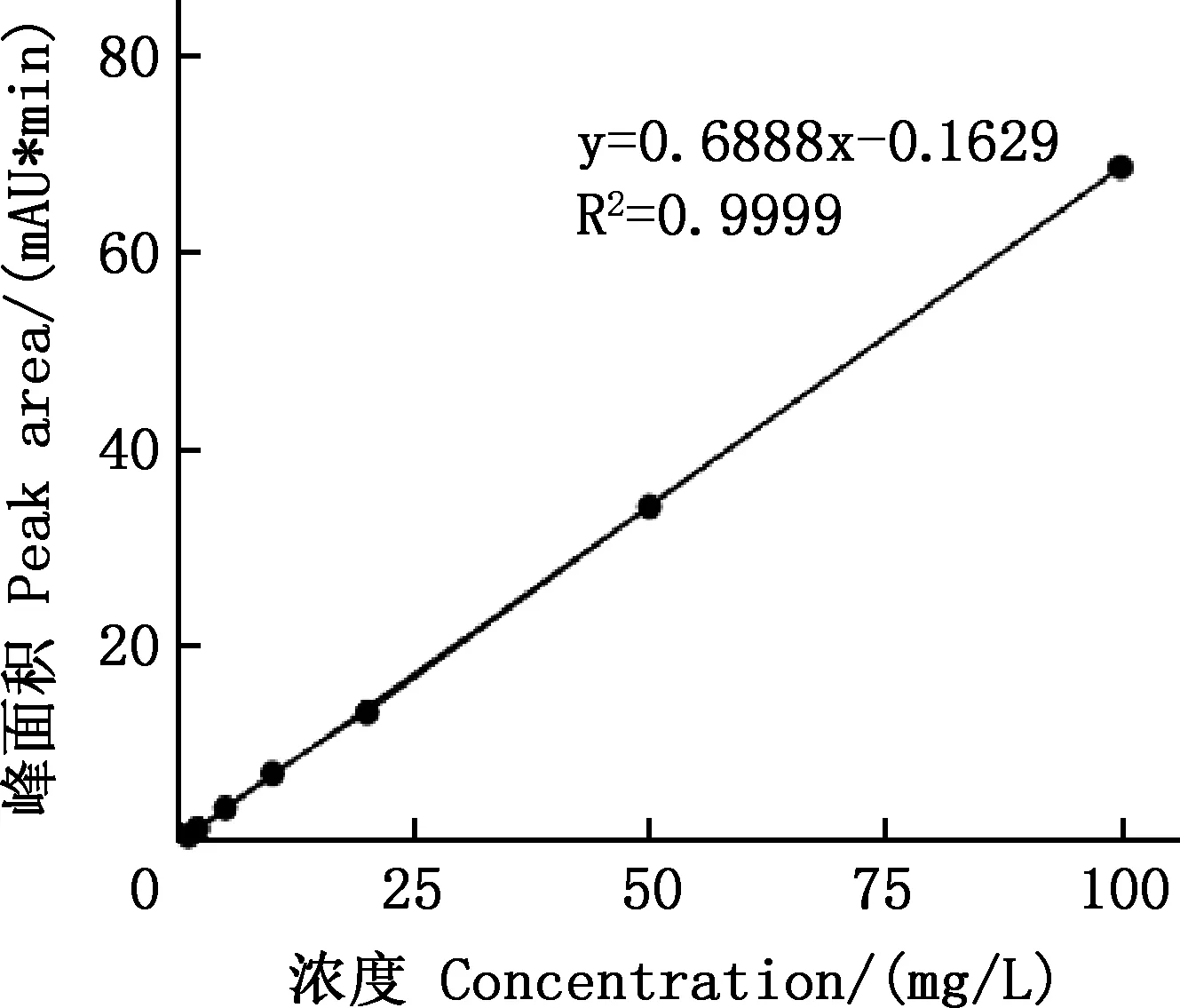
图2 虫草素的标准曲线
2.1.3 精密度、重复性和稳定性 由表2可知,同一供试品溶液重复测定6次,结果显示,虫草素峰面积为18.75 mAU*min,RSD为0.85%,表明仪器精密度良好;同一批次的6个供试品溶液各测定1次,结果显示,虫草素峰面积为18.72 mAU*min,RSD为0.46%,表明方法重复性良好;同一供试品溶液分别于0、2、4、6、8、10、12、18和24 h时各测定1次,结果显示,虫草素峰面积为18.43 mAU*min,RSD为1.71%,表明供试品溶液在24 h内稳定。

表2 HPLC方法的精密度、重复性和稳定性测定
2.1.4 准确度 取50%、100%、150%的供试品溶液,在相应的色谱条件下各测定1次,计算加样回收率,结果显示,加样回收率为103.55%,RSD为2.64%(表3),表明该方法准确度良好。

表3 HPLC方法的准确度测定
2.2 单因素试验
2.2.1 液料比 由图3A可知,随着液料比的增加,虫草素含量呈先上升后下降趋势。在液料比为20∶1时,虫草素含量达到最高,为1.32 mg/g,显著高于液料比5∶1和10∶1(P<0.05),与液料比15∶1和25∶1时差异不显著(P>0.05)。故选择20∶1为最佳液料比,确定正交设计中液料比的3个水平分别为15∶1、20∶1和25∶1。
2.2.2 提取次数 由图3B可知,虫草素含量随着提取次数增加而增加。在提取5次时,虫草素含量最高,为1.34 mg/g,显著高于提取1、2和3次(P<0.05),与提取4次差异不显著(P>0.05)。故选择5次为最佳提取次数,确定正交设计提取次数的3个水平分别为3、4和5次。
2.2.3 提取温度 由图3C可知,虫草素含量随着提取温度增加而下降,至90 ℃时虫草素含量最低;提取温度为70 ℃时,虫草素含量最高,为1.22 mg/g,显著高于90 ℃(P<0.05),与其他3个提取温度均差异不显著(P>0.05)。故选择最佳提取温度为70 ℃,确定正交设计中提取温度的3个水平分别为60、70和80 ℃。
2.2.4 提取时间 由图3D可知,虫草素含量在不同提取时间均无显著差异(P>0.05)。在提取时间为60 min时,虫草素含量最高,为1.11 mg/g。故选择最佳提取时间为60 min,确定正交设计中提取时间的3个水平分别为60、90和120 min。

肩标不同字母表示差异显著(P<0.05);肩标相同字母表示差异不显著(P>0.05)
2.3 正交试验设计结果
在单因素试验基础上,对液料比(A)、提取次数(B)、提取温度(C)、提取时间(D)4个因素进行正交试验。由表4的极差分析可知,在选定的试验范围内,影响虫草素含量的因素主次顺序为:提取时间>提取次数>液料比>提取温度,因素水平的最佳参数组合为A3B3C1D1。由表5的方差分析可知,提取时间和提取次数对虫草素含量有显著影响(P<0.05),提取温度和液料比对虫草素含量影响不显著(P>0.05)。表明影响虫草素含量的因素水平的最佳参数组合为B3D1,即最佳提取次数5次、提取时间60 min,液料比和提取温度对提取工艺影响较少。综合单因素试验和正交试验的结果,确定最佳提取工艺参数的液料比为25∶1、提取次数为5次、提取温度为70 ℃和提取时间为60 min。
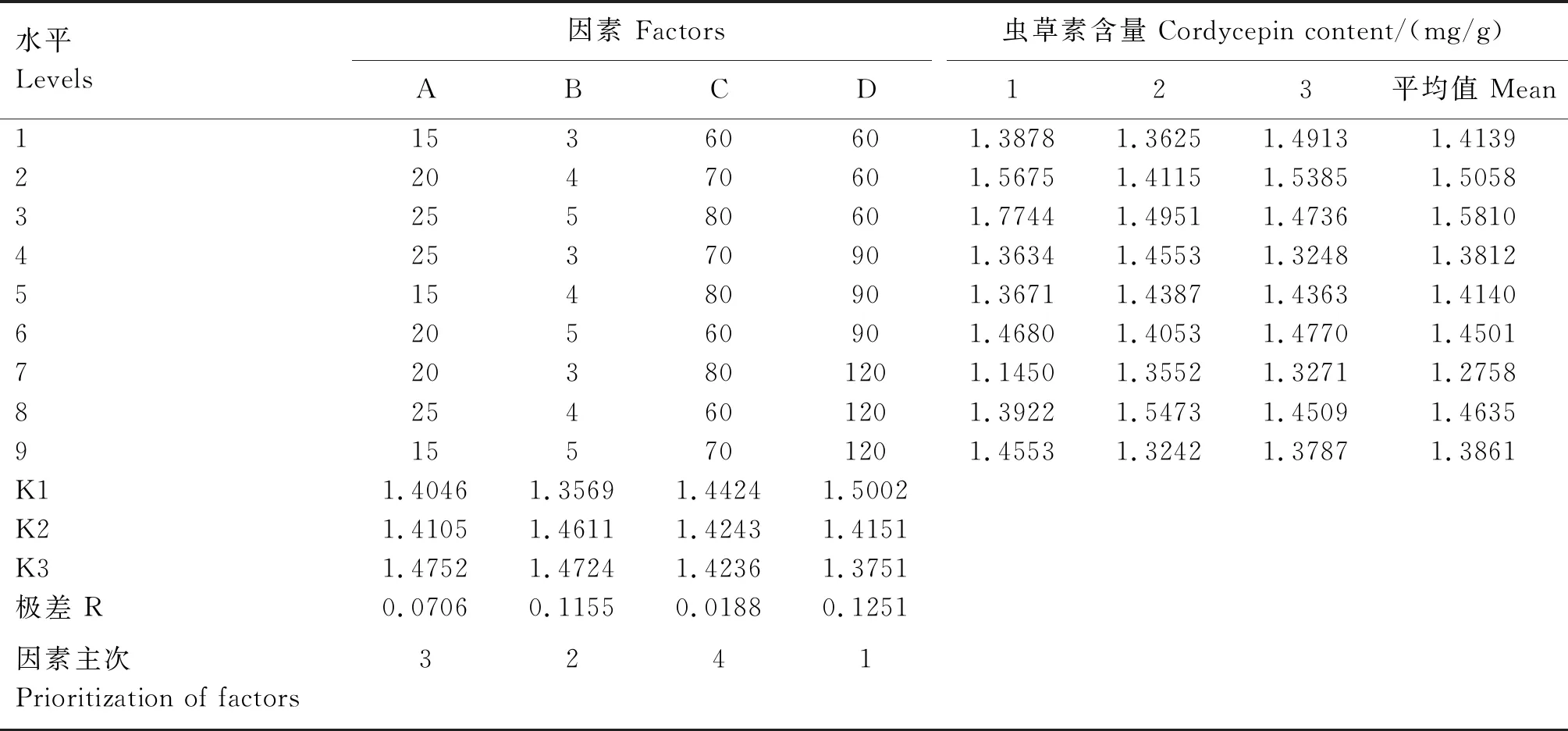
表4 正交设计的试验结果及极差分析
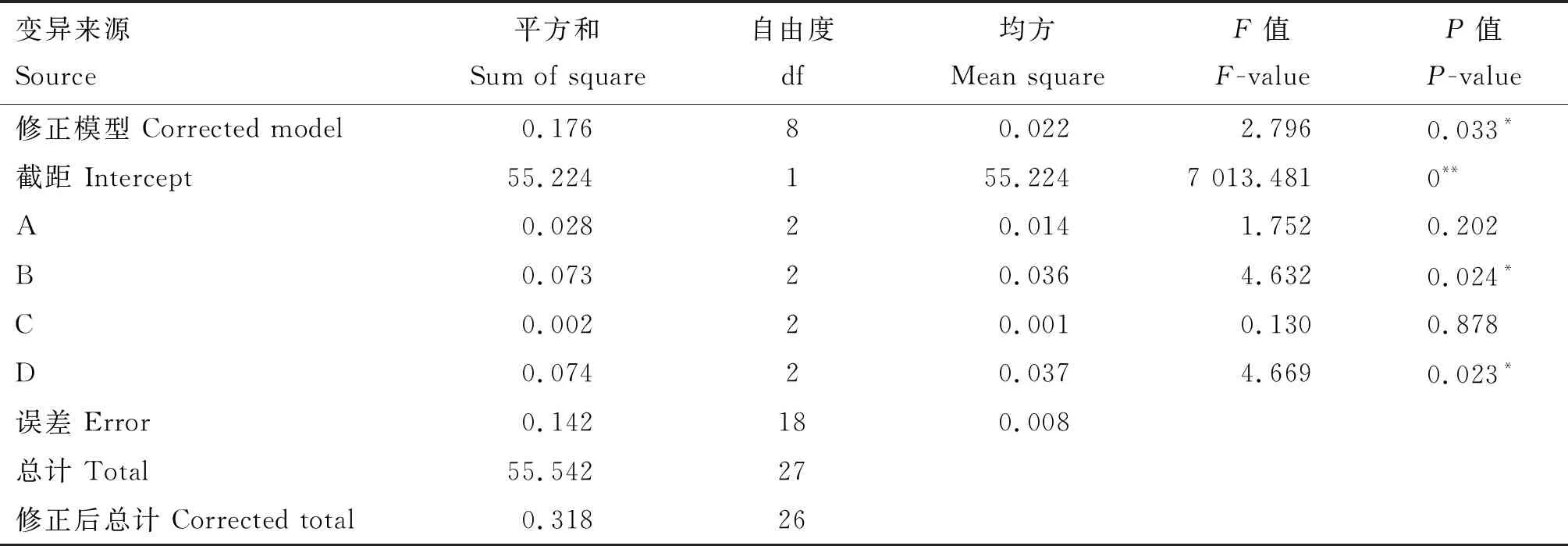
表5 正交设计的方差分析
2.4 提取回收率试验
由表6可知,在最佳提取条件下,测得蛹虫草培养残基中虫草素含量为1.48 mg/g;50%、100%、150%的供试品溶液在相应的色谱条件下各进样1次,结果显示,虫草素的平均提取回收率为92.56%,RSD为4.54%,表明蛹虫草培养残基的提取工艺良好。
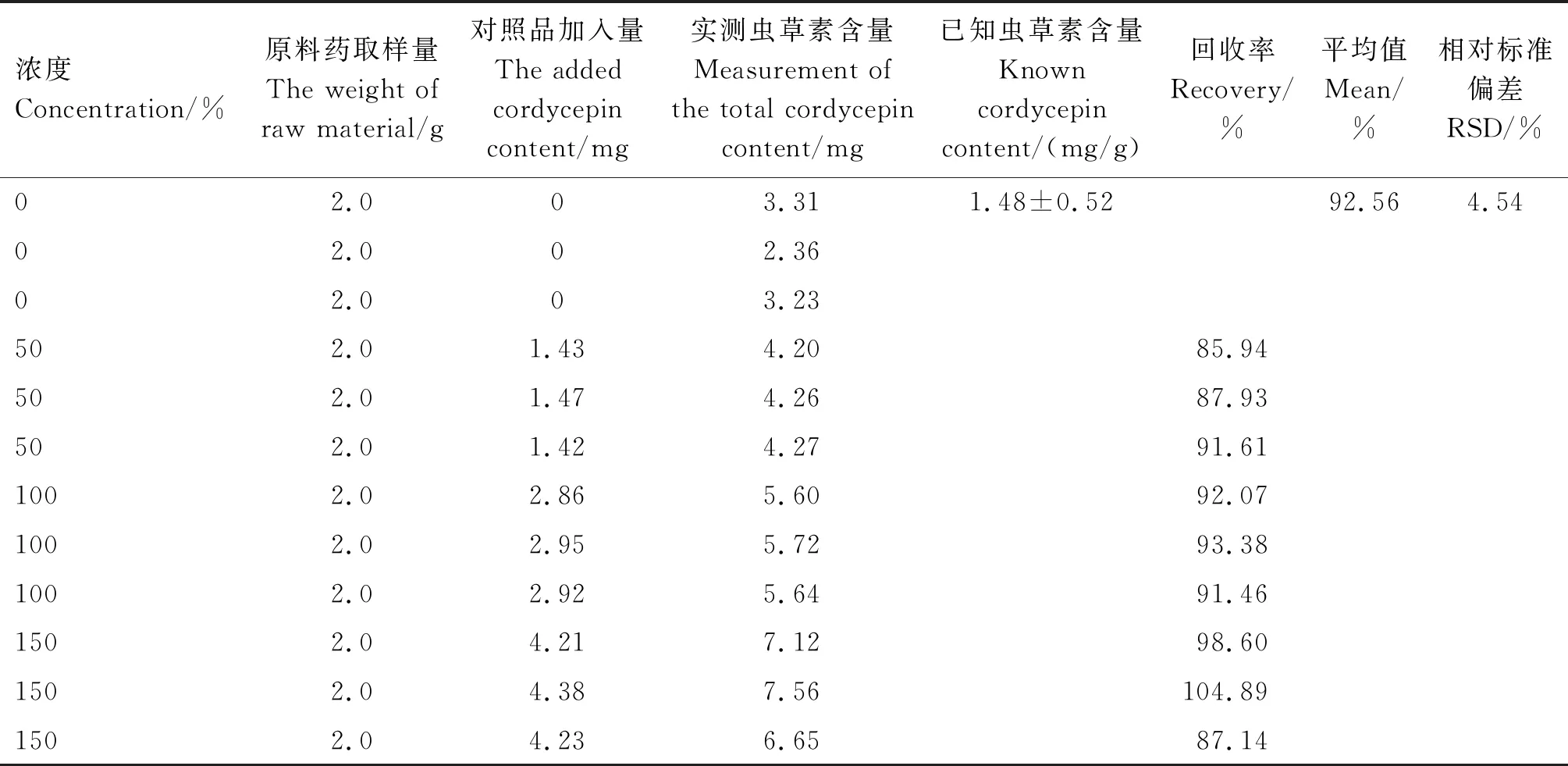
表6 提取回收率测定
3 讨 论
蛹虫草培养残基与其子实体一样,含有虫草素、腺苷、虫草酸、虫草多糖、超氧化物歧化酶、类胡萝卜素、凝集素、纤维蛋白溶解酶等多种有效成分,其中虫草素和虫草多糖关注度最高[4,15]。研究发现,采用柱层析方法对蛹虫草培养残基进行提取、分离和纯化,成功制备出高纯度的虫草素[16]。本试验使用的蛹虫草培养残基原料为燕麦,内含大量淀粉类物质,这些物质在提取过程中会被分解为多糖,从而干扰虫草多糖测定,因此一般以检测提取物中虫草素含量作为评价蛹虫草培养残基提取工艺的指标。虫草素的测定方法主要有分光光度法、薄层色谱扫描法和HPLC法等[17]。分光光度法和薄层色谱法操作简单、成本低,但检测结果重复性差、误差大;HPLC法具有重现性好、测定结果准确、灵敏度高、受样品基质影响小等优点,是目前测定虫草属中虫草素含量最常用的方法[17-18]。本研究参照行业标准[13],验证了蛹虫草培养残基水提物中虫草素含量的HPLC测定方法,考察了该方法的专属性、系统适用性、线性范围、精密度、重复性、稳定性和准确度,结果显示,虫草素质量浓度在1.00~100 mg/L范围内线性相关性高,结果稳定可靠,方法简单,灵敏度高,这与李剑梅等[19]研究结果相近,表明该方法适用于蛹虫草培养基中目标样品的检测。
中药的现代提取方法包括超声波法、加速溶剂萃取法、超高压萃取法等,具有溶剂消耗少和提取时间短等优点,但技术含量需求高、成本也高[8],不易推广普及。因此,中小企业更愿意选择工艺流程简单、成本低的传统提取方法,如浸提法和水热回流法等[8]。中药提取方法的选择,还与提取物有效成分的极性有关。研究发现,虫草素易溶于水、甲醇和热乙醇,不溶于氯仿和乙醚等[20];虫草多糖易溶于水,难溶于有机溶剂和高浓度乙醇[21],故常用水和乙醇为提取溶剂。Luo等[22]比较了水热回流法和超声提取法提取蛹虫草子实体的虫草素,发现水热回流法的虫草素提取率(95.02%)略低于超声提取法(96.12%)。雷燕妮等[11]分别选用水和乙醇为提取溶剂,比较了热回流法和超声波辅助提取法对蛹虫草菌渣中虫草素、虫草多糖和蛋白质得率的影响,结果发现,水热回流法既可提取蛹虫草菌渣中虫草素,又可提取虫草多糖和蛋白质。水热回流法与超声提取法相比,具有操作简单和成本低等优点,但其提取率受提取物粒径大小、温度、时间、提取次数、液料比等提取因素的影响[11,23]。因此,学者们采用水热回流法时常常会对提取工艺进行优化。本试验结果表明,提取时间和提取次数对虫草素含量的影响显著,而液料比和提取温度影响不显著,其中影响程度依次为提取时间、提取次数、液料比和提取温度。常正姣[24]采用单因素结合响应面法优化杂粮蛹虫菌丝共生体的水浴提取条件,发现影响虫草素含量的3个因素主次顺序为浸提时间、液料比、浸提温度,与本试验研究结果相近。孟胜楠[25]采用水热浸提法提取蛹虫草小麦培养基,结果显示,在提取温度63.3 ℃、提取时间4.8 h、液料比36.8∶1、提取液pH 6.7时,提取物中虫草含量最高,为1.32 mg/g。张丽艳[26]采用水热浸提法提取蛹虫草大米培养基,结果显示,在提取温度40 ℃、提取次数4次、液料比为20∶1、提取时间2 h时,提取物中虫草素得率最高,为0.69%。本研究通过单因素试验和正交试验,确定的蛹虫草培养残基中虫草素的最佳提取工艺参数为液料比25∶1、提取次数5次、提取温度70 ℃、提取时间60 min,此条件下测得虫草素含量为1.48 mg/g,高于孟胜楠[25]研究结果。提取回收率试验结果显示,在该工艺下虫草素回收率为92.56%,表明该提取工艺参数稳定,结果准确可靠。
此外,蛹虫草培养残基提取方式不同,虫草素含量也会有一定差异。陈丽冰[7]分别用超高压提取法、超声波水提取法和闪式提取法提取北虫草培养基有效成分,结果显示,北虫草培养基中虫草素含量分别为1.70、1.58和1.65 mg/g。石浩[27]比较了热水-乙醇提取法、酸溶剂提取法、超声协同酸溶剂提取法、超声协同微波提取法对蛹虫草下脚料超微粉的提取效果,结果显示,虫草素含量分别为2.70、2.86、3.18和2.94 mg/g,与本试验结果有一定差异,原因可能在于:蛹虫草培养基中菌丝共生体含量不同[24];蛹虫草培养残基粉末粒度大小对虫草素得率影响较大[27]。由此可见,蛹虫草的培养基组方不同、菌丝共生体含量不同、培养方式不同,其有效成分的提取方法也应不同,水热回流法是最常用方法之一。本研究确定的蛹虫草培养残基水热回流法提取工艺参数稳定,活性成分得率好,可为后续蛹虫草培养基水提物产品开发提供参考。
4 结 论
以虫草素含量为评价指标,通过单因素试验和正交试验对液料比、提取次数、提取温度和提取时间4个因素考察,得出蛹虫草培养残基活性成分的水热回流法最佳提取工艺参数为:液料比25∶1、提取次数5次、提取温度70 ℃、提取时间60 min,该条件下测得虫草素含量为1.48 mg/g。

