梅花鹿茸生长过程中顶端不同组织COL1A1基因启动子DNA甲基化模式及差异分析
张芙蕊 韩若冰 郭梦雅 赵洵武 李和平
(东北林业大学 野生动物与自然保护地学院,哈尔滨 150040)
鹿茸是哺乳动物中唯一可完全再生的附属器官,其生长速度极快却没有癌变[1],鹿茸每年周期性再生的过程通过软骨内成骨的方式进行,并且具有分层明显的成骨带,包括间充质层、前软骨层、过渡层、软骨层以及骨组织,Colitti等[2]研究表明鹿茸组织的细胞凋亡率较高,认为细胞程序性凋亡在鹿茸角快速再生过程中发挥了重要的作用,使鹿茸组织中细胞凋亡和细胞生长之间形成了有序的平衡机制,以此阻止其发展为肿瘤。因此鹿茸是研究哺乳动物生长发育和分子机制的优秀生物学模型[3],同时也是癌症生物学领域的研究模型[1]。
COL1A1基因是细胞外基质受体相互作用途径中的重要基因,在调控生物体生长发育,以及在癌细胞系转移和癌症患者预后标志预测等领域中具有重要的作用。本团队此前已研究分析了驯鹿鹿茸顶端间充质中COL1A1基因的DNA甲基化水平,结果表明COL1A1基因可能是驯鹿生茸机制的重要调控基因[4]。Stéger等[5]研究发现,COL1A1基因等调控生长相关基因在马鹿鹿茸中的表达量是鹿角表达量的10倍以上;赵姬臣[6]对狍茸顶端组织转录组分析筛选出COL1A1基因存在高表达现象,表明COL1A1基因在鹿茸生长过程中可能存在重要调控作用。DNA甲基化是一种哺乳动物中重要的表观遗传修饰,不仅在不改变DNA序列的前提下对基因的遗传和表达进行调控,而且这种调控作用可以在世代间稳定遗传[7],基因启动子区甲基化水平的变化可以直接抑制基因与转录因子的结合,进而调控特定基因的转录和表达水平[8]。并且已有研究表明COL1A1基因启动子对DNA甲基化十分敏感[9],但COL1A1基因在鹿茸中甲基化水平对鹿茸生长是否发挥作用尚不清楚。因此进一步研究鹿茸顶端组织中COL1A1基因启动子的DNA甲基化水平,可能揭示鹿茸中COL1A1基因对其生长的差异调控作用。
因此,本研究以梅花鹿鹿茸生长过程中的3个不同生长时期(前期:小鞍子时期;中期:二杠茸时期;后期:三杈茸时期)的顶端组织及其4个不同组织层(茸皮组织、间充质组织、前软骨组织、软骨组织)作为试验材料,利用亚硫酸氢盐测序法(Bisulfite sequencing PCR, BSP)对COL1A1基因启动子区部分序列甲基化水平进行测定,以分析COL1A1基因在梅花鹿鹿茸不同生长时期和顶端不同组织层中甲基化水平的差异,为进一步研究鹿茸生长、再生和骨化等调控机制提供理论参考。
1 材料与方法
1.1 试验样品
本研究选用3头5岁成年健康雄性梅花鹿,分别在脱盘后的30、60和90 d左右采集梅花鹿生茸前期(小鞍子时期)、生茸中期(二杠茸时期)和生茸后期(三杈茸时期)鹿茸主干顶端5 cm左右的组织,参考Li等[10]对鹿茸顶端组织分层方法,分出茸皮层、间充质层、前软骨层和软骨层4种组织,总共36个样本。组织样品采集后立即放入液氮中保存。
1.2 主要试剂
基因组DNA提取试剂盒(RMI060002604)购自AXYGEN公司;甲基化基因组处理试剂盒(EZ DNA Methylation-Gold Kit,D5005)购自ZYMO RESEARCH公司;琼脂糖凝胶纯化回收试剂盒(D2500-02)购自Omega公司;DL 2000 Plus DNA Marker(MD101-01)购自Vazyme公司;rTaq DNA聚合酶(R001A),Hot Start Taq DNA聚合酶(R007A),DH5α感受态细胞(CB101),pMD18-T载体(6011),6×Loading Buffer,dNTP Mix(2.5 mM),10×PCR Buffer(Mg2+Plus)购自TaKaRa公司。
1.3 试验方法
1.3.1基因组DNA的提取与检测
使用基因组DNA提取试剂盒,按照试剂盒说明书提取基因组DNA。提取DNA后分别用1%的琼脂糖凝胶电泳和NanoDrop 2000测定DNA的质量以及纯度和浓度。其中DNA浓度均应在200~500 ng/μL,利于后续的甲基化处理获得最佳CT转化率。
1.3.2重亚硫酸盐修饰基因组DNA
使用甲基化基因组处理试剂盒对基因组DNA进行转化修饰处理。注意按照说明配置CT转化液,其在使用前应水浴加热到37 ℃,并震荡混匀,防止由于CT转化液形成沉淀而影响甲基化修饰的CT转化率。最后,得到处理后基因组DNA立即用于甲基化PCR扩增。
1.3.3BSP甲基化引物设计
使用在线软件http:∥www.urogene.org/methprimer/和Primer 5.0对OPN基因启动子区域的CpG岛进行分析预测和引物设计。其中上游引物是5’-GGTTTAGATTGAATTGGGGG-3’,下游引物是5’-TAACCTTCTTCTTAACCCTCC-3’,退火温度是53.5 ℃。在亚硫酸氢盐处理的甲基化PCR引物扩增区域内,含一个长度201 bp的CpG岛,共有25个CG位点,预期扩增大小441 bp。
1.3.4COL1A1基因甲基化PCR的扩增及测序
以重亚硫酸盐处理后的基因组DNA为模版,进行甲基化PCR的扩增。PCR反应体系为(10 μL):Hot start Taq DNA聚合酶0.05 μL,DNA模板1 μL,10×PCR Buffer 1 μL,dNTP Mix 0.8 μL,上、下游引物各0.5 μL,ddH2O 6.15 μL。反应程序为:98 ℃预变性5 min;95 ℃变性30 s,53 ℃退火30 s,72 ℃延伸1 min,40个循环;72 ℃延伸10 min,4 ℃保存备用。
得到的扩增产物进行回收纯化后与pMD18-T载体进行连接,连接体系为(10 μL):solution 1 5 μL,PMD-18T vector 1 μL,回收产物3.5 μL,ddH2O 0.5 μL,16 ℃连接1 h。连接完成后将连接产物10 μL 与DH5α感受态细胞50 μL按步骤进行转化。培养的菌液均匀涂布在LB固体培养基上,37 ℃恒温培养15~17 h。用枪头挑取单一饱满的白色菌落于1.5 mL含Amp的LB液体培养基中,置于恒温摇床(37 ℃,200 r/min)培养8 h。将1 μL的DNA模板换成1 μL菌液对克隆产物进行菌液PCR,用1%的琼脂糖凝胶电泳进行克隆阳性鉴定。最后,将克隆成功的10管菌液送至吉林库美生物科技有限公司进行双向测序。
1.3.5统计分析数据
测序结果利用Chromas查看序列峰图,使用DNAStar软件对序列进行人工校对和拼接,得到甲基化BSP测序结果。
将该基因甲基化BSP测序结果与启动子序列导入在线软件QUMA(http:∥quma.cdb.riken.jp/),计算该基因在不同组织中的DNA甲基化转化率,同时得到DNA甲基化模式分析的圆圈图。
应用统计学软件GraphPad Prism 8.0.1和IBM SPSS Statistics version 23分析各组织的甲基化总差异和各CG位点上的甲基化差异。
2 结果与分析
2.1 基因组DNA的提取及质量检测
利用1%的琼脂糖凝胶电泳和NanoDrop 2000检测基因组DNA提取的质量。提取的基因组DNA浓度均可达到200 ng/μL以上,OD260/OD280值均在1.8~2.0。因此,鹿茸顶端各组织的基因组DNA提取质量较好,浓度和纯度均可满足试验要求。
2.2 COL1A1基因甲基化BSP-PCR扩增及测序
分别以重亚硫酸盐修饰处理过的梅花鹿鹿茸12个组织的基因组DNA为模板,对COL1A1基因启动子区进行BSP-PCR扩增,扩增出的片段大小均与预期扩增大小一致,如图1所示。测序结果利用Chromas查看序列峰图以确认测序结果的可靠性,使用DNAStar软件对序列进行人工校对和拼接,得到甲基化BSP测序结果,与原序列进行对比,确认测序结果正确。
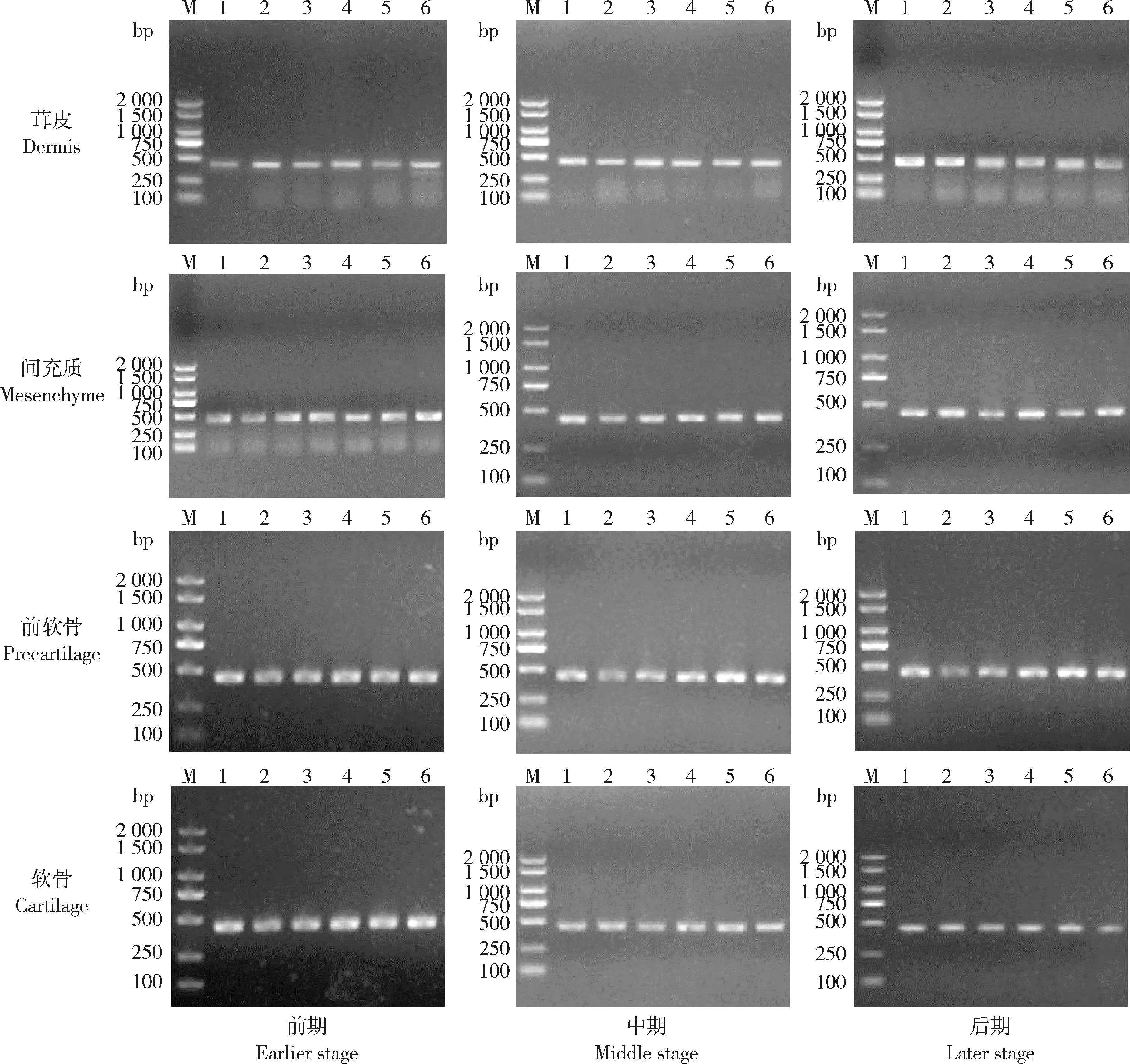
M:DL 2000 marker;1~6:代表平行样本。M: DL 2000 marker; 1-6: Parallel samples.
2.3 梅花鹿茸不同时期顶端各组织COL1A1基因的DNA甲基化模式
通过对梅花鹿鹿茸顶端组织的COL1A1基因启动子甲基化BSP测序结果校对、分析,经统计发现,各组织的阳性克隆菌液测序结果中均有10个以上的有效测序结果,利用软件QUMA比对分析该基因在梅花鹿鹿茸12个组织中的甲基化状态(图2),并进行统计分析。结果显示,COL1A1基因在前期、中期、后期的茸皮组织中的甲基化率分别为(9.73±0.92)%、(7.60±0.69)%和(3.73±0.23)%;间充质组织中的甲基化率分别为(3.20±0.40)%、(1.33±0.23)%和(1.60±0.69)%;前软骨组织中的甲基化率分别为(4.67±0.83)%、(2.53±0.46)%和(2.67±0.23)%;软骨组织中的甲基化率分别为(5.60±0.40)%、(2.80±0.40)%和(2.27±0.61)%。

每一行代表一个细菌克隆,每一圈代表一个单独的CpG二核苷酸位点;○:未甲基化位点,●:甲基化位点。Each line represents one individual bacterial clone, and each circle one single CpG dinucleotide; ○: Unmethylated CpGs; ●: Methylated CpGs.
在COL1A1基因启动子区DNA甲基化水平的分析区域中,共有25个CG位点,分别位于39、56、93、99、118、148、171、190、221、226、233、242、256、262、276、278、291、299、303、322、374、393、400、411和415 bp。各位点的甲基化率见表1所示,在其中的17个CG位点检测到不同程度的甲基化。结果显示,39、56、118、190和415 bp处在4层组织中均发生不同程度的甲基化;221 bp处只在间充质前期及中期发生甲基化;226 bp处只在间充质后期发生甲基化;233 bp处只在茸皮中期发生甲基化;242 bp处在茸皮前期、间充质前期及中期发生甲基化;262 bp处在茸皮3个时期、前软骨前期、软骨后期均发生不同程度甲基化;278 bp处在茸皮前期及中期、间充质前期及中期发生甲基化;291 bp处在间充质后期、软骨前期发生甲基化;299 bp处在前软骨3个时期、茸皮中期及后期、软骨层前期均发生甲基化;303 bp处在茸皮中期、前软骨中期、软骨中期均发生甲基化;393、400和411 bp处只在茸皮前期发生甲基化。
2.4 梅花鹿茸不同时期顶端各组织COL1A1基因的DNA甲基化差异
对COL1A1基因启动子区在梅花鹿鹿茸不同生长时期顶端各组织的DNA甲基化率进行统计以及差异分析,结果见图3所示。对相同组织甲基化程度进行差异性比较的结果显示,在茸皮组织中,3个时期甲基化程度之间差异均为极显著(P<0.01),且甲基化程度依次递减;在间充质组织中,前期甲基化程度最高,中期减小,且与前期存在显著性差异(0.01
(a)相同组织甲基化程度差异性比较;(b)相同时期甲基化程度差异性比较;*:0.01 对相同时期甲基化程度进行差异性比较的结果显示,在前期和中期中,茸皮甲基化程度最高,与间充质、前软骨、软骨之间差异均为极显著(P<0.01),软骨、前软骨、间充质甲基化程度依次递减,且前期中间充质与软骨之间差异极显著(P<0.01);在后期中,茸皮甲基化程度最高,与间充质之间差异为极显著(P<0.01),前软骨、软骨、间充质甲基化程度依次递减。 COL1A1基因启动子区甲基化研究区域共有25个CG位点,各位点DNA甲基化差异分析如图4所示。对茸皮组织进行差异性分析结果发现,前期与中期在39、56、190、233、242、278、299和400 bp处差异极显著(P<0.01),在393和411 bp处差异显著(0.01 (a)茸皮组织;(b)间充质组织;(c)前软骨组织;(d)软骨组织;1:前期;2:中期;3:后期。 COL1A1基因具有维持骨组织、结缔组织和细胞微环境完整性的作用[11],并且其传导多种信号分子参与器官发育和组织修复等生理过程[12]。鹿茸是研究骨组织再生和创伤修复的良好模型,而鹿茸顶端组织是鹿茸的生长中心,为探究COL1A1基因在鹿茸顶端组织生长过程中的作用机制,本研究选用梅花鹿鹿茸不同生长时期顶端组织及其由外到内依次排列的茸皮、间充质、前软骨、软骨4个不同组织层为研究材料,从时空角度利用亚硫酸氢盐测序法研究了鹿茸启动子区甲基化模式,进而分析了2个维度的甲基化差异。结果显示,不同组织之间在总的甲基化水平和CG位点的甲基化水平上均存在不同程度的差异和明显的规律。 COL1A1基因在4个组织中均发生了不同程度的甲基化,茸皮组织甲基化水平最高,间充质、前软骨、软骨组织甲基化水平都较低,其中,间充质组织甲基化水平最低,且在前期与中期茸皮组织的甲基化水平与其他3个组织之间的差异均为极显著,表明COL1A1基因可能在茸皮组织中的生长作用相对较弱,而在顶端中心生长组织中起更重要作用。间充质生长区在鹿茸茸性皮肤真皮层的下方[13],间充质层细胞具有极强的分裂增殖能力[14],并且在体外培养液中能迅速增殖并合成Ⅰ型胶原蛋白[15]。本研究结果表明,间充质层在4个组织中甲基化水平最低,可能是由于间充质组织细胞间质分泌旺盛,并且221 bp这一位点只在间充质发生甲基化,221 bp位点可能是调节间充质生长的重要CG位点。已有研究表明,COL1A1基因在乳腺癌、胰腺癌、胃癌及食管癌等恶性肿瘤组织中呈高表达[16-17],Ⅰ型胶原蛋白是细胞间质的重要成分[18],结合鹿茸具有细胞快速增殖这一与癌细胞相似的特点,推测梅花鹿间充质中COL1A1基因可能存在高表达。 CG位点的甲基化水平会影响DNA序列与转录因子的结合状态,进而影响基因的表达,而CpG岛DNA高甲基化往往造成基因沉默和表达下降[19-20]。Ⅰ型胶原蛋白基因在几种人类癌细胞中均存在不同程度的甲基化,且甲基化程度与Ⅰ型胶原蛋白表达呈负相关[9]。对间充质组织的研究结果显示:中期甲基化水平显著下调,后期甲基化率略高于中期,但差异不显著。张梅等[21]对快速生长期和骨化期鹿茸间充质组织差异表达基因进行筛选,发现COL1A1基因在骨化期鹿茸间充质组织中表达下调,这与本研究结果相符,表明COL1A1基因可能在间充质快速生长期中发挥更强的作用,促进鹿茸生长。 鹿茸的生长发育阶段分为生长期和骨化期,鹿茸形态从小鞍子(30 d)到三杈茸(90 d)之间为生长期,以生长为主,骨化水平缓慢,其中二杠茸(60 d)时期为快速生长期,其生长速度可达2 cm/d,三杈茸时进入骨化期,生长速度降低,骨化水平增强[22]。在4个组织中,快速生长期甲基化水平均显著下调,且造成前期与中期差异的CG位点有39、56和118 bp等,推测COL1A1基因在快速生长期发生高表达。刘海龙[23]对鹿茸顶端组织进行转录组测序分析,发现细胞外基质基因中COL1A1基因在60 d快速生长期表达量升高的结果佐证了这一推论。鹿茸的快速生长与顶端的软骨细胞的增殖、分化以及肥大密切相关[24],前软骨区和软骨区具有丰富的血液供应,且在前软骨区血管的生成更高[25-26]。在哺乳动物骨组织中COL1A1基因研究广泛,据报道大约90%的成骨不全症患者在COL1A1或COL1A2基因中存在杂合性变异,扰乱细胞内正常的胶原组装、细胞分泌以及细胞外间隙的纤维组装[27]。Fernndez等[28]研究发现COL1A1基因在16日龄鸡胚胸骨的软骨细胞中显示甲基化相对下调,他们认为COL1A1密切参与骨及软骨组织的生长与调控。丁玲[29]的研究表明,COL1A1基因在快速生长期和骨化期鹿茸软骨组织中均高度表达但存在表达差异,COL1A1基因在快速生长期的表达量均高于其他筛选出的胶原蛋白类差异表达基因且达到10倍以上,在骨化期的表达量高于除COL2A1外的其他基因,证实COL1A1在软骨组织中期、后期都对鹿茸生长发挥了有效的促进作用。本研究中软骨组织中后期甲基化水平低,且中后期相比前期的共同差异CG位点有39、56、118、190、291、299和415 bp,这与丁玲[29]的研究结果一致,但软骨组织中期与后期甲基化水平没有显著差异与丁玲的研究结果相悖,这可能是由于亚硫酸氢盐测序法测定DNA甲基化率时基因组DNA的CT转化率存在误差,导致其与转录组测定的表达水平不完全一致。 综上所述,本研究分析了梅花鹿鹿茸3个代表前、中、后期生长过程的鹿茸顶端不同组织间的DNA甲基化差异,结果表明COL1A1基因在快速生长期,以及在间充质组织、前软骨组织、软骨组织中对鹿茸生长具有促进作用,并且与COL1A1基因的甲基化位点以及COL1A1基因的甲基化率相关联。但是试验尚需进行COL1A1基因的表达测定来验证COL1A1基因的DNA甲基化水平与该基因发挥促进鹿茸生长作用的关系,因此后续研究将对COL1A1进行基因和蛋白表达水平的测定,从而对COL1A1基因的作用机制进行更进一步研究。本研究在DNA甲基化水平上探究梅花鹿鹿茸不同组织的表观遗传差异,为进一步研究鹿茸的再生、快速生长和骨化机制提供理论参考。
3 讨 论

