小鼠感染BVDV诱导NLRP3炎症小体的表达及其对病毒复制的影响
刘思雨 张月莹 黄 江 崔月琦 刘 宇,2 周玉龙,2 朱战波,2* 张泽财,2*
(1.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆,163319;2.黑龙江省牛病防控工程技术研究中心,黑龙江 大庆,163319)
牛病毒性腹泻病毒(Bovine viral diarrhea virus,BVDV)是引起牛胃肠道、呼吸道和生殖疾病的重要病原体,它所引起的疫病呈世界性分布,给养牛业造成了持续的经济损失[1-2]。BVDV可以引起宿主动物的免疫抑制和持续性感染,从而促进牛群中BVDV的循环。BVDV进化出了多种策略来逃避宿主的先天性免疫[3-4]。
已有研究表明BVDV感染的BALB/c小鼠在第14天时仍可在体内检测到病毒[5]。同时,Lee等[6]研究发现,BVDV感染的BALB/c小鼠脾脏出现明显的病理组织学变化,骨髓中巨核细胞数量也明显增加。另外,2016年,Choi等[7]研究也证实BVDV感染的BALB/c小鼠在第9天时仍可以在脾脏和肠系膜淋巴结中检测到病毒抗原。近期研究也证实BVDV感染的BALB/c小鼠在第7天时出现明显的病毒血症[8]。此外,本研究团队前期研究显示,致细胞病变(CP)型和非致细胞病变(NCP)型BVDV感染的小鼠均呈现白细胞、淋巴细胞和血小板的减少,以及病毒血症[9],表明BALB/c小鼠可以作为感染模型用于BVDV致病机制的研究。
先天性免疫是机体抵御病原微生物入侵的第一道防线,在抗感染免疫中发挥关键的作用。研究证实,宿主先天性免疫受体可通过识别入侵的BVDV粒子,进而启动一系列免疫反应,发挥抗病毒效果。NLRP3炎症小体是先天性免疫中重要模式识别受体,是由NLRP3受体、适配器ASC和Caspase-1组成的寡聚复合体。组装后的NLRP3炎症小体将会触发pro-Caspase-1自切割为成熟的Caspase-1,随后,介导IL-1β的分泌,对宿主抵御微生物至关重要[10]。越来越多的研究证实,NLRP3炎症小体参与多种病毒的致病机制,如猪繁殖与呼吸综合征病毒,呼吸道合胞病毒和猪瘟病毒等[11-13]。然而BVDV体内感染后NLRP3炎症小体的活化规律,国内外尚未见报道。本研究拟探究BVDV感染后诱导NLRP3炎症小体激活的规律,以及NLRP3炎症小体激活与病毒复制的相关性,为BVDV拮抗宿主先天性免疫的机制研究提供理论依据。
1 材料与方法
1.1 病毒株和实验动物
BVDV标准株NADL(CP型)由黑龙江省牛病防控工程技术研究中心保存。4~6周龄雌性的SPF级BALB/c小鼠购自哈尔滨医科大学实验动物医学部。
1.2 主要试剂
兔源NLRP3单克隆抗体购自北京博奥森生物技术有限公司;兔源Caspase-1和IL-1β单克隆抗体购自安诺伦生物技术有限公司;山羊抗兔IgG/辣根酶标记的二抗购自北京中杉金桥生物技术有限公司;BCA蛋白浓度测定试剂盒、RIPA蛋白裂解液、超敏ECL化学发光试剂盒购自碧云天生物科技有限公司;逆转录试剂盒、SYBR荧光定量qRT-PCR试剂盒购自Takara公司。
1.3 动物分组和处理
将BALB/c小鼠在隔离器中预饲喂适应一周后,随机分成8组,即1个对照组和7个攻毒组,每组各5只。攻毒组每只腹腔注射105TCID50的CP型BVDV,对照组注射等量的PBS,小鼠自由采食和饮水。在攻毒后的不同时间点(0、6、12、24、48、96、168和240 h)分别采集小鼠的十二指肠、脾脏和血液。所有试验均获得黑龙江八一农垦大学动物伦理委员会批准。
1.4 荧光定量PCR检测NLRP3、Caspase-1和IL-1β mRNA表达
无菌取攻毒后不同时间点小鼠的十二指肠进行研磨,提取总核糖核苷酸(RNA),通过逆转录反应合成互补脱氧核糖核苷酸(cDNA),以cDNA为模板进行荧光定量PCR反应;β-actin为内参。引物由生工生物(上海)工程股份有限公司合成。

表1 荧光定量PCR引物序列Table 1 Primer sequences for Real-time PCR
反应条件:SYBR®Premix Ex TaqTMⅡ 12.5 μL,水9.5 μL,上下游引物各1 μL,目的模板1 μL共25 μL体系在95 ℃预变性30 s;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s条件下共40个循环。SteponePlus软件测定其Ct值,将正常对照组设定为1,采用2-ΔΔCt法分析进行mRNA表达水平,ΔΔCt=试验组(Ct目的基因-Ct内参基因)-空白组(Ct目的基因-Ct内参基因)。
1.5 Western Blot分析NLRP3、Caspase-1和IL-1β蛋白表达
取攻毒后24 h和168 h(7天)小鼠十二指肠,加入细胞裂解液,提取蛋白。取30 μg样品进行80 V恒压电泳40 min,然后120 V恒压电泳45 min,切下目的蛋白凝胶并转印至PVDF膜,5%的脱脂乳封闭2 h后分别加入一抗为兔源的NLRP3(1∶1 000)、Caspase-1(1∶1 000)、IL-1β(1∶1 000)的单克隆抗体和兔源的Tubulin(1∶5 000)的单克隆抗体4 ℃过夜。加入1∶8 000稀释的山羊抗兔的二抗后,37 ℃孵育1 h,使用ECL显色剂对膜进行显色,于凝胶成像仪中进行曝光成像,得到灰度值,计算相对表达量。
1.6 荧光定量PCR检测小鼠十二指肠、脾脏和血液的病毒载量
取攻毒后不同时间点小鼠的十二指肠、脾脏进行研磨并将小鼠眼球采集抗凝血,提取总RNA通过逆转录反应合成cDNA,以cDNA为模版,进行荧光定量PCR反应。BVDV引物序列,上游为:5′-GAGTACAGGGTAGTCGTCAG-3′,下游为5′-CTCTGCAGCACCCTATCAGG-3′,扩增长度130 bp。反应条件:95 ℃预变性30 s;95 ℃ 30 s,60 ℃ 30 s,72 ℃ 30 s共35个循环,根据标准曲线Y=-2.909 4X-40.812计算出病毒载量。
1.7 十二指肠和脾脏病理组织学检查
在病毒感染第7天时,无菌采取对照组和感染组的十二指肠和脾脏,将其在4%的多聚甲醛中固定一周后经冲洗、脱水、透明、浸蜡、包埋、切片、展片、苏木素-伊红染色、封片等步骤,制作组织切片并观察。
1.8 统计分析
2 结果与分析
2.1 BVDV感染小鼠体内NLRP3、Caspase-1和IL-1β基因表达情况
qRT-PCR结果表明,小鼠感染BVDV后十二指肠中NLRP3、Caspase-1和IL-1β的mRNA表达量从第12 h开始逐步升高,24 h时达到高峰(P<0.05);在感染第48 h和96 h(4 d)时,其基因表达与对照组相比并无明显的变化(P>0.05);但在感染第168 h(7 d)时,其表达量与对照组相比显著降低(P<0.05),感染第240 h(10 d)时略有升高但仍低于对照组(图1)。

图1 qRT-PCR检测BVDV感染早期小鼠十二指肠NLRP3(a)、Caspase-1(b)和IL-1β(c)的mRNA表达水平Fig.1 Relative mRNA levels of NLRP3 (a), Caspase-1 (b) and IL-1β (c) by qRT-PCR in the early stage of BVDV infection
2.2 BVDV感染小鼠体内NLRP3、Caspase-1和IL-1β蛋白表达情况
由图2可知,Western Blot检测发现腹腔注射BVDV的小鼠在24 h时,小鼠十二指肠中的NLRP3、Caspase-1和IL-1β的蛋白表达水平与对照组相比显著升高(P<0.05)。由图3可知,其变化趋势与mRNA表达水平的结果相一致;当BVDV感染第168 h(7 d)时,小鼠十二指肠中的NLRP3、Caspase-1和IL-1β的蛋白表达水平与对照组相比显著降低(P<0.05)。此变化趋势与mRNA表达水平的结果相一致。上述结果表明BVDV感染早期,小鼠体内的NLRP3-(Caspase-1)/IL-1β信号通路被激活,感染第168 h(7 d)时,NLRP3炎症小体活化被抑制。

1和2分别代表各组中2个不同小鼠的十二指肠样本。1 and 2 represent duodenal samples from 2 different mice in each group.
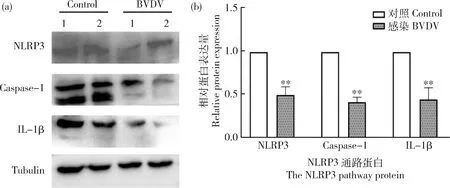
1和2分别代表各组中2个不同小鼠的十二指肠样本。1 and 2 represent duodenal samples from 2 different mice in each group.
2.3 小鼠体内病毒含量的检测
qRT-PCR结果表明,BVDV感染早期的小鼠十二指肠和脾脏中病毒载量逐渐升高。在感染的168 h(7 d)十二指肠、脾脏和血液中病毒载量均达到高峰(图4)。
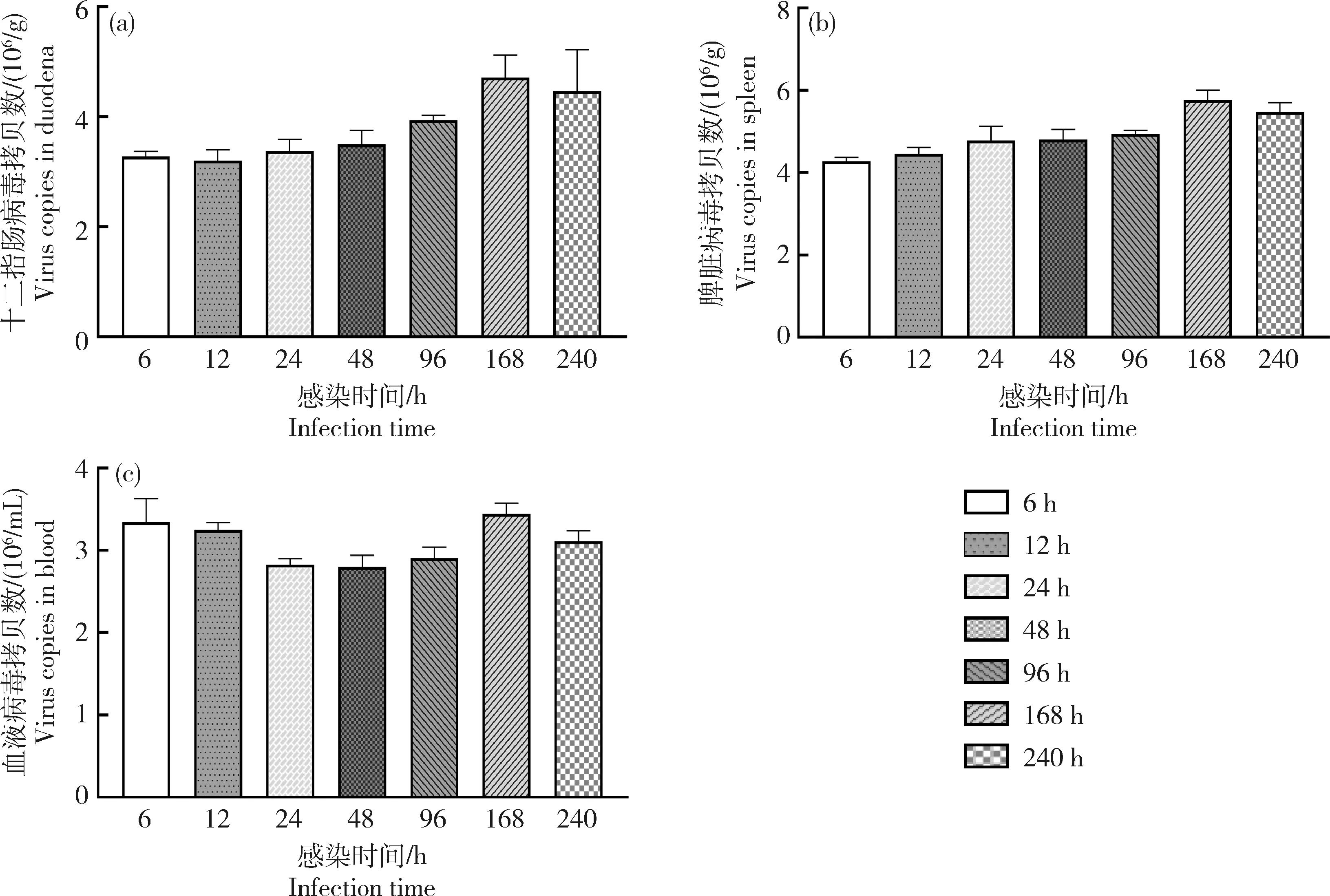
图4 小鼠十二指肠(a)、脾脏(b)和血液(c)病毒载量Fig.4 Viral load in the duodena (a), spleen (b) and blood (c) of all infected mice
2.4 小鼠十二指肠、脾脏病理组织学变化
与空白对照组小鼠相比较,BVDV感染后第7天小鼠十二指肠呈现为肠腺上皮大量坏死,基层变厚并且有较多的炎性细胞浸润;脾脏可见淋巴细胞变性、坏死,间质疏松和水肿(图5)。
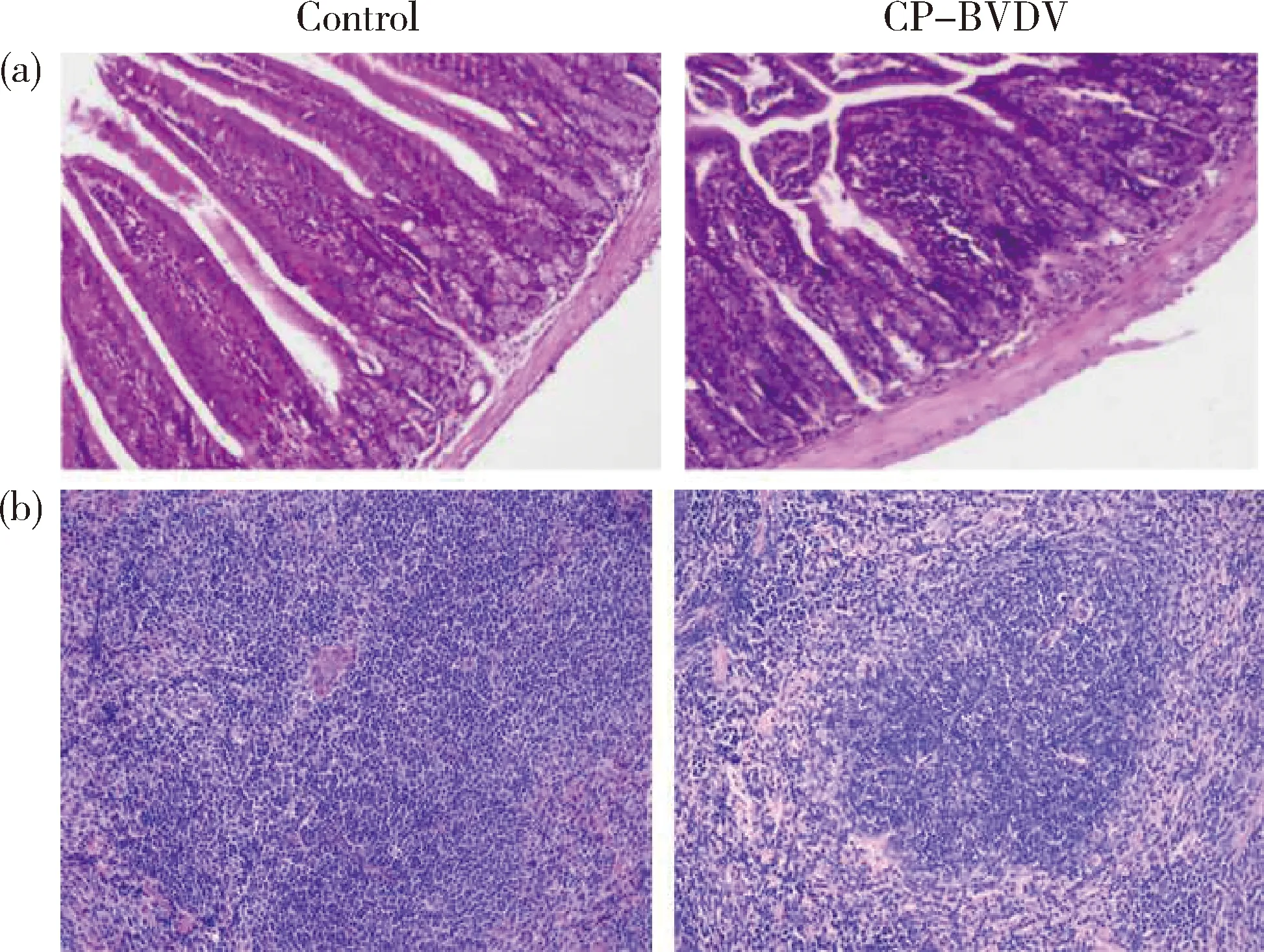
(a)小鼠十二指肠对照组与感染组;(b)小鼠脾脏对照组与感染组
3 讨 论
NLRP3炎症小体是目前研究最多的NLR家族成员[14],炎症小体的活化包含2个步骤:首先,宿主细胞对微生物的模式识别诱导了pro-IL-1β和NLRP3的转录[15];其次,危险信号激活炎症小体,导致Caspase-1的活化,并将细胞因子前体切割为成熟的具有生物活性的IL-1β和IL-18,以及触发细胞焦亡[16-17]。IL-1β作为炎症反应上游的细胞因子,能够促进炎症反应并起到清除病原体的作用[18-19]。本研究发现,与空白对照组相比,小鼠感染BVDV早期NLRP3、Caspase-1和IL-1β水平随时间推移逐步升高,在感染后24 h的mRNA和蛋白的表达水平均显著高于对照组,表明BVDV感染早期可以导致小鼠体内NLRP3炎性小体激活。
NLRP3炎症小体在许多抗病毒免疫中被激活,然而,研究表明NLRP3炎症小体的活化在不同病毒致病机制中发挥的作用可能存在差异。Cui等[20]研究证实,ZIKV感染可以通过介导NLRP3炎症小体激活促进cGAS的降解,进而抑制Ⅰ型干扰素的产生,导致ZIKV逃避宿主抗病毒反应。另外,有研究表明,丙型肝炎病毒具有抑制LPS诱导的NLRP3炎症小体活化的作用[21]。近期研究也证实,甲型流感病毒感染小鼠1周时,NLRP3和Caspase-1的表达比感染早期进一步升高,IL-1β的转录和分泌也进一步增强,促进了甲型流感病毒感染[22-23]。本研究中,与许多前期研究结果相似的是,在BVDV感染早期,NLRP3炎症小体被激活,然而在BVDV感染小鼠的第7天,发现NLRP3、Caspase-1和IL-1β基因和蛋白的表达量均明显降低。
进一步对小鼠血液、脾脏和十二指肠中病毒载量进行检测发现,感染早期的小鼠十二指肠和脾脏中病毒载量逐渐升高,血液中病毒载量逐渐下降。然而,在BVDV感染的第7天病毒载量均达到高峰,这与实验室前期构建的BVDV感染小鼠模型结果相一致[9]。通过病理组织学检查证明BVDV感染后引起了病理损伤,感染模型成立。NLRP3炎症小体活化及病毒载量变化规律表明NLRP3炎症小体在病毒感染早期被激活后,在一定程度上抑制了病毒的复制,但对病毒感染后期抑制效果不明显。值得注意的是,小鼠十二指肠、脾脏和血液的病毒载量在感染第7天最高,第10天的病毒载量开始下降,可能是特异性免疫应答被激活,其机制有待于进一步研究。
综上所述,在小鼠体内,BVDV感染早期的NLRP3炎性小体被激活,然而随着宿主体内病毒载量增加,可能对其激活具有一定的抑制作用。本研究初步揭示了BVDV感染与NLRP3炎症小体活化的相关性,为BVDV拮抗宿主先天性免疫的机制研究奠定了基础。然而,BVDV感染本体动物后NLRP3炎症小体激活及其抗病毒机制仍有待于进一步研究。

