南黄海首次暴发“巨囊”生态型球形棕囊藻藻华*
张清春 向 玲 王锦秀 刘 扬 宋敏杰 王云峰 孔凡洲 耿慧霞 颜 天 于仁成
南黄海首次暴发“巨囊”生态型球形棕囊藻藻华*
张清春1, 2, 4向 玲1, 3王锦秀1, 3刘 扬1, 5宋敏杰1, 3王云峰1, 2, 4孔凡洲1, 2, 4耿慧霞1, 2, 4颜 天1, 2, 4于仁成1, 2, 3, 4①
(1. 中国科学院海洋生态与环境科学重点实验室(中国科学院海洋研究所) 山东青岛 266071; 2. 青岛海洋科学与技术国家试点实验室海洋生态与环境科学功能实验室 山东青岛 266071; 3. 中国科学院大学 北京 100049; 4. 中国科学院海洋大科学中心 山东青岛 266071; 5. 青岛科技大学 山东青岛 266045)
球形棕囊藻()常在热带至温带近海海域形成有害藻华, 该种具有种内遗传多态性, 且有囊体大小、特征色素组成等性状分化。在我国南海形成有害藻华的球形棕囊藻可形成“巨型囊体”, 以19′-丁酰氧基岩藻黄素(But-fuco)为特征色素, 是一种独特的“巨囊”生态型。2021年11月底至12月初, 南黄海青岛沿岸暴发大规模球形棕囊藻藻华。藻华发生期间, 对青岛沿岸3个站位的水文和化学要素进行了观测, 分析了球形棕囊藻囊体的数量、直径和色素组成, 并应用一种高分辨率种下分子标记——叶绿体S-27基因间隔区分析了其遗传特征。结果表明, 藻华发生期间青岛沿岸表层海水温度较低(12~14 °C), 海域营养盐组成具有高溶解有机氮、低溶解无机氮的特征; 球形棕囊藻囊体丰度超过20个/L, 最大囊体直径为18 mm, 以But-fuco为特征色素,S-27序列分析表明其与南海“巨囊”生态型球形棕囊藻具有相同的遗传特征。南黄海首次暴发的球形棕囊藻藻华是由“巨囊”生态型形成, 该藻华可能对海洋生态系统、水产养殖业发展和核电设施运行等构成威胁, 亟待开展藻华成因与监测预警对策研究。
球形棕囊藻; “巨囊”生态型; 有害藻华; 南黄海
2021年11月底12月初, 南黄海青岛沿岸突发球形棕囊藻()形成的有害藻华(harmful algal bloom, HAB)。大量球形棕囊藻囊体聚集于青岛市黄岛至胶南沿岸海域, 这是南黄海海域首次暴发球形棕囊藻藻华。球形棕囊藻广泛分布于热带至温带海洋, 能产生二甲基丙酸盐, 对全球气候变化具有重要影响(Charlson, 1987; Wassmann, 2005; Whipple, 2005)。球形棕囊藻具有复杂的异形生活史, 含有游离单细胞和囊体群体两种迥异的细胞形态(齐雨藻等, 2001), 其中囊体是由黏多糖包裹成千上万个藻细胞形成(Van Rijssel, 1997)。球形棕囊藻常以囊体形式形成藻华, 在全球许多近海海域均有该藻藻华记录(Qi, 2004; Smith, 2014b)。在球形棕囊藻藻华衰退过程中, 死亡藻体分解消耗大量溶解氧, 囊体分解形成泡沫物质, 影响海洋生态系统和旅游景观, 亦会产生溶血毒素等有毒有害化学物质, 危害海水养殖业发展; 藻华期间形成的大量囊体易堵塞冷却水过滤网, 影响核电等沿海大型设施的安全运行(齐雨藻等, 2001; Yu, 2017)。
1997年, 球形棕囊藻首次在我国东南沿海形成有害藻华(陈菊芳等, 1999), 之后在广东、海南和广西近海海域连年暴发, 成为我国东南沿海最为突出的藻华灾害(李亚男等, 2012; 沈萍萍等, 2018)。在渤海也多次暴发该藻藻华(曲凌云等, 2008; 屠建波等, 2011)。在本次青岛沿岸藻华之前, 未见有东海和南黄海发生球形棕囊藻藻华的报道。
球形棕囊藻具有囊体大小和特征色素组成等性状分化。包括我国近海在内的东亚至南亚一带沿岸海域, 球形棕囊藻囊体常达到厘米级, 称为“巨型囊体”(Giant colony) (齐雨藻等, 2001; Smith, 2014b)。与之相比, 全球其他海域的球形棕囊藻囊体多为毫米级, 通常不超过3 mm (Rousseau, 1990; Smith, 2014b)。除了囊体大小, 该藻的特征色素组成差异明显(Vaulot, 1994; Zapata, 2004)。岩藻黄素(fucoxanthin, Fuco)的两种衍生物19′-己酰氧基岩藻黄素(19′-hexanoyloxyfucoxanthin, Hex-fuco)和19′-丁酰氧基岩藻黄素(19′-butanoyloxyfucoxanthin, But-fuco)为棕囊藻的特征色素(Zapata, 2000, 2004)。具体到球形棕囊藻, 部分株系含有上述两种特征色素, 但也有株系仅含有其中一种特征色素或两种特征色素都不含有(Vaulot, 1994; Antajan, 2004; Zapata, 2004; Seoane, 2009; 王锦秀等, 2019)。基于核糖体18S rDNA、28S rDNA和ITS等常见分子标记的研究发现, 球形棕囊藻具有种下遗传多样性(Lange, 2002; Chen, 2003; Medlin, 2007), 但是现有分子标记过于保守或高变, 与性状特征分化或地理分布之间无法关联。近年的研究发现, 叶绿体和线粒体基因组中的高变区能较好地分辨球形棕囊藻不同地理株系, 与囊体大小、特征色素组成等也有很好的对应关系, 可以用作球形棕囊藻种下遗传分化的分子标记(Song, 2020, 2021; Zhang, 2021; Niu, 2022)。
基于球形棕囊藻叶绿体S-27基因间隔区和线粒体8基因高分辨率分子标记, 可以将全球不同海域20余株球形棕囊藻分为4个基因型, 其中Ⅰ型和Ⅱ型广布于世界各海域, 而Ⅲ型株系仅分布于大西洋北海海域, Ⅳ型仅分布于我国南海海域。前3个基因型的球形棕囊藻仅形成直径≤3 mm小囊体, 含有Hex-fuco和But-fuco两种特征色素, 但Ⅳ型可形成“巨型囊体”, 仅含But-fuco一种特征色素(王锦秀等, 2019; Zhang, 2021, 2022; Niu, 2022)。综合其遗传特征、囊体大小和特征色素组成, Ⅳ型球形棕囊藻被定义为一个独特的“巨囊”生态型( Zhang, 2022)。2015~2021年间, 南海多起球形棕囊藻藻华期间采集的囊体均以But-fuco为特征色素, 且都属于Ⅳ型, 表明“巨囊”生态型引发了南海球形棕囊藻藻华(Wang, 2022; Zhang, 2022)。
目前对引发青岛沿岸藻华的球形棕囊藻色素组成和遗传特征都不了解。在球形棕囊藻藻华发生期间,本文在青岛沿岸采集了球形棕囊藻囊体, 对囊体大小、色素组成以及遗传信息进行了分析, 初步研判了此次球形棕囊藻藻华原因种的生物学特征, 以期为解析南黄海球形棕囊藻发生机制和有效防控藻华危害提供科学依据。
1 材料与方法
1.1 样品采集
2021年12月6日, 分别在青岛市黄岛区沿岸的唐岛湾(TDW)、星光岛(XGD)和古镇口(GZK)海域设置采样点(图1)。在每个采样点采集表层海水1~2 L, 倒入白瓷盘中, 以刻度尺测量囊体直径, 最小可测量囊体直径约0.5 mm。每个采样点挑取单个或多个囊体, 测量并记录直径后, 以灭菌海水清洗去除囊体表面附着物, 分别在低负压下过滤到孔径为0.4 μm聚碳酸酯膜(Millipore, 美国) 和孔径约为0.68 μm GF/F玻璃纤维滤膜(Whatman, 英国) 上, 迅速放入液氮中保存, 带回实验室于-80 °C冰箱中存放, 用于囊体分子和色素特征分析。取80 mL海水样品用经450 °C灼烧的GF/F玻璃纤维滤膜过滤, 装入100 mL聚碳酸酯瓶中, 带回实验室存放于-40 °C冰箱, 用于营养盐分析。现场海水温度、盐度、pH以及溶解氧(DO)由梅特勒多参数测试仪(Mettler Toledo, Columbus, 美国)测定。
1.2 营养盐样品分析
1.3 色素样品分析
棕囊藻囊体色素提取和分析参照Zapata等(2000)和Kong等(2012)的方法。将囊体色素滤膜剪碎后, 加入1 400 μL 95%甲醇水溶液进行色素提取, 同时加入100 μL 8′-apo-β,ψ-carotaldehyde (750 μg/L)作为内标, 充分搅拌后冰浴超声处理5 min。以孔径0.22 μm有机相针头滤器对提取液进行过滤, 吸取800 μL滤液至1.5 mL棕色样品瓶中, 加入160 μL超纯水, 震荡混匀, 立即进行高效液相色谱(HPLC)色素分析。

图1 我国渤海和黄海(a)和青岛沿岸采样站位地图(b)
注: TDW: 唐岛湾站; XGD: 星光岛站; GZK: 古镇口站
1.4 DNA提取、PCR扩增和测序
采用十六烷基三甲基溴化铵(Hexadecyl trimethyl ammonium Bromide, CTAB)提取法提取囊体过滤膜样基因组DNA (Winnepenninckx, 1993), 提取的DNA溶解于TE溶液中, 保存于-20 °C用于PCR扩增。利用前期研发的高分辨分子标志扩增球形棕囊藻叶绿体S-27基因间隔区, 引物为S-27-F (5′-GAAGCATACGCACCAAGC-3′) 和S-27-3R (5′-ATTGTTGAGTTTACGACGGATA-3′) (Zhang, 2021), PCR体系和扩增条件分别参照Zhang等(2021)。用1%琼脂糖凝胶电泳检测PCR扩增产物, 然后送测序公司进行双端测序, 测序获得序列用Invitrogen 11.0 ContigExpress (ThermoFisher, 美国)进行组装。
1.5 系统进化分析
从GenBank下载全球不同海域的20株球形棕囊藻叶绿体S-27基因间隔区序列(表1), 加上本研究获得的6条序列, 并以南极棕囊藻() CCMP1374和约氏棕囊藻() CCMP2496为外群进行系统进化分析。使用ClustalW对序列进行比对; 使用MEGA10.0程序中Find Best DNA/Protein Models (ML)功能选择最适合替换模型T92, 构建最大似然进化树(maximum- likelihood tree), bootstrap值为1 000 (Kumar, 2018);使用Modelfinder程序选择贝叶斯树(Bayesian tree)最适合替换模型为HKY+F+G4 (Kalyaanamoorthy, 2017), 使用MrBayes3.2.6构建贝叶斯树, 四条MCMC链运行2 000 000代, 每1 000代进行一次取样(Ronquist, 2012)。
2 研究结果
2.1 环境参数
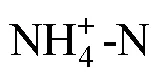
2.2 球形棕囊藻囊体数量与大小
在唐岛湾采集1 L表层海水中, 观测到直径介于0.5~18 mm的球形棕囊藻囊体27个; 星光岛采集2 L表层海水中直径介于1~12 mm的球形棕囊藻囊体37个; 古镇口1 L表层海水中直径介于4~8 mm球形棕囊藻囊体3个(图2)。将3个站位的囊体信息综合分析表明, 现场海水中直径在5~10 mm的囊体占优势(55%), 其次是直径1~5 mm的囊体(30%), 直径大于10 mm囊体数量较低, 最大囊体直径可达18 mm (图3)。
表1 本研究中球形棕囊藻和南极棕囊藻的信息
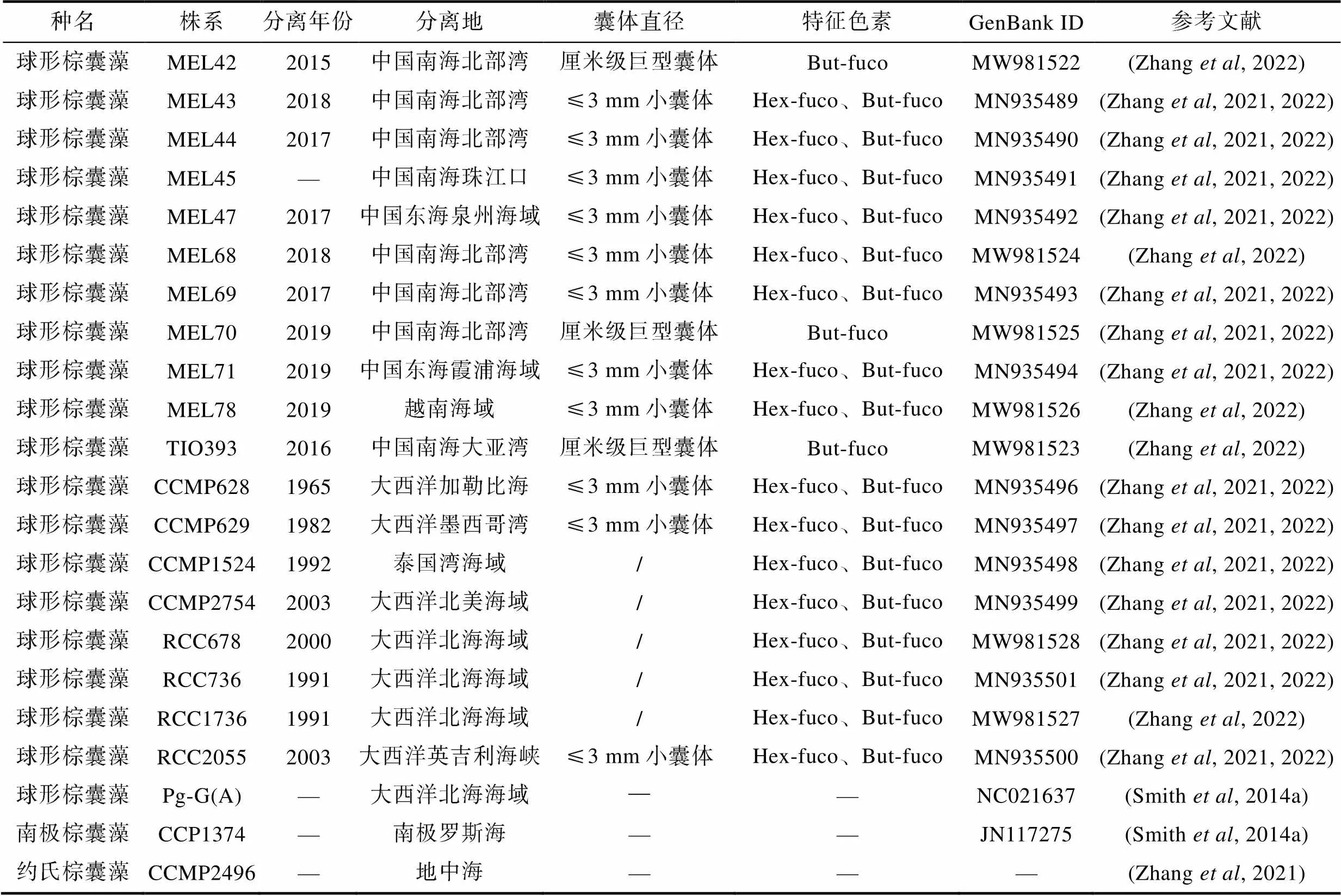
Tab.1 Information of Phaeocystis globosa and P. Antarctica strains for this study
注: /表示株系不成囊或偶尔形成直径≤3 mm小囊体; —表示具体信息不详
表2 2021年12月青岛沿岸三个调查站位的环境因子
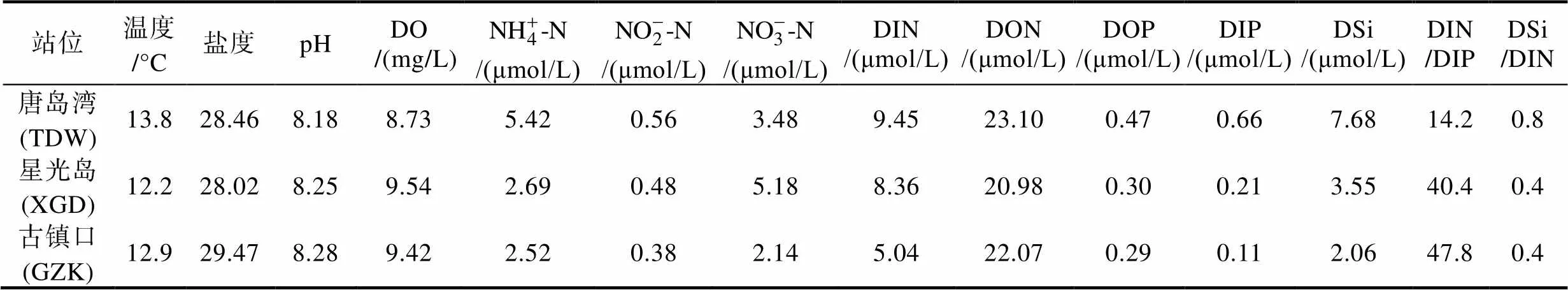
Tab.2 Environmental parameters measured at the three sampling sites in the coastal water of Qingdao in December 2021
2.3 球形棕囊藻色素组成
藻华现场采集9个直径介于4~18 mm的球形棕囊藻囊体进行色素分析, 结果如图4所示。检测到的主要色素包括脱植基叶绿素(chlide)、甲基脱植基叶绿素(Me-chlide)、19′-丁酰氧基岩藻黄素(But-fuco)、岩藻黄素(fuco)、硅甲藻黄素(diad)、硅藻黄素(diat)、叶绿素(chl)、α-胡萝卜素(βε-Car)和β-胡萝卜素(ββ-Car)。所有囊体样品中都未检测到Hex-fuco, 仅检测到But-fuco。结果表明形成藻华的球形棕囊藻以But-fuco为特征色素。
参照王锦秀等(2019)前期建立的囊体直径-囊体细胞数方程=0.00762.120 4, 根据囊体直径换算得出每个囊体样品中含有藻细胞数, 计算出囊体中单细胞主要色素含量(表3)。fuco和chl是球形棕囊藻囊体细胞中的主要色素组分, 含量分别为0.120~0.279 pg/cell和0.076~0.303 pg/cell; 其次为diad, 含量为0.009~0.092 pg/cell; 细胞特征色素But-fuco含量为0.005~0.019 pg/cell。

图2 球形棕囊藻藻华囊体的现场照片(a, b)和显微照片(c)
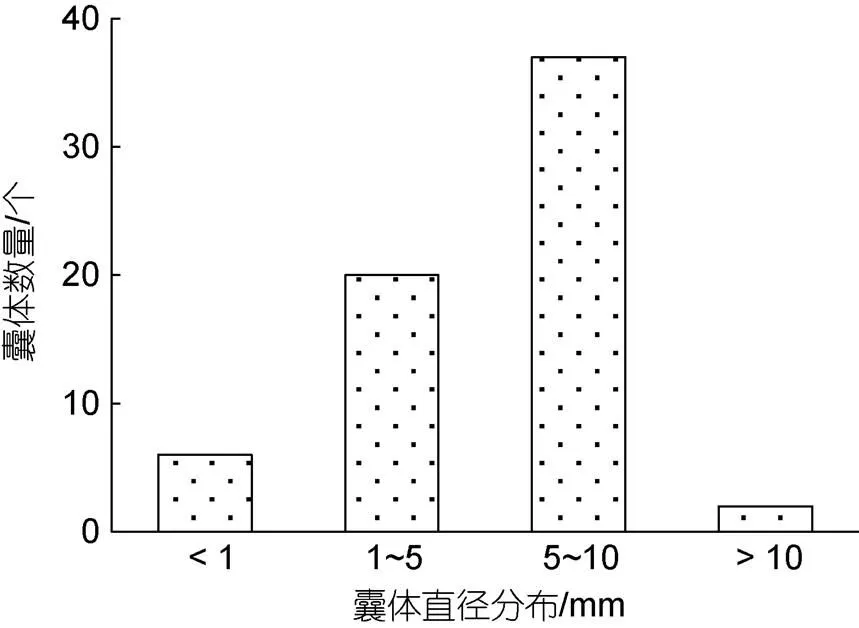
图3 2021年12月青岛沿岸球形棕囊藻藻华期间囊体直径分布状况
2.4 球形棕囊藻种下多态性分析
采自三个站位的6个球形棕囊藻囊体的叶绿体S-27基因间隔区序列完全一致。根据构建的系统进化树可以看出, 所有球形棕囊藻聚集在一起, 远离南极棕囊藻和约氏棕囊藻。球形棕囊藻可分为4个独立簇, 其中第1和2簇聚集在一起, 第3和4簇聚集一起。第1簇包括中国南海北部湾株系MEL43、MEL44、MEL68和MEL69, 南海珠江口株系MEL45、东海泉州海域株系MEL47, 越南海域株系MEL78、泰国湾株系CCMP1524以及大西洋加勒比海, 墨西哥湾和英吉利海峡株系CCMP628、CCMP629和RCC055, 这11个株系内部还有遗传分化。第2簇包括分离自东海霞浦海域西株系MEL71以及大西洋北美海域株系CCMP2754。第3簇包括分离自大西洋北海海域株系RCC678、RCC736、RCC1736和Pg-G(A)。第4簇包括分离自南海北部湾和大亚湾株系MEL42、MEL70和TIO393, 以及本研究中从青岛沿岸采集的6个囊体(图5)。
3 讨论
3.1 青岛沿岸球形棕囊藻藻华是由“巨囊”生态型形成
本研究首次报道了南黄海海域暴发的球形棕囊藻藻华。球形棕囊藻主要分布于热带至温带大洋和近海海域, 可引发有害藻华。20世纪80~90年代, 球形棕囊藻藻华主要出现在北大西洋的北海及其邻近海域(Rousseau, 1990; Lancelot, 2009)。20世纪末, 太平洋西部的东亚和东南亚海域频发球形棕囊藻藻华, 位于印度洋的阿拉伯海等也有零星出现(Madhupratap, 2000; Qi, 2004; Hai, 2010; Smith, 2014b)。1997年10月, 中国东南沿海首次暴发大规模球形棕囊藻藻华, 随后, 广东、海南和广西沿海亦频频发生。2004年6月至2006年10月, 渤海沿海多次发生球形棕囊藻藻华(曲凌云等, 2008; 屠建波等, 2011)。在本次青岛沿岸发生球形棕囊藻藻华之前, 未曾有南黄海发生球形棕囊藻藻华的报道。

图4 球形棕囊藻囊体色素色谱图(440 nm)
表3 2021年12月青岛沿岸三个调查站位球形棕囊藻囊体细胞中的主要色素含量*
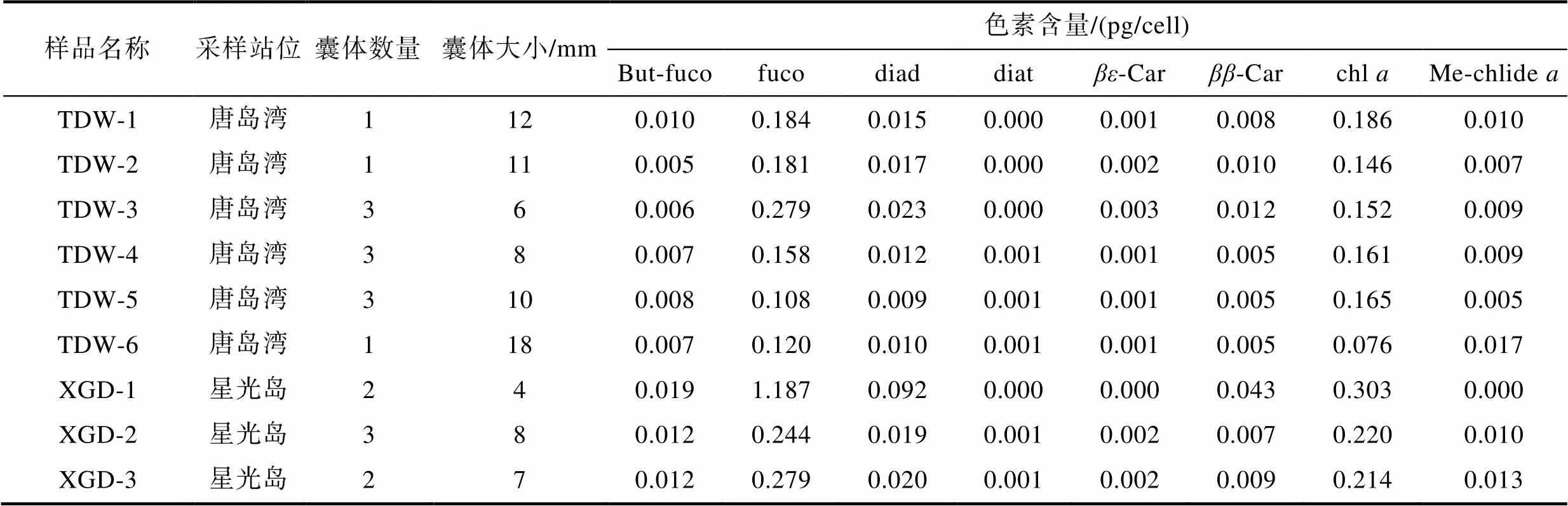
Tab.3 Content of pigments in colony cells collected from the three sampling sites in the coastal water of Qingdao in December 2021
注:*因缺少childe标准品, 未计算细胞内childe色素含量

图5 基于rbcS-rpl27序列建立的球形棕囊藻系统进化树
Figure 5 Phylogenetic tree established forbased on theS-27 intergenic spacer
注: 图中数值斜线左边是最大似然bootstrap值, 右边是贝叶斯分析值, 图中加粗的为本研究中从青岛沿岸采集的6个球形棕囊藻囊体
前期研究发现, 球形棕囊藻具有种下遗传多态性, 且存在囊体大小和特征色素等性状分化(Vaulot, 1994; Zapata, 2004; Medlin, 2007; Smith, 2014b)。基于核糖体18S rDNA、28S rDNA、ITS和L等常见分子标记研究表明, 球形棕囊藻具有复杂的种下遗传多态性(Medlin, 2007)。在大西洋北海海域, 球形棕囊藻囊体一般小于3 mm, 含Hex-fuco和But-fuco两种特征色素。而在东南亚沿海, 球形棕囊藻藻华中常出现厘米级大小的“巨型囊体”, 且仅含有But-fuco一种特征色素。随着研究深入, 在我国近海也陆续发现了仅形成小囊体、以Hex-fuco和But-fuco为特征色素的球形棕囊藻株系(王锦秀等, 2019)。尽管球形棕囊藻囊体形成受到光照、温度、营养盐、硅藻, 以及浮游动物摄食等多种因素影响(Tang, 2003; Sazhin, 2007; Wang, 2010, 2011), 但上述因素并非决定球形棕囊藻大小的根本因素。棕囊藻特征色素含量会受到光照等环境因素影响(Buma, 1991; van Leeuwe, 1998, 2014; Schlüter, 2000; DiTullio, 2007), 但其特征色素组成与环境因素无关。因此, 球形棕囊藻囊体大小和特征色素等性状应当具有其遗传基础。早期研究中采用的分子标记因过于保守或高变, 无法合理解释球形棕囊藻的生物地理分布状况, 与其性状特征分化也没有清晰的关联。
生态型(ecotype)是指同一物种的不同种群长期生活在不同环境中, 由于环境选择和隔离产生趋异适应, 成为遗传上有差异、适应不同生态环境的类群, 相当于分类学上的亚种(Turesson, 1922; Begon, 2005)。基于叶绿体S-27基因间隔区和线粒体8基因分子标记研究都表明, 分离于南海的部分球形棕囊藻藻株能形成厘米级“巨型囊体”, 以But-fuco作为特征色素, 且其在基因型属于Ⅳ型。在南海海域2015~2021年期间的调查发现, 该海域存在包括Ⅰ、Ⅱ和Ⅳ型之内多种基因型球形棕囊藻游离细胞, 但藻华期间采集的球形棕囊藻囊体都属于Ⅳ型(Zhang, 2021, 2022; Niu, 2022)。室内模拟实验也发现, Ⅳ型球形棕囊藻比Ⅰ和Ⅱ型具有更高的溶血活性和生物毒性。因此, “巨型囊体”球形棕囊藻与其他球形棕囊藻相比具有明显的性状和遗传差异, 应属于一类独特的生态型——“巨囊”生态型(Zhang, 2022)。本研究发现, 在青岛沿岸形成藻华的球形棕囊藻可以形成厘米级“巨型囊体”, 囊体叶绿体S-27基因间隔区与“巨囊”生态型球形棕囊藻完全一致, 均属于Ⅳ型, 且以But-fuco作为特征色素。上述结果表明此次青岛沿岸球形棕囊藻藻华是由“巨囊”生态型形成。
3.2 南黄海球形棕囊藻藻华的监测和研究展望
球形棕囊藻藻华暴发具有规模大、时间长等特征。如2016~2017年北部湾球形棕囊藻藻华影响海域覆盖了从广西防城港至广东雷州半岛的近岸海域, 持续时间从2016年12月至次年3月(贺成等, 2019); 1997年我国东南沿海首次暴发球形棕囊藻藻华, 面积超过3 000 km2, 持续6个月(陈菊芳等, 1999)。此外, 球形棕囊藻藻华往往会在暴发海域多年持续发生, 很难消除。20世纪80~90年代, 球形棕囊藻藻华在北大西洋的北海及邻近海域几乎连年出现, 1997年以来, 我国南海海域也连续多年暴发, 2011年至今, 北部湾几乎每年冬季都会发生(沈萍萍等, 2021)。南黄海海域的球形棕囊藻藻华是否会连年出现, 值得密切关注。
球形棕囊藻藻华是典型的有害藻华, 对海洋生态系统、水产养殖业以及沿岸大型设施运行等有不利影响(沈萍萍等, 2021)。南黄海球形棕囊藻藻华的潜在危害同样值得密切关注。球形棕囊藻藻华暴发时会产生二甲基硫化物和硫丙酸等有毒物质, 常造成海洋生物死亡。藻华消亡时, 高生物量囊体细胞分解消耗大量氧气, 造成水体缺氧, 威胁海洋生物生存(沈萍萍等, 2018)。1997年我国东南沿海暴发的大规模藻华造成养殖生物大量死亡, 仅广东拓林湾的渔业直接损失超过6 000万元(陈菊芳等, 1999)。前人研究发现, 球形棕囊藻南海株系可产生溶血毒素, 是造成大量海洋生物死亡的原因之一(何家菀等, 1999)。本文近期研究也发现, “巨囊”生态型球形棕囊藻(Ⅳ型)比Ⅰ和Ⅱ型具有更高的溶血活性, 对轮虫和卤虫等浮游生物的生物毒性更强(Zhang, 2022)。南黄海的“巨囊”生态型球形棕囊藻有可能对该海域的水产养殖活动造成损害。球形棕囊藻具有胶质囊体, 容易堵塞冷却系统过滤网, 威胁沿海地区核电和热点设施的安全运行,南海北部湾海域的球形棕囊藻藻华对核电运行的影响是备受关注的热点问题(曹西华等, 2017)。近年来, 我国沿海大力发展核电和火电工程, 南黄海沿岸已建立和正在建立多个核电和火电厂, 依赖大量海水来维持冷源系统正常运行。南黄海海域“巨囊“生态型球形棕囊藻藻华对核电和火电冷源系统安全运行的影响值得高度关注。
球形棕囊藻藻华在渤海和南海都有多次形成大规模藻华的记录, 但在黄、东海海域很少发生, 其原因有待深入研究。本研究发现, 此次南黄海的球形棕囊藻藻华是由“巨囊”生态型形成。以往渤海和北黄海球形棕囊藻藻华期间, 也有“巨型囊体”出现的记录(李伟才等, 2006; 曲凌云等, 2008), 但由于缺乏现场样品和分离的球形棕囊藻培养系, 无法进行进一步验证。基于2021年对渤海、黄海和东海浮游植物群样品的分析, 我们发现渤海也存在Ⅳ型球形棕囊藻, 而黄海、东海海域的球形棕囊藻则以其他基因型为主。这表明渤海海域以往的球形棕囊藻藻华极有可能也是由“巨囊”生态型形成。但是, 此次藻华过程中的“巨囊”生态型球形棕囊藻从何而来, 我国南方、北方海域的“巨囊”生态型球形棕囊藻是否存在种群隔离和生理生态特征的差异等, 目前并不清楚。其次, 这次南黄海球形棕囊藻藻华也具有一些独有的特征: 藻华期海水温度仅为12~14 °C, 远低于南海海域藻华发生时的海水温度(水温20 °C左右) (徐宁等, 2003; 贺成等, 2019)。此外, 以往研究认为高浓度硝态氮是球形棕囊藻大量繁殖和形成藻华的重要物质基础(Lancelot, 2007; Wang, 2021), 但在南黄海球形棕囊藻藻华期间, 海水中DON浓度(21~23 μmol/L)远高于DIN浓度(5.0~9.5 μmol/L), 高浓度DON是否有利于此次球形棕囊藻藻华形成仍有待阐明。鉴于球形棕囊藻藻华对海洋生态系统、水产养殖业、沿岸核电和火电等设施的潜在危险, 有必要开展针对性的研究, 深入揭示我国北方海域球形棕囊藻藻华的发生机制, 在此基础上进一步强化对北方海域球形棕囊藻藻华的监测预警。
本次南黄海球形棕囊藻藻华已被证实是由“巨囊”生态型形成。在海水中, 球形棕囊藻可以游离单细胞和囊状群体两种形态存在(齐雨藻等, 2001), 囊体出现常被视为藻华形成的标志。在藻华形成前, 球形棕囊藻以游离单细胞形式存活于海水中。球形棕囊藻游离单细胞大小仅为3~8 μm, 通过传统的显微镜观察手段难以实现对游离细胞的鉴定和监测。“巨囊”生态型球形棕囊藻以But-fuco作为特征色素, 在北部湾藻华的研究中, Wang等(2022)将But-fuco含量作为诊断色素, 成功应用于球形棕囊藻藻华的过程研究和早期诊断。根据“巨囊”生态型球形棕囊藻的遗传序列信息, Niu等(2022)开发了以线粒体8基因为靶区的特异性qPCR定量方法, 检测限可达到30 cells/L, 成功应用于北部湾海域球形棕囊藻藻华监测和研究中。对青岛沿岸采集的球形棕囊藻线粒体8基因扩增测序结果表明, 其序列信息与南海“巨囊”生态型序列一致, 这表明前期研发的“巨囊”生态型球形棕囊藻特异性qPCR方法可以用于北方海域球形棕囊藻的检测。这些研究手段为进一步开展北方海域球形棕囊藻的监测和研究工作奠定了基础。
4 结论
2021年11月底至12月初, 青岛沿岸暴发球形棕囊藻藻华, 藻华中产生大量囊体主要集聚于青岛黄岛至胶南沿岸。藻华发生时, 青岛沿岸表层海水温度低, 仅为12~14 °C, 呈现高DON、低DIN营养盐组成特征。海水中囊体丰度可超过20个/L, 最大直径超过1 cm。藻华中形成的囊体与南海“巨囊”生态型球形棕囊藻一样, 均以But-fuco为特征色素; 叶绿体S-27序列完全一致, 与南海“巨囊”生态型球形棕囊藻同属于基因Ⅳ型。“巨囊”生态型球形棕囊藻藻华可能会对南黄海生态系统、水产养殖业和沿岸核电、热电冷却系统构成威胁, 亟需加强我国北方海域球形棕囊藻藻华形成机制研究, 进一步提高监测预警能力, 防控藻华危害。
致谢 感谢参与现场调查和采样全体科研人员, 以及烟台大学江涛教授提供部分现场调查信息。
王锦秀, 孔凡洲, 陈振帆, 等, 2019. 六株球形棕囊藻的色素组成特征研究[J]. 海洋与湖沼, 50(3): 611-620.
曲凌云, 吕颂辉, 高春蕾, 等, 2008. 棕囊藻渤海株核糖体18S rDNA和ITS基因结构序列分析[J]. 海洋科学进展, 26(2): 200-206.
齐雨藻, 沈萍萍, 王艳, 2001. 棕囊藻属()的分类与生活史(综述)[J]. 热带亚热带植物学报, 9(2): 174-184.
李亚男, 沈萍萍, 黄良民, 等, 2012. 棕囊藻的分类及系统进化研究进展[J]. 生态学杂志, 31(3): 745-754.
李伟才, 孙军, 宋书群, 等, 2006. 烟台港和邻近锚地及其入境船舶压舱水中的浮游植物[J]. 海洋湖沼通报(4): 70-77.
何家菀, 施之新, 张银华, 等, 1999. 一种棕囊藻的形态特征与毒素分析[J]. 海洋与湖沼, 30(2): 172-179.
沈萍萍, 齐雨藻, 2021. 棕囊藻属()的种类多样性及地理分布特征研究进展[J]. 海洋与湖沼, 52(1): 1-15.
沈萍萍, 齐雨藻, 欧林坚, 2018. 中国沿海球形棕囊藻()的分类、分布及其藻华[J]. 海洋科学, 42(10): 146-162.
陈菊芳, 徐宁, 江天久, 等, 1999. 中国赤潮新记录种——球形棕囊藻()[J]. 暨南大学学报(自然科学版), 20(3): 124-129.
贺成, 宋书群, 李才文, 2019. 广西北部湾海域球形棕囊藻囊体时空分布及其影响因素[J]. 海洋与湖沼, 50(3): 630-643.
徐宁, 齐雨藻, 陈菊芳, 等, 2003. 球形棕囊藻(Scherffel)赤潮成因分析[J]. 环境科学学报, 23(1): 113-118.
曹西华, 俞志明, 邱丽霞, 2017. 改性黏土法消除球形棕囊藻赤潮的现场实验与效果评估[J]. 海洋与湖沼, 48(4): 753-759.
屠建波, 张秋丰, 徐玉山, 等, 2011. 渤海湾天津近岸海域首次棕囊藻赤潮初探[J]. 海洋通报, 30(3): 334-337.
ANTAJAN E, CHRÉTIENNOT-DINET M J, LEBLANC C,, 2004. 19′-hexanoyloxyfucoxanthin may not be the appropriate pigment to trace occurrence and fate of: the case ofin Belgian coastal waters [J]. Journal of Sea Research, 52(3): 165-177.
BEGON M, TOWNSEND C R, HARPER J L, 2005. Ecology: From Individuals to Ecosystems [M]. 4th ed. Oxford: Wiley-Blackwell.
BUMA A G J, BANO N, VELDHUIS M J W,, 1991. Comparison of the pigmentation of two strains of the prymnesiophytesp. [J]. Netherlands Journal of Sea Research, 27(2): 173-182.
CHARLSON R J, LOVELOCK J E, ANDREAE M O,, 1987. Oceanic phytoplankton, atmospheric sulphur, cloud albedo and climate [J]. Nature, 326(6114): 655-661.
CHEN Y Q, SHAO P, WANG N,, 2003. Molecular identification of bloom-forming speciesglobosa (Prymnesiophyta) and its dispersal based on rDNA ITS sequence analysis [J]. Acta Oceanologica Sinica, 22(2): 243-253.
DITULLIO G R, GARCIA N, RISEMAN S F,, 2007. Effects of iron concentration on pigment composition ingrown at low irradiance [J]. Biogeochemistry, 83(1/2/3): 71-81.
HAI D N, LAM N N, DIPPNER J W, 2010. Development ofblooms in the upwelling waters of the South Central coast of Viet Nam [J]. Journal of Marine Systems, 83(3/4): 253-261.
KALYAANAMOORTHY S, MINH B Q, WONG T K F,, 2017. ModelFinder: fast model selection for accurate phylogenetic estimates [J]. Nature Methods, 14(6): 587-589.
KONG F Z, YU R C, ZHANG Q C,, 2012. Pigment characterization for the 2011 bloom in Qinhuangdao implicated “brown tide” events in China [J]. Chinese Journal of Oceanology and Limnology, 30(3): 361-370.
KUMAR S, STECHER G, LI M,, 2018. MEGA X: molecular evolutionary genetics analysis across computing platforms [J]. Molecular Biology and Evolution, 35(6): 1547-1549.
LANCELOT C, GYPENS N, BILLEN G,, 2007. Testing an integrated river-ocean mathematical tool for linking marine eutrophication to land use: the-dominated Belgian coastal zone (Southern North Sea) over the past 50 years [J]. Journal of Marine Systems, 64(1/2/3/4): 216-228.
LANCELOT C, ROUSSEAU V, GYPENS N, 2009. Ecologically based indicators fordisturbance in eutrophied Belgian coastal waters (Southern North Sea) based on field observations and ecological modelling [J]. Journal of Sea Research, 61(1/2): 44-49.
LANGE M, CHEN Y Q, MEDLIN L K, 2002. Molecular genetic delineation ofspecies (Prymnesiophyceae) using coding and non-coding regions of nuclear and plastid genomes [J]. European Journal of Phycology, 37(1): 77-92.
MADHUPRATAP M, SAWANT S, GAUNS M, 2000. A first report on a bloom of the marine prymnesiophycean,from the Arabian Sea [J]. Oceanologica Acta, 23(1): 83-90.
MEDLIN L, ZINGONE A, 2007. A taxonomic review of the genus[J]. Biogeochemistry, 83(1/2/3): 3-18.
NIU Z, LIU C, ZHANG Q C,, 2022. Development of sensitive genotype-specific quantitative polymerase chain reaction methods for detection ofin the South China Sea [J]. Limnology and Oceanography: Methods, 20(3): 131-145.
QI Y Z, CHEN J F, WANG Z H,, 2004. Some observations on harmful algal bloom (HAB) events along the coast of Guangdong, southern China in 1998 [J]. Hydrobiologia, 512(1/2/3): 209-214.
RONQUIST F, TESLENKO M, VAN DER MARK P,, 2012. MrBayes 3.2: efficient Bayesian phylogenetic inference and model choice across a large model space [J]. Systematic Biology, 61(3): 539-542.
ROUSSEAU V, MATHOT S, LANCELOT C, 1990. Calculating carbon biomass ofsp. from microscopic observations [J]. Marine Biology, 107(2): 305-314.
SAZHIN A F, ARTIGAS L F, NEJSTGAARD J C,, 2007. The colonization of twospecies () by pennate diatoms and other protists: a significant contribution to colony biomass [J]. Biogeochemistry, 83(1/2/3): 137-145.
SCHLÜTER L, MØHLENBERG F, HAVSKUM H,, 2000. The use of phytoplankton pigments for identifying and quantifying phytoplankton groups in coastal areas: testing the influence of light and nutrients on pigment/chlorophyllratios [J]. Marine Ecology Progress Series, 192: 49-63.
SEOANE S, ZAPATA M, ORIVE E, 2009. Growth rates and pigment patterns of haptophytes isolated from estuarine waters [J]. Journal of Sea Research, 62(4): 286-294.
SMITH D R, ARRIGO K R, ALDERKAMP A C,, 2014a. Massive difference in synonymous substitution rates among mitochondrial, plastid, and nuclear genes ofalgae [J]. Molecular Phylogenetics and Evolution, 71: 36-40.
SMITH JR W O, LIU X, TANG K W,, 2014b. Giantism and its role in the harmful algal bloom species[J]. Deep Sea Research Part II: Topical Studies in Oceanography, 101: 95-106.
SONG H Y, CHEN Y, GIBSON K,, 2021. High genetic diversity of the harmful algal bloom speciesrevealed using the molecular marker[J]. Harmful Algae, 107: 102065.
SONG H Y, LIU F, LI Z L,, 2020. Development of a high-resolution molecular marker for trackinggenetic diversity through comparative analysis of chloroplast genomes [J]. Harmful Algae, 99: 101911.
TANG K W, 2003. Grazing and colony size development in(Prymnesiophyceae): the role of a chemical signal [J]. Journal of Plankton Research, 25(7): 831-842.
TURESSON G, 1922. The genotypical response of the plant species to the habitat [J]. Hereditas, 3(3): 211-350.
VAN LEEUWE M A, STEFELS J, 1998. Effects of iron and light stress on the biochemical composition of Antarcticsp. (Prymnesiophyceae). II. Pigment composition [J]. Journal of Phycology, 34(3): 496-503.
VAN LEEUWE M A, VISSER R J W, STEFELS J, 2014. The pigment composition of(Haptophyceae) under various conditions of light, temperature, salinity, and iron [J]. Journal of Phycology, 50(6): 1070-1080.
VAN RIJSSEL M, HAMM C, GIESKES W, 1997.(Prymnesiophyceae) colonies: hollow structures built with small amounts of polysaccharides [J]. European Journal of Phycology, 32(2): 185-192.
VAULOT D, BIRRIEN J L, MARIE D,, 1994. Morphology, ploidy, pigment composition, and genome size of cultured strains of(Prymnesiophyceae) [J]. Journal of Phycology, 30(6): 1022-1035.
WANG J X, KONG F Z, GENG H X,, 2022. Pigment characterization of the giant-colony-forming haptophytein the Beibu Gulf reveals blooms of different origins [J]. Applied and Environmental Microbiology, 88(4): e0165421.
WANG X D, SONG H Y, WANG Y,, 2021. Research on the biology and ecology of the harmful algal bloom speciesin China: progresses in the last 20 years [J]. Harmful Algae, 107: 102057.
WANG X D, TANG K W, WANG Y,, 2010. Temperature effects on growth, colony development and carbon partitioning in threespecies [J]. Aquatic Biology, 9(3): 239-249.
WANG X D, WANG Y, SMITH W O, 2011. The role of nitrogen on the growth and colony development of(Prymnesiophyceae) [J]. European Journal of Phycology, 46(3): 305-314.
WASSMANN P, RATKOVA T, REIGSTAD M, 2005. The contribution of single and colonial cells ofto spring and summer blooms in the north-eastern North Atlantic [J]. Harmful Algae, 4(5): 823-840.
WHIPPLE S J, PATTEN B C, VERITY P G, 2005. Life cycle of the marine alga: a conceptual model to summarize literature and guide research [J]. Journal of Marine Systems, 57(1/2): 83-110.
WINNEPENNINCKX B, BACKELJAU T, DEWACHTER R, 1993. Extraction of high molecular weight DNA from molluscs [J]. Trends in Genetics, 9(12): 407.
YU Z M, SONG X X, CAO X H,, 2017. Mitigation of harmful algal blooms using modified clays: theory, mechanisms, and applications [J]. Harmful Algae, 69: 48-64.
ZAPATA M, JEFFREY S W, WRIGHT S W,, 2004. Photosynthetic pigments in 37 species (65 strains) of Haptophyta: implications for oceanography and chemotaxonomy [J]. Marine Ecology Progress Series, 270: 83-102.
ZAPATA M, RODRÍGUEZ F, GARRIDO J L, 2000. Separation of chlorophylls and carotenoids from marine phytoplankton: a new HPLC method using a reversed phase C8column and pyridine-containing mobile phases [J]. Marine Ecology Progress Series, 195: 29-45.
ZHANG Q C, NIU Z, WANG J X,, 2021. Development of high-resolution chloroplast markers for intraspecific phylogeographic studies of[J]. Journal of Oceanology and Limnology, 39(2): 508-524.
ZHANG Q C, LIU C, WANG J X,, 2022. Intense blooms ofin the South China Sea are caused by a unique “giant-colony” ecotype [J]. Harmful Algae, 114: 102227.
FIRST REPORT OFBLOOM CAUSED BY “GIANT-COLONY” ECOTYPE IN THE SOUTH YELLOW SEA
ZHANG Qing-Chun1, 2, 4, XIANG Ling1, 3, WANG Jin-Xiu1, 3, LIU Yang1, 5, SONG Min-Jie1, 3, WANG Yun-Feng1, 2, 4, KONG Fan-Zhou1, 2, 4, GENG Hui-Xia1, 2, 4, YAN Tian1, 2, 4, YU Ren-Cheng1, 2, 3, 4
(1.CAS Key Laboratory of Marine Ecology and Environmental Sciences, Institute of Oceanology, Chinese Academy of Sciences, Qingdao 266071, China; 2. Laboratory for Marine Ecology and Environmental Science, Pilot National Laboratory for Marine Science and Technology (Qingdao), Qingdao 266071, China; 3. University of Chinese Academy of Sciences, Beijing 100049, China; 4.Center for Ocean Mega-Science, Chinese Academy of Sciences, Qingdao 266071, China;5. Qingdao University of Science & technology, Qingdao 266045, China)
, an important causative species of harmful algal blooms worldwide, exhibits varying morphological and physiological features and high genetic diversity. The bloom-formingin the South China Sea (SCS) is proposed to be a unique “giant-colony” ecotype, which features giant colonies and possesses 19′-butanoyloxyfucoxanthin (But-fuco) as its diagnostic pigment, and is genetically distinct from other strains of...blooms occur frequently in the SCS, as well as several times in the Bohai Sea and the North Yellow Sea, but never in the South Yellow Sea (SYS). A.bloom broke out in the coastal waters of Qingdao from late November to early December, 2021. During the bloom, it was found that the surface temperature ranged 12~14 °C, andexhibited high DON (dissolved organic nitrogen) content and low DIN (dissolved inorganic nitrogen) content in the Qingdao coastal waters. The colony abundance was more than 20 colonies/L with the maximum diameter of 18 mm. The sampled colonies from the Qingdao coastal waters contained a unique diagnostic pigment But-fuco, and belonged to the same genetic clade of “giant-colony” ecotype of.distributed in the SCS. This study firstly reported that thebloom in the SYS caused by the “giant-colony” ecotype. The “giant-colony”.bloom may threaten local plankton ecosystem, aquaculture, and coastal nuclear power plant. Therefore, it is our key task to detect and monitor.blooms, and study the mechanism of its occurrence in the northern waters of China.
; “giant-colony” ecotype; harmful algal bloom (HAB); South Yellow Sea
Q14
10.11693/hyhz20220100017
*青岛海洋科学与技术试点国家实验室山东省专项经费, 2021QNLM040001-2; 国家自然科学基金委面上项目42076140号, U20A004号, 41776127号; 国家科技基础资源调查项目, 2018FY100200号。张清春, 副研究员, E-mail: qczhang@qdio.ac.cn
于仁成, 博士生导师, 研究员, E-mail: rcyu@qdio.ac.cn
2022-01-21,
2022-02-09

