双硫仑协同奥沙利铂诱导胃癌细胞铁死亡
喻 鑫,刘 弋,周 波,曹先东
胃癌是致死率较高的一种消化道恶性肿瘤[1],早期胃癌进行手术治疗以及转移性胃癌进行化疗可使患者明显获益[2]。奥沙利铂(oxaliplatin,Oxa)是临床常用的胃癌化疗药物,但Oxa在临床使用过程中经常出现耐药且副作用多[3-4]。因此,当前急需探索新的治疗方法来增加奥沙利铂的治疗效果,减少其毒副作用。
双硫仑(disulfiram,DSF)是一种乙醛脱氢酶抑制剂,其作为一种解酒药,已被报道具有抗肿瘤的作用[5]。研究[6]发现,DSF可通过抑制Wnt/β-catenin和NF-κB通路抑制胃癌细胞生长,DSF可通过上调活性氧簇(reactive oxygen species,ROS)表达诱导恶性胶质瘤细胞铁死亡[7]。DSF与多种化疗药物联用可发挥协同作用,如DSF与多西他赛或顺铂联用可协同抑制乳腺癌生长[8-9]。DSF与Oxa联用能否发挥协同作用抑制胃癌细胞生长尚未见报道。该研究以人胃癌细胞BGC-823为研究对象,进行体外细胞实验,旨在探索DSF与Oxa联用的治疗效果及作用机制,为DSF老药新用治疗胃癌提供线索,为临床DSF与Oxa联用治疗胃癌提供理论依据。
1 材料与方法
1.1 细胞胃癌BGC-823细胞由中国科学技术大学生命科学院中心惠赠。
1.2 主要试剂RPMI 1640培养基、0.25%胰蛋白酶、青-链霉素双抗、BODIPY 581/591 C11dye (Invitrogen)购自美国赛默飞世尔科技公司;胎牛血清购自上海吉泰依科赛生物科技股份有限公司;DSF、Oxa、Z-VAD、NAC、Necro-1、Ferr-1购自上海蓝木化工有限公司;AnnexinV/PI凋亡试剂盒、碘化吡啶购自上海碧云天生物技术有限公司;PCR逆转录试剂盒、PCR荧光定量试剂盒购自于北京宝日医生物技术有限公司,Trizol试剂购自于美国赛默飞世尔科技公司。
1.3 细胞培养将BGC-823细胞培养于37 ℃,5% CO2恒温培养箱中以1640培养基(含10%胎牛血清和1%青-链霉素双抗)培养,每天显微镜下观察,2~3 d更换一次培养基,细胞传代时用0.25%胰蛋白酶消化,取对数生长期细胞为实验用细胞。
1.4 CCK-8检测细胞活力取对数生长期细胞计数后,调整细胞密度为2×105/ml,接种于96孔板内,待细胞贴壁后,梯度稀释药物,实验分为Oxa组、DSF组、Oxa+DSF组和空白组。Oxa组给予不同浓度(0、5、10、20、40、80、160 μmol/L) Oxa处理,DSF组给予不同浓度(0、8、16、32、64、128、256 μmol/L)DSF处理,Oxa+DSF组中每组的Oxa给药浓度与单用组相同,Oxa与DSF给药浓度比为1 ∶1.6。各组加药,每组设3个复孔,待不同浓度的DSF与Oxa处理BGC-823细胞24、48、72 h后,每孔加入10 μl CCK-8溶液,在细胞培养箱培养1~3 h后,用酶标仪检测450 nm处的吸光度(optical density,OD),根据OD值计算细胞活力,使用Compu Syn软件做协同作用曲线。
1.5 NAC、Z-VAD、Necro-1、Ferr-1抑制对细胞活力的回复实验应用凋亡抑制剂Z-VAD、坏死性凋亡抑制剂Necro-1、铁死亡抑制剂Ferr-1和活性氧抑制剂NAC进行细胞活力回复实验。实验分为DMSO对照组、NAC组(5 mmol/L)、Oxa组(60 μmol/L)、DSF组(40 μmol/L)、Oxa+DSF组、Oxa+DSF+NAC组;实验分为DMSO对照组、Z-VAD组(40 μmol/L)、Oxa组(60 μmol/L)、DSF组(40 μmol/L)、Oxa+DSF组、Oxa+DSF+Z-VAD组;实验分为DMSO对照组、Necro-1组(20 μmol/L)、Oxa组(60 μmol/L)、DSF组(40 μmol/L)、Oxa+DSF组、Oxa+DSF+ Necro-1组;实验分为DMSO对照组、Ferr-1组(5 μmol/L)、Oxa组(60 μmol/L)、DSF组(40 μmol/L)、Oxa+DSF组、Oxa+DSF+Ferr-1组。取对数生长期细胞计数后,调整细胞密度为2×105/ml,接种于96孔板内,待细胞贴壁后,加入不同浓度药物处理24 h后,每孔加入10 μl CCK-8溶液,在细胞培养箱培养1~3 h后,用酶标仪检测450 nm处的OD值,根据OD值计算细胞活力。
1.6 Annexin V-FITC/PI检测细胞凋亡实验分为DMSO对照组、NAC组(5 mmol/L)、Oxa组(60 μmol/L)、DSF组(40 μmol/L)、Oxa+DSF组、Oxa+DSF+NAC组。取处于对数生长期的BGC-823细胞胰酶消化后接种于6孔板内,待6~12 h细胞贴壁后弃去培养基,每组加入新的含药培养基处理24 h,之后吸弃培养基,用不含EDTA的胰酶消化BGC-823细胞后收集细胞于EP管内,用预冷的PBS清洗一遍,离心后每管加入500 μl 1×Binding Buffer重悬细胞转入流式细胞管,每管加入5 μl AnnexinV-FITC避光10 min后,加入5 μl PI染色,混匀避光室温反应10~15 min,之后于流式细胞仪上机检测。
1.7 BODIPY 581/591 C11 dye (Invitrogen) 染色检测脂质过氧化自由基(lipid ROS,LipROS)水平实验分为DMSO对照组、Ferr-1组(5 μmol/L)、Oxa组(60 μmol/L)、DSF组(40 μmol/L)、Oxa+DSF组、Oxa+DSF+Ferr-1组, 取对数生长期细胞计数后,调整细胞密度为2×105/ml, 接种于6孔板内,待细胞贴壁后,加入不同浓度药物处理24 h后弃去培养基,每孔加入提前稀释好的含BODIPY 581/591 C11的新鲜培养基,放入培养箱培养10 min左右,胰酶消化细胞之后转入流式细胞管上机检测。
1.8 qRT-PCR实验设置DMSO对照组、Ferr-1组(5 μmol/L)、Oxa组(60 μmol/L)、DSF组(40 μmol/L)、Oxa+DSF组,取对数生长期细胞计数后,调整细胞密度为2×105/ml, 接种于6孔板内,待细胞贴壁后,加入不同浓度药物处理BGC-823细胞24 h后弃去培养基,用TRIzol法提取总RNA,使用Takara逆转录试剂盒用两步法逆转录成cDNA,用Takara荧光定量试剂盒进行实时荧光定量PCR反应。引物序列见表1。

表1 引物序列表

2 结果
2.1 DSF与Oxa联用抑制BGC-823细胞活力CCK-8检测细胞活力结果显示,不同浓度的DSF、Oxa处理BGC-823细胞24、48、72 h后,DSF、Oxa均能时间与剂量依耐性抑制BGC-823细胞活力(图1A、B)。DSF与Oxa联用时,DSF能明显增强Oxa对BGC-823细胞活力抑制效果(F=382.37,P<0.001,图1C);用CompuSyn软件做Farction-Effect协同作用曲线,结果显示所有的联合指数(combination index,CI)值都小于1 (CI<1),表明DSF与Oxa联用联用有很好的协同作用(图1D)。
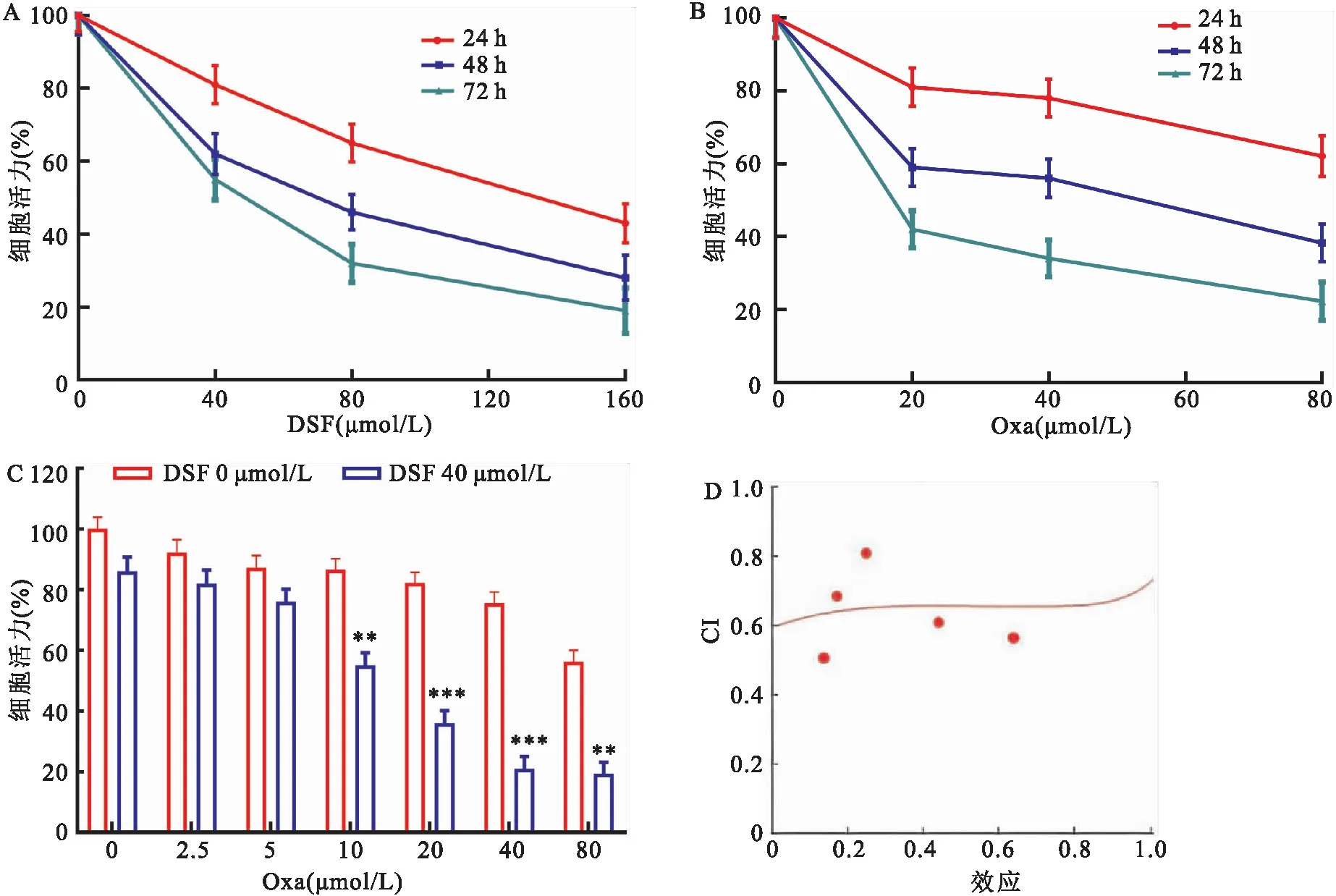
图1 DSF与Oxa对BGC-823细胞活力的影响
2.2 DSF与Oxa联用诱导BGC-823细胞凋亡和铁死亡本实验使用了凋亡抑制剂Z-VAD、坏死性凋亡抑制剂Necro-1、铁死亡抑制剂Ferr-1和活性氧抑制剂NAC进行细胞活力回复实验。结果显示:Z-VAD处理能部分逆转DSF与Oxa联用诱导的细胞活力抑制(F=67.62,P<0.05,图2A);Necro-1处理不能逆转DSF与Oxa联用诱导的细胞活力抑制(F=1.52,P>0.05,图2B);Ferr-1处理能完全逆转DSF与Oxa联用诱导的细胞活力抑制(F=397.54,P<0.001,图2C);NAC能逆转DSF与Oxa联用诱导的细胞活力抑制(F=382.62,P<0.001,图2D)。流式细胞术检测细胞凋亡结果也表明NAC能部分逆转DSF与Oxa联用引起的细胞凋亡(F=368.12,P<0.001,图3)。上述结果表明DSF与Oxa联用可部分引起BGC-823细胞凋亡和铁死亡。
2.3 铁死亡抑制剂Ferr-1能逆转DSF联合Oxa诱导胃癌细胞铁死亡进一步用流式细胞术检测铁死亡抑制剂Ferr-1是否能逆转DSF与Oxa联用后引起的胃癌细胞死亡。结果显示Ferr-1预处理BGC-823细胞后,DSF与Oxa联用引起BGC-823细胞死亡(PI阳性)明显减少,Ferr-1能逆转DSF与Oxa联合诱导的胃癌细胞铁死亡(F=402.52,P<0.001,图4),显然,DSF与Oxa联用能诱导胃癌细胞铁死亡。

图4 铁死亡抑制剂Ferr-1预处理BGC-823细胞后用DSF与Oxa单用或联用24 h后检测BGC-823细胞凋亡情况
2.4 DSF联合Oxa诱导BGC-823细胞铁死亡的分子机制LipROS BODIPY 581/591 C11染色流式细胞术检测结果显示,DSF与Oxa联用能明显诱导LipROS产生增多,铁死亡抑制剂Ferr-1预处理BGC-823细胞后,明显抑制DSF与Oxa联用诱导的BGC-823细胞LipROS产生增多(F=530.36,P<0.001,图5A、B);qRT-PCR结果显示,DSF与Oxa联用可引起促铁死亡调控基因PTGS2 mRNA表达水平上调(图5C),抑铁死亡调控基因GPX4和SLC7A11 mRNA表达水平下调(F=462.56,P<0.001,图5D、E)。上述结果表明DSF与Oxa联用明显促进LipROS产生增多,上调PTGS2 mRNA表达水平,下调GPX4和SLC7A11 mRNA表达水平,诱导胃癌细胞BGC-823细胞铁死亡。
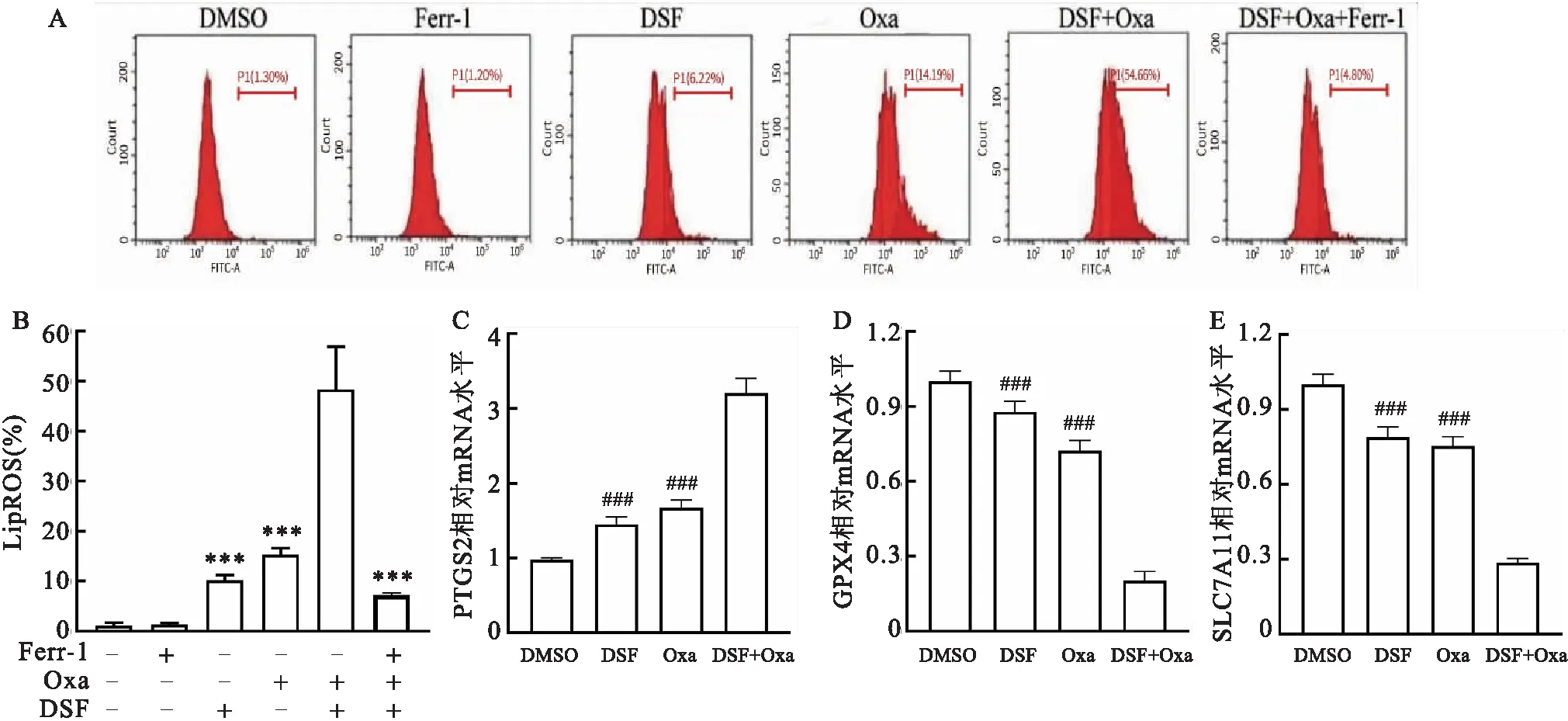
图5 DSF与Oxa联用诱导BGC-823细胞铁死亡
3 讨论
Oxa作为第三代铂类药物,对转移性胃癌有很好的效果,在临床使用中由于易发生耐药和毒副作用,目前仍有许多局限性[10],联合用药是一种很好的增效减毒的方法,因此急需找到有效的可增敏Oxa的药物。DSF为常见的戒酒药,二价过渡金属离子螯合剂,具有价格低廉、细胞毒性及良好的抗肿瘤效果等优势,有望作为抗肿瘤药物应用于临床[11]。DSF可通过抑制Wnt/β-catenin和NF-κB等通路抑制胃癌细胞的增殖、迁移、侵袭[6]。另有研究[12]发现,DSF与多种化疗药物联用可协同抑制肿瘤生长,如DSF与铜(Cu)联合作用可通过下调Casepas-3蛋白表达、上调Casepas-8蛋白,进而通过上调自噬相关蛋白抑制胃癌细胞凋亡而发挥抑制胃癌生长作用;DSF与Cu联合作用也可以通过调控应激反应和Wnt/β-catenin信号通路发挥抗肿瘤作用[13];DSF与多西他赛或顺铂联用可协同抑制乳腺癌生长[8-9]。DSF联用Oxa是否能发挥对胃癌细胞生长起协同作用不清楚,同时两者联用的作用机制也有待阐明。本研究以BGC-823细胞为实验对象,通过CCK-8实验检测细胞活力、流式细胞术检测细胞凋亡和LipROS变化情况及qRT-PCR来探索DSF与Oxa联用可诱导BGC-823细胞铁死亡。
本研究发现,DSF与Oxa联用可时间和剂量依赖性抑制BGC-823细胞活力。为了探索DSF与Oxa联用的作用机制,本研究使用凋亡抑制剂Z-VAD、坏死性凋亡抑制剂Necro-1、铁死亡抑制剂Ferr-1和活性氧抑制剂NAC,进行了细胞活力回复实验。发现DSF与Oxa联用可部分诱导BGC-823细胞凋亡,活性氧抑制剂NAC可以逆转DSF与Oxa联用诱导BGC-823细胞凋亡。铁死亡是一种区别于细胞凋亡、细胞坏死、细胞焦亡、细胞自噬的新型细胞程序性死亡方式[14],其是一种铁依赖的脂质过氧化引发的新的死亡方式[15],铁死亡过程中常出现LipROS[16],同时促铁死亡标记物PTGS2表达上升和抑铁死亡标记物GPX4、SLC7A11水平表达下调[17]。本研究发现铁死亡抑制剂Ferr-1可在一定程度上逆转DSF与Oxa联用引起的BGC-823细胞活力下降和细胞死亡,同时铁死亡抑制剂Ferr-1能部分逆转DSF与Oxa联用引起的BGC-823细胞LipROS产生增多,表明两药联用主要是通过诱导LipROS产生增多促进BGC-823细胞发生铁死亡。qRT-PCR结果也进一步提示DSF与Oxa联用可上调促铁死亡PTGS2 mRNA表达水平和下调抑铁死亡GPX4和SLC7A11 mRNA表达水平,诱导BGC-823细胞铁死亡。
综上所述,本研究发现DSF与Oxa发挥明显协同作用诱导BGC-823胃癌细胞铁死亡。DSF与Oxa联用诱导胃癌细胞铁死亡将为临床DSF老药新用提供线索,为DSF与Oxa联合用药治疗胃癌提供理论指导。

