下调lncRNA SPINT1-AS1通过靶向miR-211-5p对卵巢癌细胞生长和侵袭的影响
曾友玲,张 清,曾 洁,王 欢,侯 俐
卵巢癌是世界范围内最常见的生殖系统肿瘤之一,恶性程度较高[1-2]。卵巢癌的治疗在近十几年中得到较大的发展,然而多数患者的预后仍不能满足临床需求[3]。高度的增殖性和侵袭性是卵巢癌预后较差的重要原因之一[4]。探讨卵巢癌生长和转移的分子发生机制,是卵巢癌有效分子治疗靶点研究的重要方向。长链非编码RNA(long noncoding RNA,lncRNA)是细胞内具有重要功能的单链RNA分子,其广泛参与众多疾病的进展[5-6]。近年的研究[7-9]证实,卵巢癌组织中存在lncRNA的异常表达,其表达水平与卵巢癌的耐药性、放疗敏感性密切相关。lncRNA在卵巢癌中的功能引起了研究们的广泛关注。lncRNA SPINT1-AS1是目前发现的在恶性肿瘤中高表达的lncRNA,沉默lncRNA SPINT1-AS1的表达具有抑制细胞恶性侵袭和生长的作用[10-12]。该研究通过DIANA TOOLS数据库发现lncRNA SPINT1-AS1和miR-211-5p可能互为靶向关系。miR-211-5p是一个在卵巢癌中表达下调的抑癌基因,恢复其表达可抑制卵巢癌的生长和进展[13]。该研究通过检测卵巢癌组织和细胞系中lncRNA SPINT1-AS1的表达,旨在探究下调lncRNA SPINT1-AS1对卵巢癌SKOV-3细胞增殖和侵袭的影响,验证lncRNA SPINT1-AS1在卵巢癌细胞中的作用机制。
1 材料与方法
1.1 材料
1.1.1细胞与试剂 永生化卵巢上皮细胞IOSE80、卵巢癌细胞系(SKOV-3、A2780、OC3、HO-8910)均购自中国科学院上海细胞库。Lipofectamine 3000转染试剂购自美国Thermo Fisher公司。胎牛血清和细胞培养基均购自美国Hyclone公司。lncRNA SPINT1-AS1 siRNA(CAGGATCGAAGA-GGGCGCA)、mimics control、miR-211-5p mimics、siRNA control均由武汉巴菲尔生物技术服务公司构建。荧光素酶报告载体SPINT1-AS1野生型(WT)、SPINT1-AS1突变型(MUT)载体由上海剑钝生物科技有限公司构建。MTT试剂盒和Transwell小室购自大连美仑生物技术有限公司。山羊抗兔一抗β-Tubulin、PCNA、CyclinD1、MMP2、MMP9均购自美国Abcam公司(ab18207、ab29、ab16663、ab92536、ab76003)。
1.2 方法
1.2.1生物信息学方法 通过GEPIA数据库分析卵巢癌组织和正常组织中lncRNA SPINT1-AS1的表达差异。通过DIANA TOOLS数据库对lncRNA SPINT1-AS1的靶基因进行预测。
1.2.2细胞培养、分组与转染 将OC3细胞接种在含10%胎牛血清的RPMI 1640培养基,将SKOV-3、A2780、HO-8910、IOSE80细胞接种在含10%胎牛血清的DMEM/F12培养基。将对数生长期的SKOV-3细胞接种到12孔板,根据Lipofectamine 3000说明书将lncRNA SPINT1-AS1 siRNA或siRNA control分别转染至SKOV-3细胞中,命名为si-SPINT1-AS1组和si-NC组。转染48 h后,测定各组SKOV-3细胞中lncRNA SPINT1-AS1表达变化。
1.2.3荧光实时定量聚合酶链反应(fluorescence real-time quantitative polymerase chain reaction,qRT-PCR)测定lncRNA SPINT1-AS1和miR-211-5p表达 提取永生化卵巢上皮细胞IOSE80、卵巢癌细胞系(SKOV-3、A2780、OC3、HO-8910)的总RNA,逆转录反应得到cDNA。配制qRT-PCR反应体系,GAPDH作为lncRNA SPINT1-AS1表达量的参照,U6作为miR-211-5p表达量的参照。引物的序列如下,GAPDH F:5′-GCACCGTCAAGGCTGAGAAC-3′,R:5′-ATGGTGGTGAAGACGCCAGT-3′;lncRNA SPINT1-AS1 F:5′-GCCCTGGAGGATGAGAG-3′,R:5′-CAGATGC-TGTTGGCTAAAGA-3′;U6 F:5′-CTCGCTTCGGCAG-CACA-3′,R:5′-ACGCTTCACGAATTTGCGT-3′;miR-211-5p F:5′-CTCGAGTAACCGTATTGTTCGCGTCATGCCAGCA-3′,R:5′-GCGGCCGCCAGACCATGTGTCCCATTTG-3′。利用2-ΔΔCt法计算lncRNA SPINT1-AS1和miR-211-5p的相对表达水平。
1.2.4MTT方法检测SKOV-3细胞的增殖活性 将SKOV-3细胞按照si-SPINT1-AS1组(转染lncRNA SPINT1-AS1 siRNA)和si-NC组(转染siRNA control)的分组方法接种于96孔板,每孔3 000个细胞。于第1、2、3、4、5 天,每孔加25 μl的MTT试剂,在培养箱内结合3 h。每孔加125 μl的二甲基亚砜试剂,震荡30 min,酶标仪测定每孔SKOV-3细胞在450 nm波长的吸光度(A)值,代表各组SKOV-3细胞的增殖活性。
1.2.5Transwell小室实验检测SKOV-3细胞的侵袭能力 用无血清的培养基以1 ∶7稀释基质胶,包被Transwell小室。用无血清的培养基重悬si-SPINT1-AS1组和si-NC组SKOV-3细胞,在Transwell底部加含10%血清的培养基,培养箱孵育24 h。棉签擦出滤膜上层的细胞,用多聚甲醛固定35 min,在结晶紫中染色40 min。倒置显微镜下(100倍视野)观察细胞,取5个视野,统计分析每组侵袭细胞数。
1.2.6双荧光素酶报告基因实验分析lncRNA SPINT1-AS1对miR-211-5p的靶向作用 DIANA TOOLS数据库预测发现lncRNA SPINT1-AS1和miR-211-5p之间存在互补结合位点。把荧光素酶报告载体野生型WT以及突变型MUT分别和mimics control、miR-211-5p mimics共转染至SKOV-3细胞。常规培养48 h,参照双荧光素酶测定试剂盒说明书测定各组SKOV-3细胞中荧光素酶的活性。
1.2.7Western blot检测PCNA、CyclinD1、MMP2、MMP9蛋白表达 提取si-SPINT1-AS1组和si-NC组SKOV-3细胞总蛋白,电泳仪电压为120 V,电泳100 min。转膜电压为110 V,转膜110 min。将硝酸纤维素膜在6%的牛血清白蛋白中封闭,保证非特异性结合位点全部封闭。将硝酸纤维素膜在含有β-Tubulin、PCNA、CyclinD1、MMP2、MMP9抗体稀释液(均按1 ∶1 000稀释)的玻璃皿中结合13 h。将硝酸纤维素膜在含有二抗稀释液的玻璃皿中结合3 h。滴加化学发光液,显色和拍照,将β-Tubulin作为参照蛋白。

2 结果
2.1 lncRNA SPINT1-AS1在卵巢癌组织中的表达lncRNA SPINT1-AS1由250个核苷酸组成,其结构示意图见图1。GEPIA数据库显示(图2),lncRNA SPINT1-AS1在卵巢癌组织中的表达水平高于正常组织(P<0.01)。
图1 lncRNA SPINT1-AS1的结构示意图
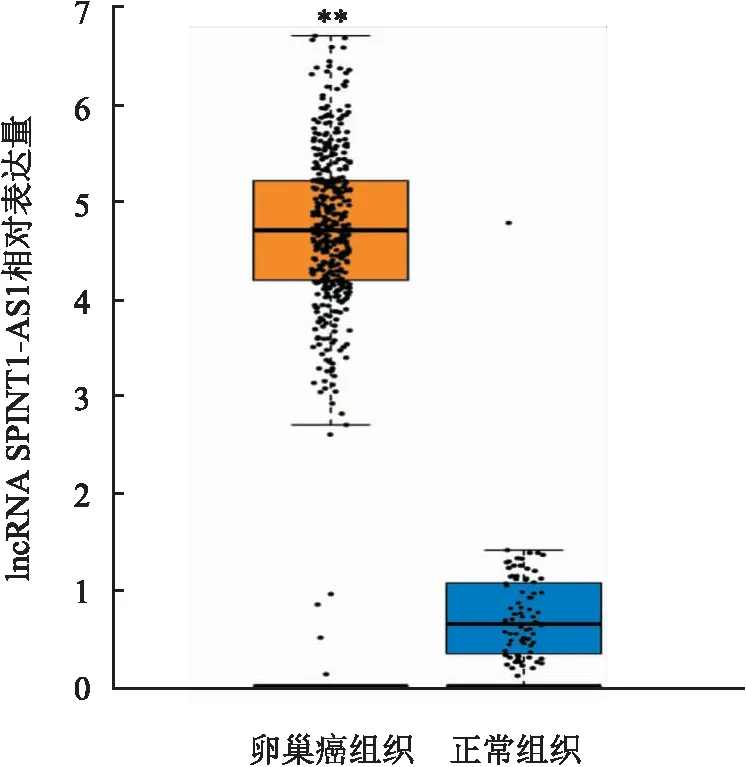
图2 lncRNA SPINT1-AS1在卵巢癌组织和正常组织中的表达
2.2 lncRNA SPINT1-AS1在卵巢癌细胞中的表达qRT-PCR结果显示(图3),与永生化卵巢上皮IOSE80细胞比较,卵巢癌细胞系(SKOV-3、A2780、OC3、HO-8910)中lncRNA SPINT1-AS1的表达水平升高(P<0.05),SKOV-3细胞中lncRNA SPINT1-AS1的表达水平最高(F=20.46,P<0.01)。
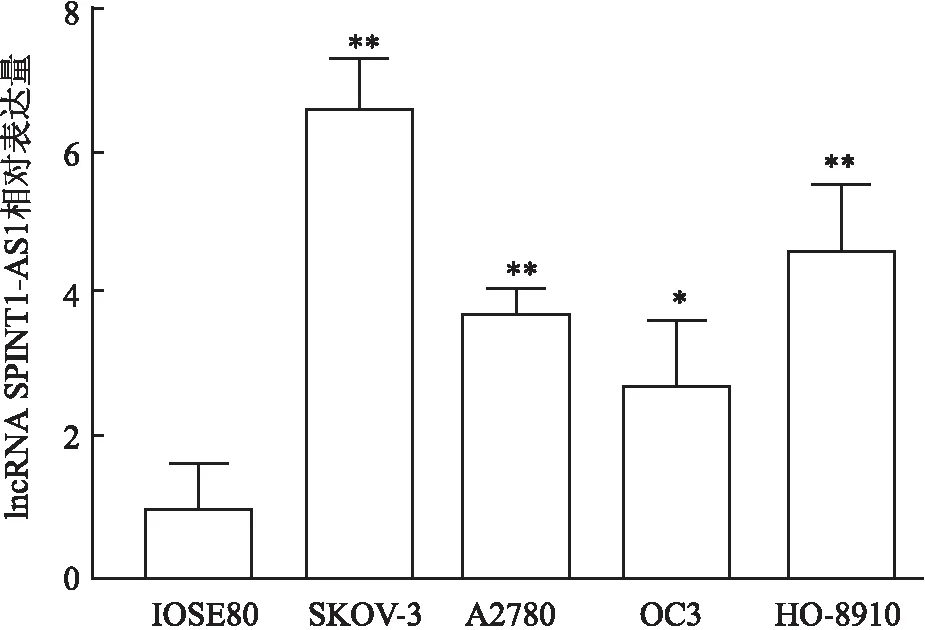
图3 lncRNA SPINT1-AS1在永生化卵巢上皮细胞和卵巢癌细胞系中的表达
2.3 两组SKOV-3细胞中lncRNA SPINT1-AS1的下调效率qRT-PCR结果显示,lncRNA SPINT1-AS1在si-SPINT1-AS1组和si-NC组的SKOV-3细胞中相对表达量分别为(1.06 ± 0.36)和(6.38 ± 0.77),si-SPINT1-AS1可有效下调SKOV-3细胞中lncRNA SPINT1-AS1的表达(t=6.24,P<0.01)。
2.4 下调lncRNA SPINT1-AS1表达对SKOV-3细胞增殖活性的影响MTT法检测显示(图4),与si-NC组比较,si-SPINT1-AS1组SKOV-3细胞接种2 d后,吸光度降低(P<0.05),下调lncRNA SPINT1-AS1抑制了SKOV-3细胞的增殖活性。
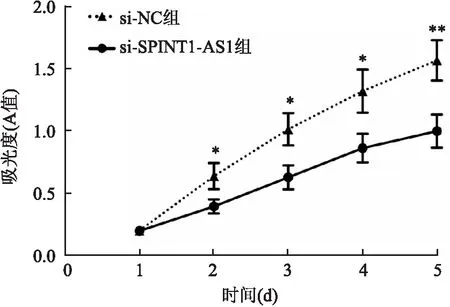
图4 下调lncRNA SPINT1-AS1表达对SKOV-3细胞增殖活性的影响
2.5 下调lncRNA SPINT1-AS1表达对SKOV-3细胞侵袭能力的影响Transwell小室实验显示(图5),si-NC组侵袭细胞数(113.90 ± 11.96)个/视野明显多于si-SPINT1-AS1组侵袭细胞数(44.27 ± 10.95)个/视野(t=4.30,P<0.01),下调lncRNA SPINT1-AS1抑制了SKOV-3细胞的侵袭能力。
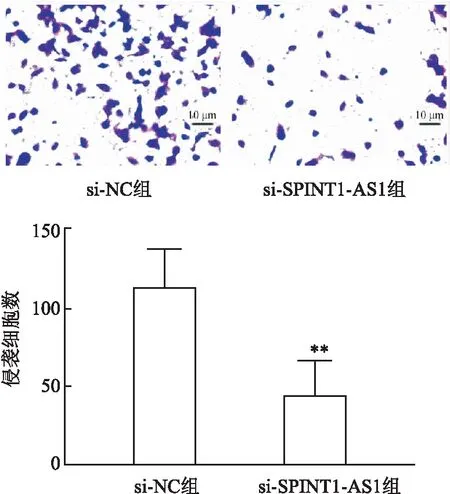
图5 下调lncRNA SPINT1-AS1对SKOV-3细胞侵袭能力的影响
2.6 lncRNA SPINT1-AS1和miR-211-5p互为靶向关系DIANA TOOLS数据库预测lncRNA SPINT1-AS1的靶向基因结果显示(图6),miR-211-5p和lncRNA SPINT1-AS1存在互补结合位点。双荧光素酶报告系统鉴定显示(图7),共转染WT与miR-211-5p mimics后荧光素酶活性较WT与mimics control明显降低(t=6.36,P<0.01),定点突变后,共转染MUT与miR-211-5p mimics较MUT与mimics control荧光素酶活性无明显差异(t=0.40,P=0.71),表明lncRNA SPINT1-AS1和miR-211-5p互为靶向关系。
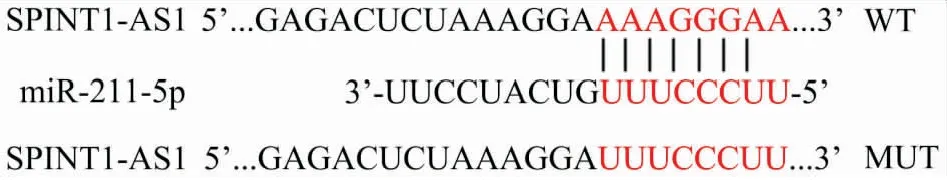
图6 lncRNA SPINT1-AS1互补结合miR-211-5p的序列区域
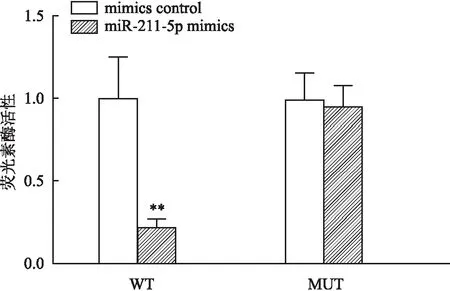
图7 双荧光素酶报告系统鉴定lncRNA SPINT1-AS1和miR-211-5p互为靶向关系
2.7 下调lncRNA SPINT1-AS1对SKOV-3细胞中miR-211-5p表达的情况qRT-PCR结果显示,si-NC组SKOV-3细胞中miR-211-5p相对表达量(1.03 ± 0.43)明显低于si-SPINT1-AS1组相对表达量(5.33 ± 0.69),下调lncRNA SPINT1-AS1能够增加miR-211-5p的表达(t=5.27,P<0.01)。
2.8 下调lncRNA SPINT1-AS1的SKOV-3细胞中PCNA、CyclinD1、MMP2、MMP9蛋白的表达Western blot检测发现(图8),下调lncRNA SPINT1-AS1后,增殖表型蛋白PCNA、CyclinD1表达水平降低,转移表型蛋白MMP2、MMP9表达水平降低。
3 讨论
lncRNA是一种在人体细胞中发挥广泛调节功能的内源性RNA,与消化系统疾病、内分泌系统疾病、生殖系统疾病等密切相关[14-16]。lncRNA与卵巢癌的发病有关,TTN-AS1[17]等lncRNA能够有效减少卵巢癌细胞的数量,阻碍卵巢癌的进展。MCM3AP-AS1[18]、LINC00176[19]等lncRNA能够延缓卵巢癌细胞的凋亡,增强卵巢癌细胞抵御化疗药物的杀伤作用。lncRNA SPINT1-AS1是近年来新发现的与肿瘤发生相关的lncRNA。Zhou et al[10]研究发现,lncRNA SPINT1-AS1在乳腺癌患者血清和乳腺癌细胞系中上调,lncRNA SPINT1-AS1敲低后乳腺癌细胞的增殖和迁移能力降低,其可能通过结合let-7促进乳腺癌进展。Li et al[12]研究发现,lncRNA SPINT1-AS1在结直肠癌组织中高表达,其与区域淋巴结转移、远处转移和较短的无复发生存时间相关,lncRNA SPINT1-AS1是结直肠癌患者的独立预后因素,同时在手术切除后的lncRNA SPINT1-AS1患者血清外泌体中观察到lncRNA SPINT1-AS1表达水平降低。lncRNA SPINT1-AS1是一种肿瘤促进因子。
本研究结果显示,lncRNA SPINT1-AS1在卵巢癌组织中的表达水平高于正常组织,在卵巢癌细胞系中的表达水平高于正常卵巢上皮细胞,表明lncRNA SPINT1-AS1在卵巢癌中可能发挥促癌功能,与上述的研究报道一致。本研究在SKOV-3细胞中转染si-SPINT1-AS1下调lncRNA SPINT1-AS1的表达水平,发现下调lncRNA SPINT1-AS1后SKOV-3细胞增殖活性和侵袭能力降低,同时SKOV-3细胞增殖表型蛋白PCNA、CyclinD1表达水平降低,SKOV-3细胞转移表型蛋白MMP2、MMP9表达水平降低,提示下调lncRNA SPINT1-AS1具有改善卵巢癌恶性增殖和侵袭的作用。
lncRNA发挥调节作用的方式是通过与微小RNA(miRNA)以碱基互补配对的方式进行结合,特异性下调miRNA的表达,从而调节细胞的各方面功能[5]。例如,SDHAP1通过与miR-4465相互作用影响卵巢癌细胞对紫杉醇的抗性[7]。本研究通过DIANA TOOLS数据库预测lncRNA SPINT1-AS1和miR-211-5p可能互为靶向关系,具有互补结合区域。miR-211-5p在乳头状甲状腺癌、膀胱癌、口腔鳞状细胞癌等很多恶性肿瘤中低表达,是一种肿瘤抑制因子[20]。miR-211-5p在卵巢癌中低表达,上调miR-211-5p能够抑制卵巢癌SKOV3细胞的增殖、细胞周期和细胞转移,促进SKOV3细胞凋亡,同时降低卵巢癌细胞对紫杉醇的耐药[13]。本研究结果表明,lncRNA SPINT1-AS1能够靶向结合miR-211-5p,且下调lncRNA SPINT1-AS1能够促进miR-211-5p的表达,表明lncRNA SPINT1-AS1作用机制与miR-211-5p有关。
综上所述,lncRNA SPINT1-AS1在卵巢癌组织和细胞系中高表达,下调lncRNA SPINT1-AS1可抑制卵巢癌SKOV-3细胞的增殖活性和侵袭能力,其机制与靶向促进miR-211-5p表达有关。本研究为lncRNA SPINT1-AS1在卵巢癌靶向治疗的应用研究提供了参考。

