NaOH 溶液脱绒对白羊草种子活力的影响
王 勃,王 菲,夏方山,董秋丽
(山西农业大学草业学院,山西 太谷 030801)
种子的主要用途即用于播种生产, 只有具有活力的种子才具备生产潜力, 而绒毛作为内因可以影响种子的活力水平[1]。 经过脱绒处理,种子活力得到明显提升,种子病虫害减少,与此同时,脱绒后种子间的附着情况减轻, 使机械播种更加方便[2],因此,对表面具有绒毛的种子进行脱绒处理具有重要意义。目前种子脱绒方法主要有机械脱绒和化学脱绒, 化学脱绒是现在研究中经常采用的种子脱绒处理方法, 通过化学试剂和种子上的绒毛充分接触,使绒毛碳化,从而达到脱绒效果[2-3]。化学脱绒相比于机械脱绒,操作步骤简单,脱绒效果好, 且对绒毛上的病菌和微生物有明显抑制作用。 机械脱绒过程中产生的摩擦会使种胚的子叶及胚根受到损害[4],而化学试剂脱绒可以通过调控溶液浓度和处理时间,减少对种胚的损伤[5]。 化学脱绒常用的试剂有浓盐酸 (hydrochloric acid,HCl)、 浓硫酸 (sulfuric acid,H2SO4) 及氢氧化钠(sodium hydroxide,NaOH)等。 目前,种子脱绒的研究 主 要 集 中 于 棉 花 (Gossypium spp.)[6]、 番 茄(Solanum lycopersicum)[7]以及部分一年生草本花卉[8]。张晓洁等[6]通过比较机械脱绒和化学脱绒的效果发现,硫酸脱绒后棉种发芽、出苗能力均得到提升。 夏方山等[9]通过化学脱绒处理发现,轻度盐酸浸种能有效提高白羊草种子的活力。 适宜浓度的NaOH 溶液处理也可提高嵩草(Kobresia myosuroides)[10]、结缕草(Zoysia japonica)[11]种子的发芽率。 然而,关于NaOH 处理对着毛种子活力影响方面的研究仍然有限, 其作为化学脱绒剂的研究与应用不足, 探究NaOH 对着毛种子活力的影响有利于其作为化学脱绒剂的广泛应用与科学推广。
白羊草(Bothriochloa ischaemum)是禾本科孔颖草属的多年生暖季型牧草, 具有易建植、 繁殖快、优质高产、耐牧、耐盐碱及固土保水等优点[9,12],主要在华北地区的低山丘陵与黄土高原的塬上生长发育,并作为当地的主要放牧草场[13]。国内外学者对白羊草形态特征[14-15]、营养价值[16-17]、群落生态学[18-19]及抗性[20-21]等方面进行研究,取得了诸多成效。 然而,白羊草种子细小,千粒重低(约0.65 g),且表面的绒毛相互粘连, 不仅限制了大规模的播种、收割等机械化操作,而且严重降低了种子利用率, 阻碍了白羊草产业的发展。 该试验通过探讨NaOH 溶液脱绒处理对白羊草种子活力的影响,以期为进一步研究其脱绒方法提供参考, 为白羊草种质资源的开发利用提供依据。
1 材料与方法
1.1 试验材料
山西农业大学草业学院驯化选育的“太行”白羊草种子。 种子于2017 年9 月采收,在自然条件下晾干,并于4 ℃冷库保存,于2019 年3 月进行试验。
1.2 种子脱绒处理
以白羊草种子为材料,利用NaOH 溶液(浓度设为10%、20%、30%、40%、50%,W/V) 分别处理1、5、10、15 min,每个处理设置4 次重复。 具体脱绒方法为:将0.25 g 白羊草种子完全浸没于50 mL不同浓度的NaOH 溶液中, 立即用直立搅拌器进行匀速搅拌, 使白羊草种子与NaOH 溶液充分接触, 浸种1、5、10、15 min 后迅速用纱网过滤出种子,并用蒸馏水冲洗5 次,以终止反应。 随后用滤纸吸干种子表层水分,并于25 ℃阴暗条件下自然风干至含水量10%(鲜重基础)。 以未经任何处理的白羊草种子为对照组(CK)。
1.3 发芽试验
从各个处理的白羊草种子中分别取100 粒置于铺有双层滤纸的培养皿中,参照《草种子检验规程发芽试验》(GB/T 2930.4—2017)[22],在恒温光照培养箱[控制条件:温度(25±0.5)℃、湿度30%~50%、光照8 h,黑暗16 h]进行标准发芽试验,以胚根突破种皮2 mm 时作为发芽, 每天统计发芽种子数,试验于第12 天结束, 测定其发芽率(germination percentage,Gp)、发芽指数(germination index,Gi)、平均发芽时间(mean germination time,MGT)和幼苗活力指数 (seedings vigor index,SVI)。 Gp、Gi、MGT 和SVI 的计算公式如下:

式(1)中,Gn 为12 d 内正常发芽种子数,N 为供试种子总数。

式(2)中,Gt 为第t 天发芽种子数,t 为发芽天数。
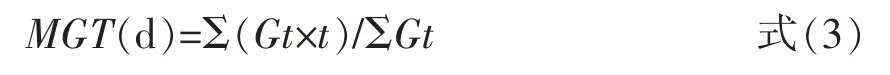
式(3)中,Gt 为第t 天发芽种子数,t 为发芽天数。
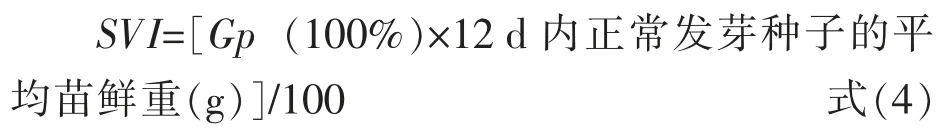
1.4 数据分析
采用Excel 2010 软件对试验数据进行初步整理。利用SPSS 22.0 统计学软件进行单因素方差分析和双因素方差分析。 NaOH 溶液脱绒后白羊草种子发芽指标的单因素方差分析及组间多重比较采用Duncan′s 法进行,P<0.01 表示差异极显著,P<0.05 表示差异显著,P>0.05 表示差异不显著。NaOH 溶液浓度和处理时间对白羊草种子萌发特性影响的双因素方差分析采用一般线性模型法。作图应用Origin 软件。 试验数据以“平均值±标准误”的形式表示。
2 结果与分析
2.1 NaOH 溶液脱绒对白羊草种子发芽率的影响
由图1 可知,脱绒时间为1~10 min 时,白羊草种子Gp 随着NaOH 溶液浓度的升高而升高;处理时间为15 min 时, 种子Gp 随NaOH 溶液浓度的升高先增后减。 脱绒时间为1 min 和5 min 时,种子Gp 在NaOH 溶液浓度为10%时显著 (P<0.05)低于其他处理浓度。 脱绒时间为15 min 时,种子Gp 在10%~30%的NaOH 溶液浓度范围内均显著(P<0.05)低于CK,浓度为40%、50%时显著(P<0.05)高于CK。 处理浓度为10%,时间在5~15min范围内,种子Gp 显著(P<0.05)低于CK。 20%~50%的NaOH 溶液浓度范围内,种子Gp 随脱绒时间的增加先升后降。 NaOH 溶液浓度为20%和30%对白羊草种子脱绒处理1 min 和5 min 时,种子Gp 均显著(P<0.05)高于CK,种子脱绒10 min和15 min 时显著(P<0.05)低于CK。 NaOH 溶液浓度为40%和50%, 种子Gp 在1~15 min 的脱绒时间内显著(P<0.05)高于CK。
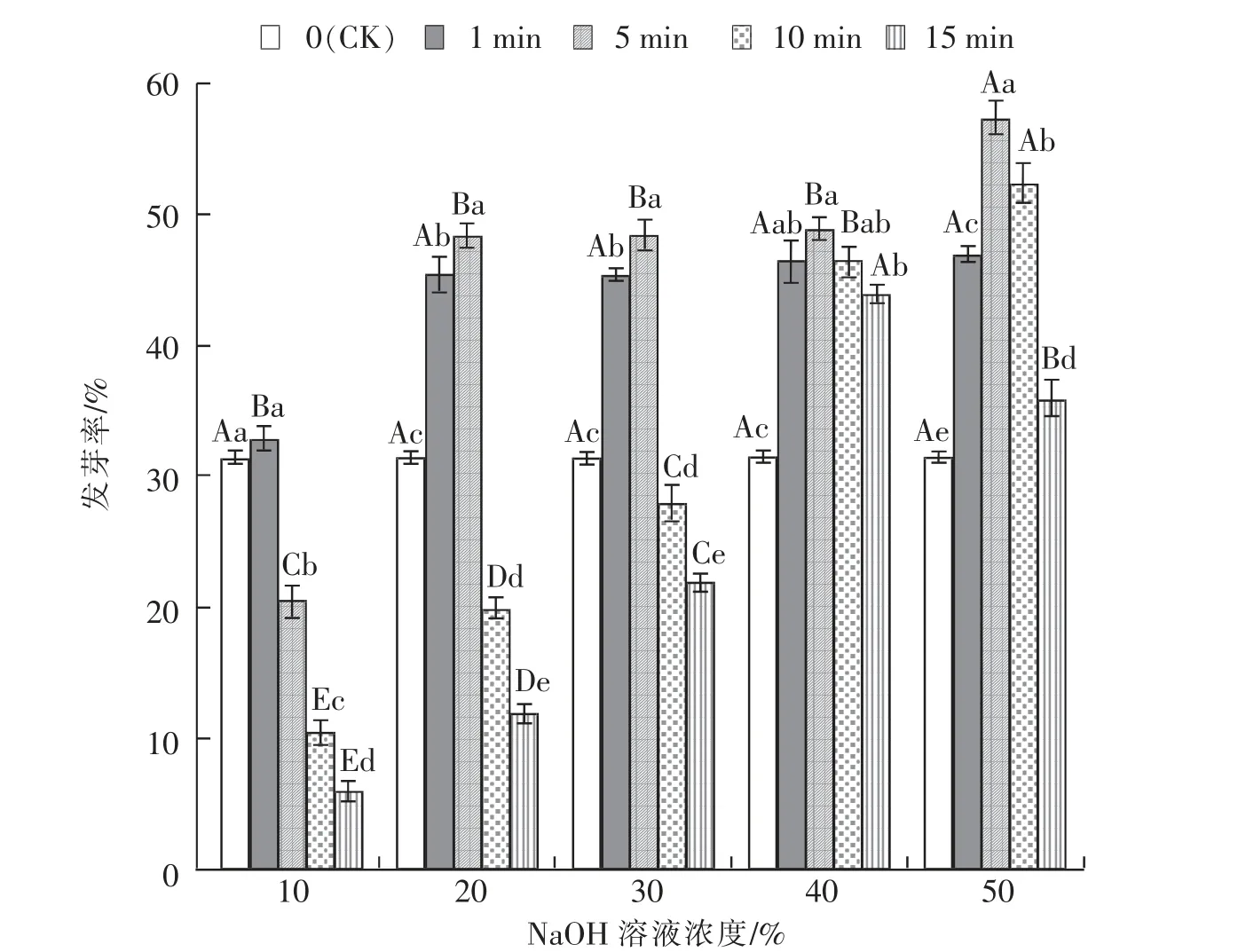
图1 NaOH 溶液不同浓度及不同时间处理下白羊草种子Gp 的变化
2.2 NaOH 溶液脱绒对白羊草种子发芽指数的影响
由图2 可知,NaOH 溶液处理时间为1~10 min时,白羊草种子Gi 随NaOH 溶液浓度的增加而增加;处理时间为15 min 时,种子Gi 随溶液浓度的增加先增后减。对白羊草种子脱绒处理10 min,种子Gi 在NaOH 溶液浓度为10%~30%时显著 (P<0.05)低于CK,在NaOH 溶液浓度为40%和50%时显著(P<0.05)高于CK。20%~50%的NaOH 溶液脱绒处理后, 种子Gi 随处理时间的增加先增后减。 NaOH 溶液浓度为10%时,种子Gi 随脱绒时间的增加而降低,在1~15 min 时间范围内种子Gi均显著(P<0.05)低于CK。 20%和30%的浓度处理时, 白羊草种子脱绒处理1 min 和5 min 时Gi 显著(P<0.05)高于CK。 40%的浓度处理时,白羊草种子脱绒处理1~15 min 时Gi 均显著(P<0.05)高于CK。 50%的浓度处理时,白羊草种子脱绒处理1~10 min 时Gi 显著(P<0.05)高于CK。

图2 NaOH 溶液不同浓度及不同时间处理下白羊草种子Gi 的变化
2.3 NaOH 溶液脱绒对白羊草种子平均发芽时间的影响
由图3 可知, 处理时间在1~15 min 范围内,白羊草种子经10%的NaOH 溶液脱绒后MGT 显著(P<0.05)高于其他浓度。 脱绒时间为1 min 和5 min, 种子MGT 在20%~40%的NaOH 溶液浓度范围间差异均不显著(P>0.05),但在NaOH 溶液浓度为50%时MGT 显著(P<0.05)下降。 脱绒时间为10 min,NaOH 溶液浓度为50%时种子MGT 显著(P<0.05)低于其他浓度。 脱绒时间为15 min,NaOH 溶液浓度为40%时种子MGT 显著(P<0.05)低于其他浓度。 NaOH 溶液浓度相同时,经过脱绒的白羊草种子MGT 均显著(P<0.05)高于CK。
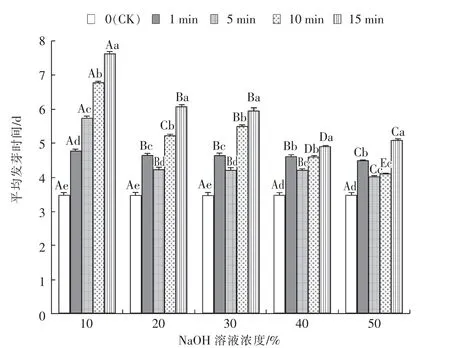
图3 NaOH 溶液不同浓度及不同时间处理下白羊草种子MGT 的变化
2.4 NaOH 溶液脱绒对白羊草种子幼苗活力指数的影响
由图4 可知, 时间为1~10 min, 经50%的NaOH 溶液脱绒后白羊草种子SVI 均显著 (P<0.05)高于其他浓度,但当处理时间为15 min 时,脱绒后种子SVI 在NaOH 溶液浓度为40%达到最大值0.039 5。 处理时间为1 min 和10 min 时,种子SVI 随着NaOH 溶液浓度增加显著(P<0.05)增加。 白羊草种子脱绒5 min 时,种子SVI 在NaOH溶液浓度为20%和40%时差异不显著 (P>0.05)。处理时间为15 min 时,种子SVI 随着NaOH 溶液浓度增加呈先上升后下降的趋势, 在40%浓度下显著(P<0.05)高于其他浓度。 溶液浓度为10%时,白羊草种子SVI 在1~15 min 处理时显著(P<0.05)低于CK。用20%和30%的NaOH 溶液对白羊草种子进行脱绒,SVI 在1 min 和5 min 的脱绒时间时均显著(P<0.05)高于CK,而在10 min 和15 min的脱绒时间时显著(P<0.05)低于CK。 用40%和50%的NaOH 溶液对白羊草种子进行脱绒后,SVI均显著(P<0.05)高于CK。
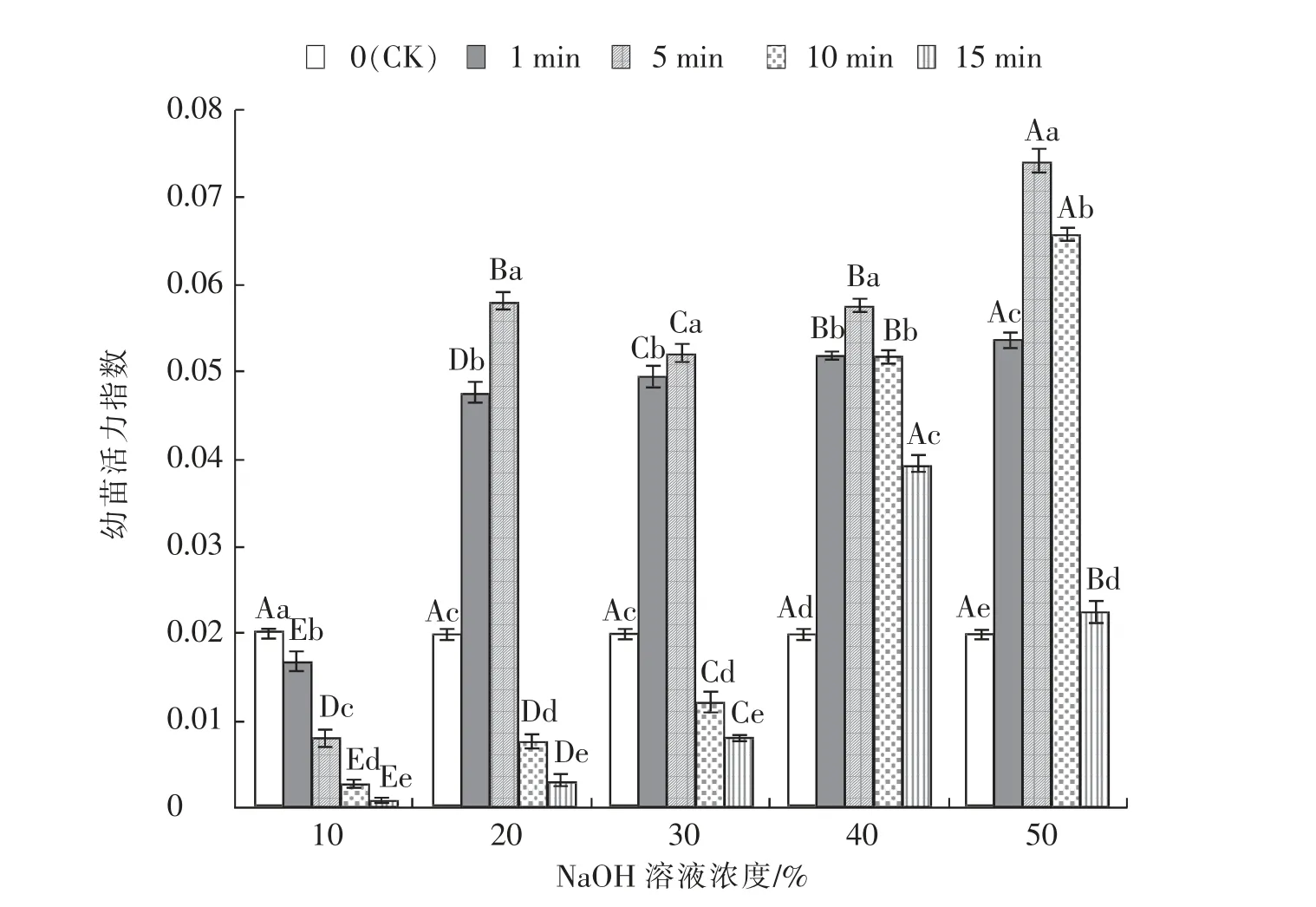
图4 NaOH 溶液不同浓度及不同时间处理下白羊草种子SVI 的变化
2.5 NaOH 溶液脱绒后白羊草种子活力的双因素方差分析
由表1 可知,NaOH 溶液浓度、处理时间以及两者的交互作用对白羊草种子的Gp、MGT、Gi 和SVI 影响均达到了极显著(P<0.01)水平。
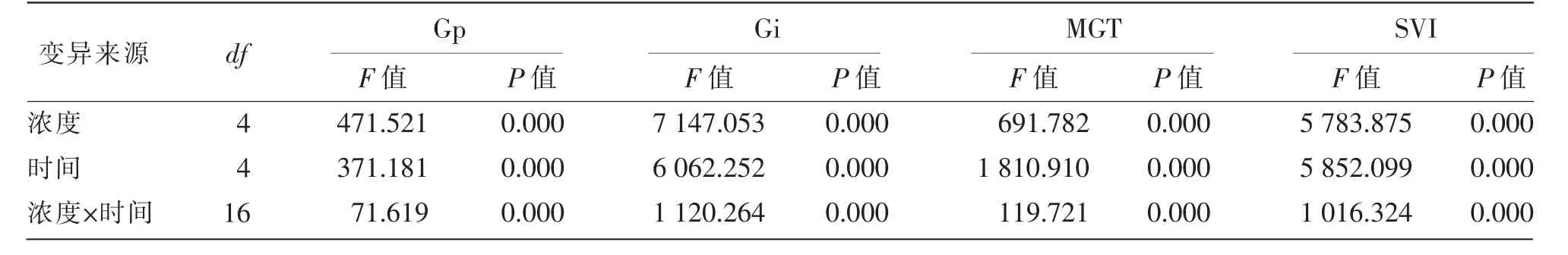
表1 不同浓度NaOH 溶液不同时间处理对白羊草种子活力影响的双因素方差分析
3 讨论
强碱处理可以使种子表面的绒毛发生碳化,减轻种子之间的相互粘连, 并能有效减少病害的发生。 脱绒虽能减轻植物种子因绒毛造成的相互粘连,但也对植物种子活力产生了影响[9,23-24],强碱处理也可对种子活力产生影响。 在该试验中,NaOH 溶液浓度对白羊草种子发芽率、发芽指数、平均发芽时间、 幼苗活力指数的影响差异极显著(P<0.01), 经过NaOH 溶液处理后的白羊草种子活力随处理时间和溶液浓度的升高而升高。 试验发现,NaOH 溶液浓度为40%和50%, 种子Gp 在1~15 min 的脱绒时间内均显著(P<0.05)高于CK。张国云等[10]对6 种嵩草的研究也表明, 随着NaOH 溶液浓度的升高,各种嵩草种子Gp 均有明显提高, 通过对处理后种子进行电镜观察分析得出,NaOH 溶液处理嵩草种子,可能破坏了种子角质层,增大了种皮细胞间隙,有利于嵩草种子与外部之间的物质交流,从而使得嵩草Gp 提高。 该研究很大程度上揭示了处理时间相同时, 种子萌发能力随NaOH 溶液浓度的升高而升高的原因。 也有研究认为NaOH 之所以可以促进嵩草种子萌发是因为它可以降低种皮抑制物内源脱落酸含量[25]。白羊草种子经NaOH 溶液处理后,其种子表面绒毛逐步脱落, 在NaOH 溶液浓度为40%和50%时,其种子MGT 随处理时间增加呈先降后升的趋势,种子Gi、SVI 随处理时间的增加呈先升后降的趋势, 其原因可能是在白羊草脱绒过程中,NaOH 溶液浓度和处理时间的增加对其种子造成一定程度的损伤, 但NaOH 溶液并没有破坏种皮从而促进白羊草种子发芽。
该试验的双因素方差分析也表明NaOH 溶液浓度、 处理时间以及两者的交互作用对白羊草种子的Gp、MGT、Gi 和SVI 影响均达到了极显著(P<0.01)水平。 高浓度及长时间的碱处理会降低白羊草种子活力, 可能是因为两者的累积会对种胚造成破坏,从而降低其种子活力。 该试验发现,白羊草种子MGT 在50%浓度处理5 min 时较其他处理最低,此时白羊草种子Gp、Gi 及SVI 也最高,然而白羊草种子平均发芽时间随NaOH 溶液浓度的增加呈下降趋势, 这说明适宜浓度的NaOH 溶液处理降低了白羊草种子的萌发时间, 这可能由于NaOH 溶液处理会改变白羊草种子内部的角质层, 轻微改变会有利于其萌发前及萌发代谢活动的发生。因此,运用NaOH 溶液对白羊草种子进行脱绒处理时, 必须要注意平衡白羊草种子活力及脱绒效果之间的关系。
4 结论
NaOH 溶液浓度及处理时间均对白羊草种子活力具有极显著影响, 适宜浓度的NaOH 溶液浸种能有效脱去白羊草种子表面的绒毛,提高白羊草种子的活力。浓度为50%的NaOH 溶液浸种5 min对白羊草种子活力的提升效果最好。

