光质对小球藻(Chlorella sorokiniana)生长和代谢机制的调控
甘钰华,魏 群,马湘蒙,李忠棠,靳元容,李淑媛
光质对小球藻(Chlorella sorokiniana)生长和代谢机制的调控
甘钰华,魏 群*,马湘蒙,李忠棠,靳元容,李淑媛
(广西大学资源环境与材料学院,广西 南宁 530004)
为研究光质对小球藻()生长和代谢机制的影响,分析了不同光质下的生长情况,利用Illumina平台进行转录组测序.结果表明:红、蓝光是生长的有效光质,红、蓝光培养7d后藻细胞密度分别比白光对照组的高52.96%和61.11%.在不同光质下具有独特的生理特性,蓝光组Chl a、Chl b和Car最高,分别为(17.84±0.26), (8.39±0.19), (6.04±0.08) mg/L;红光培养7d后微藻的碳水化合物和脂质含量最高,分别达到了(115.60±1.81) μg/mg和(18.64±0.54)%.通过转录组测序分析,不同光质下的基因表达存在差异,红光下碳酸酐酶、乙酰辅酶A羧化酶和脂肪酸合成酶的基因表达量较高,差异表达的基因大部分参与了脂肪酸合成和碳固定过程;蓝光下RubisCO酶的基因表达量最高且光合系统中富集的差异基因均上调表达,光合速率和碳固定速率最快;绿光下微藻大部分的基因表达量较低,新陈代谢潜能较差;白光下的TCA循环活跃,不利于储存碳水化合物和脂质.
光质;小球藻;生长;代谢;基因;高通量测序
微藻作为光氧生物,光质可以刺激藻细胞改变自身的代谢模式以适应环境的变化,从而改变微藻的细胞代谢产物[1-2].在分子水平上,光质会影响光合生物的基因表达水平[3],不同的光质下微藻的酶活性和细胞化学组成均会发生改变[4-6],从而调控微藻的细胞周期和光合作用等生理活动.迄今为止,关于光质对微藻影响的研究重点主要集中在利用光质诱导藻细胞合成某种特定的代谢产物[7-11],或者研究光质组合对微藻生长的影响[12-15],优化微藻培养过程中的光质参数,提高微藻生物量和具有经济效益的化合物产量[16-17].事实上,光质对于微藻的影响存在物种特异性,即每种微藻在不同的照明条件下都会有适合其生长的最佳光质[7],而关于光质对微藻的具体的代谢调控机理还有待深入探究.本研究以红色、蓝色和绿色LED作为单色光光源培养小球藻(),白色LED为对照光源,分析不同光质下的细胞密度、光合色素浓度、碳水化合物和脂质含量的变化情况,并利用Illumina Novaseq 6000测序平台对在不同光质下培养4d的进行转录组测序.通过转录组学分析揭示代谢途径的关键差异基因,结合微藻在不同光质下的生理特性变化,明确响应不同光质的代谢机制,为后续选择合适的光质培养微藻提供一定的理论参考.
1 材料与方法
1.1 实验材料
藻种:购自中国科学院水生生物研究所(武汉),藻株编号为FACHB-2900.
LED光源:红色、蓝色、绿色和白色LED灯带(长10m、宽80mm),功率为1.5~8.5W.蓝光的::= 0:14.4:85.6,峰值波长为460nm;绿光的::=0.3: 98.0:1.7,峰值波长分别为511nm.红光的::=96.5: 3.5:0,峰值波长为633nm;白光由红绿蓝光按::= 18.1:68.6:13.3比例混合而成,其峰值波长包括465, 514和630nm.
培养基:BG-11培养基[18].
1.2 实验设计
1.2.1 单色光对生长的影响 将藻液在室温下以4000r/min离心10min,重复用纯水洗涤离心沉淀物3次.将和配制好的BG-11培养基混合在5L反应器中,培养基体积为3L,初始pH值调整为7.00±0.02.光源设置为单色光组(红色、蓝色和绿色)和白光对照组.用气泵以3L/min的速度供应空气用于微藻生长.在(25±1)℃和50μmol/(m2·s)条件下进行7d的实验.测定指标为:藻细胞密度、光合色素浓度、碳水化合物和脂质含量.
1.2.2 单色光下的转录学研究 委托上海美吉生物医药科技有限公司完成的测序实验步骤.第4d的微藻已经适应光源条件且对营养物质的摄取处于快速利用的阶段,选用该时间点的微藻进行研究.鉴于目前的参考基因组注释信息尚不明确,因此选择进行无参考基因组的转录组研究,测序完成后对数据进行交互分析.测序数据已提交到NCBI的SRA数据库中,登录号为SRR17697914、SRR17697915、SRR17697916、SRR17697917.
1.3 指标检测方法
藻细胞密度:用血球计数板进行显微镜计数.在血球计数板的计数区中盖上盖玻片,在盖玻片两端各加入10μL藻液(藻液OD680³0.5时需要用超纯水稀释至0.5以下),静置片刻,待微藻细胞布满计数室.使用连接有摄像头的显微镜在10×10倍数下进行拍摄,拍摄范围约为320格.每组样品需拍摄4次.使用Image J软件处理图片得到count值,微藻细胞数目=(count值/320)×400×稀释倍数×10000.
光合色素:参考文献[19]的方法进行测量.取5mL微藻悬浮液于10mL离心管,以4000r/min离心10min后用无菌注射器小心弃去上清液,保留离心管底部的藻泥.往离心管中加入5mL 90%丙酮后置于冰浴中用细胞破碎仪处理5min.在4℃的黑暗环境中静置5h后以4000r/min离心10min,在450, 630, 664, 647, 750nm处,以90%丙酮作为空白参比,测量上清液的吸光度.
叶绿素a(Chl a)和叶绿素b(Chl b)的浓度分别根据式(1)和(2)[20]计算:
Chl a=11.85(664-750)-1.54(647-750)-
0.08(630-750) (1)
Chl b=21.03(647-750)-5.43(664-750)-
2.66(630-750) (2)
参考公式(3)[21]计算类胡萝卜素(Car)的浓度(mg/L):
Car=450×10000/2500 (3)
脂质:采用改良的氯仿-甲醇溶剂提取法[22-23].精确称量藻粉并记录每组样品的质量(D)后转入50mL离心管中,往离心管中加15mL氯仿/甲醇(2:1)溶液和150μL HCl溶液(1mol/L).将离心管横置于摇床震荡 3h后加入5mL 0.9%的NaCl溶液,旋涡混合均匀后在8000r/min下离心10min.用无菌注射器抽取下层的有机相至已预先称重的锡纸盘内.在通风橱的电热板中以80℃干燥锡纸盘至有机溶剂完全挥发,锡纸盘前后的质量差即为微藻的脂质产量(L).微藻脂质产量与藻粉的质量比值即微藻的脂质含量.
lipid=L/D×100% (4)
式中:lipid是微藻脂质含量, %;L为第天的微藻脂质产量, g;D为藻粉的质量, g.
碳水化合物:利用HPAEC-PAD进行测定[24],精确称量(5±0.05) mg藻粉于干净的色谱瓶中,加入1mL 2mol/L TFA酸溶液,在105℃下加热6h后氮气吹干,加入甲醇重复清洗吹干2~3次.加入无菌水溶解,转入色谱瓶中待测.采用Thermo ICS5000离子色谱系统(ICS5000,Thermo Fisher Scientific,USA)和Dionex™ CarboPac™ PA20(150´3.0mm,10μm)液相色谱柱;进样量为5μL.流动相A(0.1mol/L NaOH),流动相B(0.1mol/L NaOH,0.2mol/L NaAc),流速0.5mL/min;柱温为30℃;洗脱梯度:0min A相/B相(95:5/),30min A相/B相(80:20/),30.1min A相/B相(60:40/),45min A相/B相(60:40/),45.1min A相/B相(95:5/),60min A相/B相(95:5/).
1.4 数据处理
数据结果表示为平均值±标准偏差,使用IBM SPSS Statistics 26进行单因素方差(ANOVA)分析,Tukey’HSD进行事后多重比较检验,在95%的显著性水平上评估结果的统计学意义(<0.05).
对于没有生物学重复的基因组测序,对4个样品(红光、蓝光、绿光和白光组)的raw counts进行基于TMM(Trimmed Mean of M-values,M-值的加权截尾均值)方法的标准化,然后利用DEGseq软件进行组间差异表达分析.为了控制整体推断结果发生错误的概率或频次,对统计检验获得的-value利用BH(FDR correction with Benjamini & Hochberg,Benjamini & Hochberg法控制错误发现率)进行多重检验矫正,矫正后的-value即为-adjust.利用RSEM软件,根据基因的表达量FPKM值计算出单色光培养/白光培养的FC(Fold change,差异倍数)进行差异分析.满足|log2FC|³1 &-adjust<0.05筛选条件的基因视为差异表达基因(DEGs).KEGG代谢通路使用Fisher 精确检验,当-adjust<0.05时,认为此KEGG通路在基因集中显著富集.本文所描述的基因上下调表达规律,均表示单色光(红光、蓝光和绿光)相较于白光中的同种转录变化情况.
2 结果与讨论
2.1 单色光对C. sorokiniana生长的影响
2.1.1 藻细胞密度 如图1所示,初始藻细胞密度为(0.79±0.03)×107cells/mL.根据单因素方差分析和Tukey’HSD检验,红光下的藻细胞密度与绿光和白光均存在显著性差异(<0.05),与蓝光下获得的藻细胞密度之间无显著性差异.结果表明:能迅速适应红光和蓝光环境,细胞生长速率明显比绿光和白光下的高(表1),表明与其它波长相比,红光和蓝光是适合生长的光质.这与一些学者的研究结果相似,Alboresi等[4]、Fan等[25]和唐青青等[26]的研究发现微藻的叶绿素更倾向于吸收红色或蓝色光子,虽然这些学者的研究对象为不同的微藻,但结果均表明了微藻在红光或蓝光中的生长情况较好,获得了较高的生物量.

图1 不同光质下小球藻的细胞密度

表1 不同光质下小球藻的比生长速率
注:1和2为前3d和前7d的比生长速率.
红光下微藻前期的生长速率最高,微藻细胞密度比蓝光大,可能是因为短期内红光促进了微藻分裂.丙酮酸脱氢酶参与的糖酵解过程可提供磷酸核糖和能量参与核酸的生物合成[27].红光下参与丙酮酸脱氢酶的基因(Gene id:TRINITY_DN29677_ c0_g1)表达量最高(图4),微藻细胞合成核酸的生化反应比蓝光、绿光和白光更为迅速,即短期的红光培养在一定程度上促进了的分裂繁殖.这与Kim等[1]的研究结论相似,他们在研究报告中指出红光有利于进行细胞分裂并提高生物量生产率.相反的是,在培养后期蓝光下的藻细胞浓度增长比红光快,这是因为红光的波长较长,光子能量较低,随着反应器中微藻浓度增大,红光光子较难穿透到反应器中部,所以在培养后期,红光下的微藻光合作用不如蓝光活跃.在第7d红、蓝光的藻细胞密度分别达到(4.13±0.39)×107和(4.35± 0.45)×107cells/mL,红光组和蓝光组的藻细胞密度分别比白光对照组的高52.96%和61.11%.
2.1.2 光合色素 如图2所示,实验结束时,蓝光组的Chl a、Chl b和Car浓度分别为(17.84±0.26), (8.39±0.19), (6.04±0.08) mg/L;红光组的Chl a、Chl b和Car浓度分别为(14.16±0.37), (4.65±0.19), (5.09± 0.11) mg/L;绿光组的Chl a、Chl b和Car浓度分别为(10.91±0.34), (4.40±0.08), (3.99±0.10) mg/L;白光组的Chl a、Chl b和Car浓度分别为(12.60±0.56), (5.37±0.23), (4.56±0.23) mg/L.在培养初期(第1~3d)和末期(第6~7d),绿光组的光合色素浓度均较低,但在培养中期(第4~5d),绿光组的光合色素浓度逐渐增加,在第5d的时候Chl a、Chl b和Car浓度最高达到了(17.60±0.48), (8.61±0.44), (5.98±0.14) mg/L.
蓝光下的光合色素浓度比红光的高.这与Vadiveloo等[17]和Kim等[1]的研究结果相似.相关研究发现微藻细胞的光合色素决定了大部分微藻是倾向于利用红光和蓝光光子[28-29].结合图5分析可知,红光下参与合成细胞色素b6/f复合体的基因表达水平下调,而蓝光下参与合成细胞色素b6/f复合体的基因表达水平上调,意味着的光合色素倾向于捕获蓝光光子.
绿光LED的::=0.3:98.0:1.7,绿光的光谱范围中左侧有一部分与蓝光重叠,光谱右侧有一部分与红光重叠,大部分绿光被反射而不能被吸收,因此在接入绿光培养的初期,微藻的光合色素浓度并没有显著改变,在此阶段微藻利用原有的储存在细胞内的能量物质进行生长繁殖,导致的碳水化合物浓度有所下降(图3).在绿光培养的中期,微藻细胞中储存的碳水化合物已经不足以提供其维持正常的生理活动,为了适应绿光的胁迫环境,需要合成更多可以吸收绿光中与红蓝光重叠光谱的光合色素,以进行光合作用合成能量物质,结合图5c分析可知,绿光下参与合成细胞色素b6/f复合体的基因表达水平上调,因此绿光培养中期的光合色素浓度迅速增加.在绿光培养的末期,可能是由于长时间的绿光胁迫加速了的衰亡期的到来,微藻的光合色素浓度有所下降,且下降幅度较其它3个光质组的大.
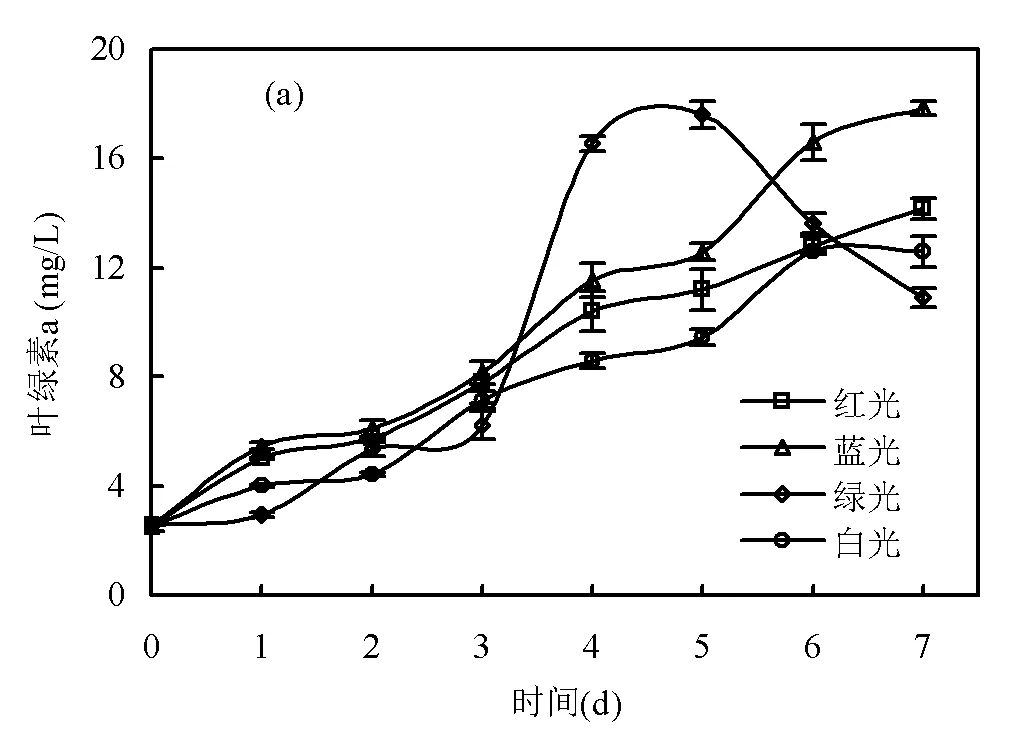
(a) 叶绿素 a; (b) 叶绿素 b; (c) 类胡萝卜素
2.1.3 碳水化合物含量和脂质含量 各组的碳水化合物和脂质含量初始值为(72.88±0.11) μg/mg和(5.96±0.36)%.如图3所示,在培养初期,红光下的分解碳水化合物提供细胞分裂所需的磷酸核糖和能量,所以在红光下培养3d后的碳水化合物含量和脂质含量均比蓝光低,但红光培养7d后的碳水化合物含量和脂质含量均最高,分别达到了(115.60±1.81) μg/mg和(18.64±0.54)%.这是因为红光下固定CO2的碳酸酐酶(Gene id:TRINITY_DN442_c0_g5)的基因表达量比蓝光下的高,合成脂肪酸的乙酰辅酶A羧化酶(Gene id:TRINITY_DN25174_c0_g1)和脂肪酸合成酶(Gene id:TRINITY_DN16349_c0_g2)的基因表达量(图4)也比蓝光下的高,即表明红光下的合成碳水化合物和脂质等能量物质的生化过程比蓝光的活跃.同时,参与TCA循环的丙酮酸羧化酶(Gene id:TRINITY_DN10107_c0_g1)和磷酸戊糖途径的葡萄糖-6-磷酸脱氢酶(Gene id: TRINITY_DN24821_c0_g1)的基因表达量比蓝光的低,表明红光下分解碳水化合物的生化过程比蓝光缓慢.因此在培养末期,红光下的碳水化合物含量和脂质含量比蓝光的高.在许多学者的研究中均有红光刺激微藻合成碳水化合物的结论[30-34].此外,在许多学者的研究中也得到了红光促进微藻脂质合成的结论[35-38].
在绿光下生长7d后[(70.76±1.13) μg/mg]的碳水化合物含量比培养3d后[(65.67±1.88) μg/mg]的含量低.相反,绿光下生长7d后(9.16%)的脂质含量比培养3d后(7.80%)的高.结合图4来看,这是因为绿光下的脂肪酸合成过程和磷酸戊糖途径比较活跃.绿光下参与合成脂肪酸的乙酰辅酶A羧化酶(Gene id:TRINITY_DN18846_ c0_g1;TRINITY_DN18846_c0_g3;TRINITY_DN23484_c0_g1)的基因表达量较高,参与磷酸戊糖途径的葡萄糖-6-磷酸脱氢酶(Gene id: TRINITY_ DN24821_c0_g1)和参与TCA循环的丙酮酸羧化酶(Gene id:TRINITY_DN10107_c0_g1)的基因表达量均较高,表明绿光下微藻细胞一方面分解碳水化合物维持细胞正常的生理活动,另一方面积累脂质应对绿光的胁迫环境.在Ra等[39]和Das等[40]的研究报告中也提到了短期的绿光胁迫有助于提高微藻的脂质含量.
在白光下培养3d后的的碳水化合物含量和脂质含量与培养7d后的相比没有明显增加.结合图4分析,白光下参与糖异生过程的磷酸烯醇式丙酮酸羧激酶(Gene id:TRINITY_DN5136_ c0_g1;TRINITY_DN21219_c0_g1;TRINITY_DN1384_c0_g1)的基因表达量较高;参与TCA循环的异柠檬酸脱氢酶(Gene id:TRINITY_DN5047_c0_g1; TRINITY_DN18028_c0_g1)、酮戊二酸脱氢酶(Gene id:TRINITY_DN11395_c0_g1)、琥珀酸脱氢酶(Gene id:TRINITY_DN25148_c0_g1)和柠檬酸合酶(Gene id:TRINITY_DN9140_c0_g1;TRINITY_DN7537_c0_g1;TRINITY_DN30503_c0_g1)的基因表达量也较高.综上分析可知白光下合成有机物与分解有机物的生化过程均比较活跃,不利于微藻积累大分子有机物.这可能是因为白色LED光源中包含了红蓝绿光,白光表现出红蓝绿光质的混合效应[41].

图3 不同光质下小球藻的碳水化合物和脂质含量
2.2 单色光下C. sorokiniana小球藻转录学分析
2.2.1 DEGs的聚类热图 如图4所示,筛选的基因参与的生化过程主要包括:TCA循环、糖酵解和糖异生过程、磷酸戊糖途径、类胡萝卜素合成、碳固定、氮代谢以及脂肪酸合成.不同光质下培养的的代谢通路存在较大的差异,红光下的差异表达基因大部分参与了脂肪酸的合成和碳固定过程.蓝光引起的差异基因表达则集中在TCA循环、磷酸戊糖途径和碳固定过程.相较于其它光质来说,绿光下培养的微藻的基因表达量最低.白光下微藻差异表达的基因主要参与TCA循环、糖酵解和糖异生过程.
2.2.2 光合作用代谢通路 为了研究光合作用相关基因表达的变化情况,分析了微藻细胞在不同光质下生长4d后的转录水平,并与白光培养的微藻细胞的转录水平进行了对比.对红光组和白光组的差异基因集进行KEGG功能富集分析,光合作用变化情况如图5a所示.光系统Ⅱ(PhotosystemⅡ,PSⅡ)中(Psa C、Psa P、Psa Y和Psb 28)、光合电子传输中(Pet H)和F型ATP酶(F-type ATPase)中(alpha)的基因上调表达,表明红光在一定程度上可以促进PSⅡ水的光解和O2的释放.此外,通过细胞色素b6/f复合体在PSⅠ和PSⅡ之间进行电子传递,将光能转化为跨膜质子梯度,用于ATP合成[42-43].而红光下的细胞色素b6/f复合体中(Pet C)基因表达水平下调,长时间在红光培养可能会降低藻细胞的电子转移速率和ATP合成速率.综合比较来说,红光并不是进行光合作用的最佳光源.

图4 不同光质下小球藻差异表达unigene的聚类热图
图中每列表示一个样本(WHITE、RED、BLUE和GREEN分别代表白光、红光、蓝光和绿光),每行表示一个unigene,图中的颜色表示unigene在该样本中表达量的高低,红色代表unigene在样本中表达量较高,蓝色代表unigene的表达量较低对蓝光组和白光组的差异基因集进行KEGG功能富集分析,光合作用代谢通路变化情况如图5b所示.蓝光明显促进了的光合作用,无论是光合系统(PSⅠ和PSⅡ)还是细胞色素b6/f复合体中,富集的差异基因均上调表达.Kim等[1]在研究报告中指出蓝光下参与PSⅡ的基因表达增加.通过对比图5中与PSⅡ相关的基因表达情况发现,图5b中(即蓝光)PSⅡ的上调表达的基因最多,这与Kim等[1]的研究结果一致.此外,蓝光下RubisCO酶(Gene id:TRINITY_DN20432_c0_g1;TRINITY_DN7040_c0_g1) 的基因表达量最高(图4),该酶是碳固定过程必不可少的酶[44],表明蓝光的碳固定速率比红光和绿光快. Olga等[45]发现蓝光促进了RubisCO酶的合成,提高了CO2的固定速率.Kim等[1]认为蓝光可能激活RubisCO酶,与本研究结果一致.
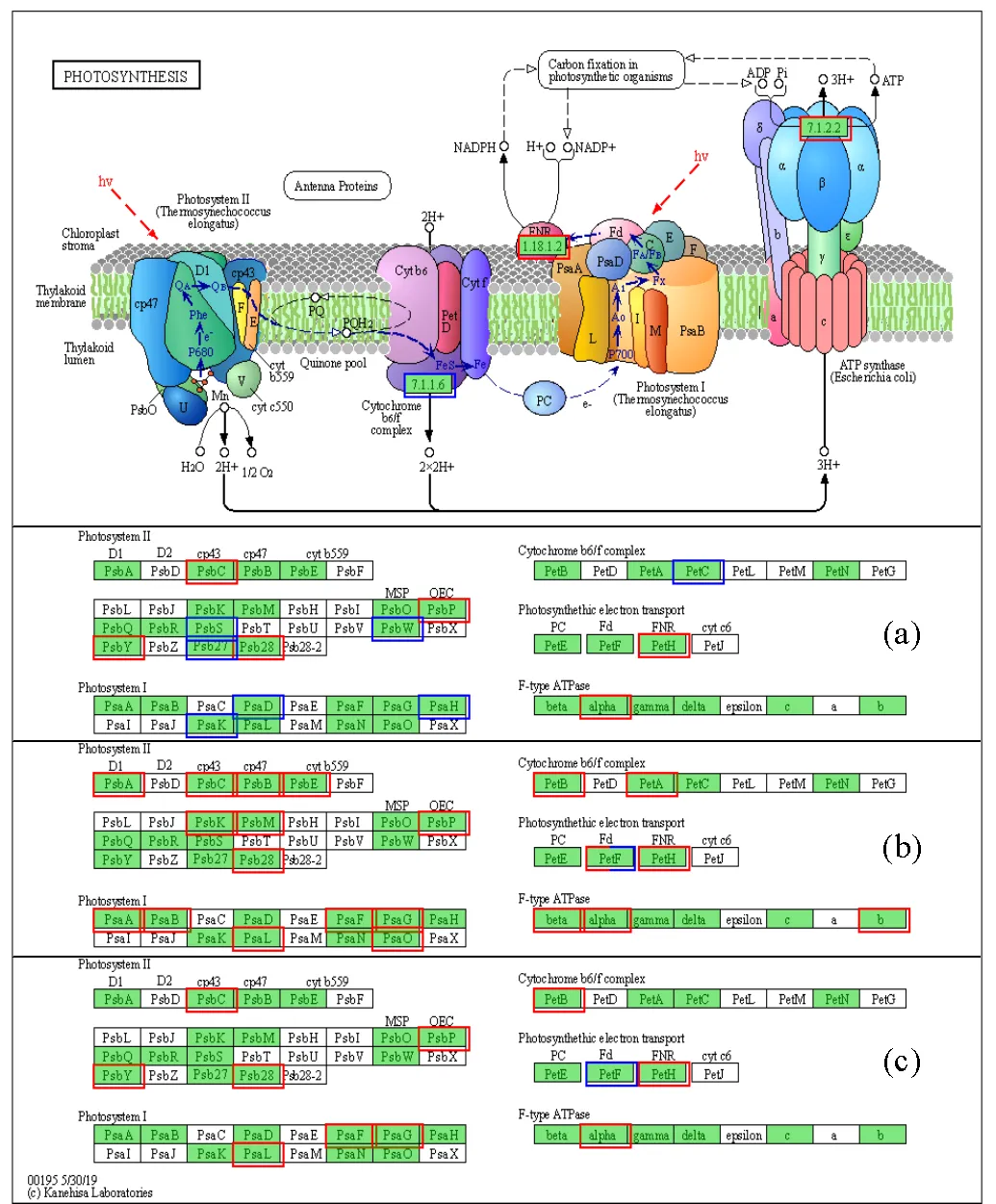
图5 不同光质下小球藻的光合作用代谢通路
a、b、c分别为红光、蓝光、绿光的差异基因表达情况;长方形绿色方框代表显著差异表达的基因注释到的ko节点;方框内的数字/字母表示酶的EC编号;红框对应表达量上调的基因,蓝框对应表达量下调的基因,红蓝框对应既有上调又有下调的基因
对绿光组和白光组的差异基因集进行KEGG功能富集分析,通路变化情况如图5c所示.除了光合电子传输中(Pet F)下调表达外,其它显著富集的基因均上调表达,绿光中参与光合作用的上调表达的基因比红光的多但较蓝光的少,说明绿光不如蓝光被微藻吸收利用的程度大,光合作用速率较蓝光缓慢.绿光下的细胞色素b6/f复合体中Pet B上调表达,表明绿光下的为了进行光合作用维持细胞正常的代谢,微藻在绿光胁迫下合成更高浓度的光合色素.
3 结论
3.1 红、蓝光是生长的有效光质.在实验结束的时候,红光组和蓝光组的藻细胞密度分别达到(4.13±0.39)×107和(4.35±0.45)×107cells/mL,红光组和蓝光组的藻细胞密度分别比白光对照组的高52.96%和61.11%.
3.2在不同光质下具有独特的生理特性.蓝光组的Chl a、Chl b和Car浓度最高,分别为(17.84±0.26), (8.39±0.19), (6.04±0.08) mg/L.微藻细胞需要合成更多可以吸收绿光中与红蓝光重叠光谱的光合色素来应对绿光的胁迫,但长时间的胁迫会加速微藻衰亡期的到来,降低藻细胞内的光合色素浓度.红光促进微藻积累碳水化合物和脂质,在红光下培养7d后微藻的碳水化合物含量和脂质含量均最高,分别达到了(115.60±1.81)μg/mg和(18.64± 0.54)%.
3.3 不同光质下培养的的基因存在表达差异.红光下微藻差异表达的基因大部分参与了脂肪酸的合成和碳固定过程.蓝光下微藻的TCA循环、磷酸戊糖途径和碳固定过程较为活跃.白光下微藻的TCA循环很活跃,无法储存能量物质.相比之下,绿光微藻的大部分基因表达量较低,新陈代谢潜能较差.
3.4 蓝光明显促进了的光合作用.无论是光合系统(PSⅠ和PSⅡ)还是细胞色素b6/f复合体中,富集的差异基因均上调表达,与其它光质组相比,光合速率和碳固定速率最快.
[1] Kim D G, Lee C S, Park S M, et al. Manipulation of light wavelength at appropriate growth stage to enhance biomass productivity and fatty acid methyl ester yield using[J]. Bioresource Technology, 2014,159:240-248.
[2] Yoshifumi U, Shimpei A, Akihiko K, et al. Adaptation of light- harvesting functions of unicellular green algae to different light qualities [J]. Photosynthesis Research, 2018,139(1-3):145-154.
[3] 李 莹,吴兴杰,贺治斌,等.宏转录组学在环境微生物生态学中的应用[J]. 中国环境科学, 2021,41(9):4341-4348.
Li Y, Wu X J, He Z B, et al.Application of metatranscriptomics in environmental microbial ecology [J]. China Environmental Science, 2021,41(9):4341-4348.
[4] Alboresi A, Perin G, Vitulo N, et al. Light remodels lipid bio-synthesis inmodulating carbon partitioning between organelles [J]. Plant Physiology, 2016,171(4):2468-2482.
[5] Mehmet T, Meric D U, Ibrahim B, et al. RNA-seq analysis of the transcriptional response to blue and red light in the extremophilic red alga,[J]. Functional & integrative genomics, 2016,16(6):657-669.
[6] Ra C H, Sirisuk P, Jung J H, et al. Effects of light-emitting diode (LED) with a mixture of wavelengths on the growth and lipid content of microalgae [J]. Bioprocess and Biosystems Engineering, 2018,41(4): 457-465.
[7] Shu C H, Tsai C C, Liao W H, et al. Effects of light quality on the accumulation of oil in a mixed culture ofsp. and[J]. Journal of Chemical Technology & Biotechnology, 2012,87(5):601-607.
[8] Hwang J H, Maier N. Effects of LED-controlled spatially-averaged light intensity and wavelength ongrowth and lipid composition [J]. Algal Research, 2019,41:101573.
[9] Jung J H, Sirisuk P, Ra C H, et al. Effects of green LED light and three stresses on biomass and lipid accumulation with two-phase culture of microalgae [J]. Process Biochemistry, 2019,77:93-99.
[10] 孙建瑞,赵君峰,符丹丹,等.不同光质对衣藻(sp.212)生长及油脂积累的影响[J]. 应用与环境生物学报, 2020,26(4): 1016-1022.
Sun J R, Zhao J F, Fu D D, et al. Effects of different lights on the growth and lipid accumulation ofsp. 212 [J]. Chinese Journal of Applied and Environmental Biology, 2020,26(4):1016- 1022.
[11] 李元翔.杜氏盐藻类胡萝卜素代谢对光强和光质变化的响应机制[D]. 青岛:中国科学院大学(中国科学院海洋研究所), 2019.
Li Y X. The response mechanism of carotenoid biosynthesis pathway under different intensities and wavelengths of light in[D]. Qingdao: University of Chinese Academy of Sciences (Institute of Oceanography, Chinese Academy of Sciences), 2019.
[12] 蔡学花.杜氏盐藻对不同浓度CO2与光质的代谢响应[D]. 青岛:中国科学院大学(中国科学院海洋研究所), 2018.
Cai X H. Metabolic responses ofto different concentrations of CO2and light quality [D]. Qingdao: University of Chinese Academy of Sciences (Institute of Oceanography, Chinese Academy of Sciences), 2018.
[13] Blair M F, Kokabian B, Gude V G. Light and growth medium effect onbiomass production [J]. Journal of Environmental Chemical Engineering, 2014,2(1):665-674.
[14] 李 珂,李清毅,郭文文,等.高碳与光调控对微藻捕集CO2的影响机制[J]. 化工进展, 2020,39(11):4600-4607.
Li K, Li Q Y, Guo W W, et al. Effects of high carbon and light regulation on CO2capture by microalgae [J]. Chemical Industry and Engineering Progress, 2020,39(11):4600-4607.
[15] 魏 群,毛 瑞,马湘蒙,等.光质对蛋白核小球藻膜生长及除镉效果的影响[J]. 华北水利水电大学学报(自然科学版), 2021,42(1):16- 21.
Wei Q, Mao R, Ma X M, et al. Effects of different light qualities onbiofilm growth and cadmium removal [J]. Journal of North China University of Water Resources and Electric Power (Natural Sciences Edition), 2021,42(01):16-21.
[16] Amrei H D, Ranjbar R, Rastegar S, et al. Using fluorescent material for enhancing microalgae growth rate in photobioreactors [J]. Journal of Applied Phycology, 2015,27(1):67-74.
[17] Vadiveloo A, Moheimani N R, Cosgrove J J, et al. Effect of different .light spectra on the growth and productivity of acclimatedsp. () [J]. Algal Research, 2015,8: 121-127.
[18] Stanier R Y, Kunisawa R, Mandel M, et al. Purification and properties of unicellular blue-green algae (order) [J]. Bacteriological Reviews, 1971,35(2):171-205.
[19] Cheirsilp B, Torpee S. Enhanced growth and lipid production of microalgae under mixotrophic culture condition: effect of light intensity, glucose concentration and fed-batch cultivation [J]. Bioresource Technology, 2012,110:510-516.
[20] Jeffrey S W, Humphrey G F. New spectrophotometric equations for determining chlorophylls a, b, c1and c2 in higher plants, algae and natural phytoplankton [J]. Biochemie und Physiologie der Pflanzen, 1975,167(2):191-194.
[21] Jensen A. Handbook of phycological methods [M]. London: Cambridge University Press, 1978.
[22] Folch J, Lees M, Sloane S G H. A simple method for the isolation and purification of total lipides from animal tissues [J]. Journal of Biological Chemistry, 1957,226(1):497-509.
[23] 熊 伟,黄 云,付 乾,等.微藻生物膜营养环境对微藻生长和油脂积累影响[J]. 中国环境科学, 2016,36(8):2463-2469.
Xiong W, Huang Y, Fu Q, et al.Effect of nutrient solution content of biofilm on algal growth and lipid accumulation [J]. China Environmental Science, 2016,36(8):2463-2469.
[24] Templeton D W, Quinn M, Wychen S V, et al. Separation and quantification of microalgal carbohydrates [J]. Journal of Chromatography A, 2012,1270:225-234.
[25] Fan H H, Wang K, Wang C, et al. A comparative study on growth characters and nutrients removal from wastewater by two microalgae under optimized light regimes [J]. Environmental Technology & Innovation, 2020,19:100849.
[26] 唐青青,方治国,嵇雯雯,等.光质对蛋白核小球藻()生长特征及生化组成的影响研究[J]. 环境科学, 2014, 35(11):4212-4217.
Tang Q Q, Fang Z G, Ji W W,et al.Effects of light quality on the growth characteristics and biochemical component of[J]. Environmental Science, 2014,35(11):4212-4217.
[27] 马瑜晗.反义抑制三角褐指藻丙酮酸脱氢酶激酶基因促进脂质合成的研究[D]. 广州:暨南大学, 2016.
Ma Y H. Antisense inhibition ofpyruvate dehydrogenase kinase gene to promote lipid synthesis [D]. Guangzhou: Jinan University, 2016.
[28] Tamburic B, Szabó M, Tran N A T, et al. Action spectra of oxygen production and chlorophyll a fluorescence in the green microalga[J]. Bioresource Technology, 2014,169:320- 327.
[29] Takaichi S. Carotenoids in algae: distributions, biosyntheses and functions [J]. Marine drugs, 2011,9(6):1101-1118.
[30] Kim C W, Sung M G, Nam K, et al. Effect of monochromatic illumination on lipid accumulation ofunder continuous cultivation [J]. Bioresource Technology, 2014,159:30-35.
[31] Hogewoning S W, Trouwborst G, Maljaars H, et al. Blue light dose-responses of leaf photosynthesis, morphology, and chemical composition ofgrown under different combinations of red and blue light [J]. Journal of Experiment Botany, 2010,61(11):3107- 3117.
[32] Li X P, Manuel J, Slavens S, et al. Interactive effects of light quality and culturing temperature on algal cell size, biomass doubling time, protein content, and carbohydrate content [J]. Applied Microbiology and Biotechnology, 2021,105(2):587-597.
[33] Ajayan K V, Harilal C C, Gani P. Performance of reflector coated LED Bio-box on the augmentation of growth and lipid production in aerophytic trebouxiophyceaen algaesp. [J]. Algal Research, 2019,38:101401.
[34] Schulze P S C, Pereira H G C, Santos T F C, et al. Effect of light quality supplied by light emitting diodes (LEDs) on growth and biochemical profiles ofand[J]. Algal Research, 2016,16:387-398.
[35] Eugenio G L D, Erika O A A, Alejandro R U, et al. Effect of green and red light in lipid accumulation and transcriptional profile of genes implicated in lipid biosynthesis in[J]. Biotechnology Progress, 2016,32(6):1404-1411.
[36] Schulze P S C, Barreira L A, Pereira H G C, et al. Light emitting diodes (LEDs) applied to microalgal production [J]. Trends in Biotechnology, 2014,32(8):422-430.
[37] Hee K S, Yung S I, Jun H H, et al. Lipid and unsaturated fatty acid productions from three microalgae using nitrate and light-emitting diodes with complementary LED wavelength in a two-phase culture system [J]. Bioprocess and Biosystems Engineering, 2019,42(9):1-10.
[38] Severes A, Hegde S, Souza L D, et al. Use of light emitting diodes (LEDs) for enhanced lipid production in micro-algae based biofuels [J]. Journal of Photochemistry & Photobiology, B: Biology, 2017, 170:235-240.
[39] Ra C H, Kang C H, Jung J H, et al. Effects of light-emitting diodes(LEDs) on the accumulation of lipid content using a two-phase culture process with three microalgae [J]. Bioresource Technology, 2016,212:254-261.
[40] Das P, Lei W, Aziz S S, et al. Enhanced algae growth in both phototrophic and mixotrophic culture under blue light [J]. Bioresource Technology, 2011,102(4):3883-3887.
[41] Wang C Y, Fu C C, Liu Y C. Effects of using light-emitting diodes on the cultivation of[J]. Biochemical Engineering Journal, 2007,37(1):21-25.
[42] Mirkovic T, Ostroumov E E, Anna J M, et al. Light absorption and energy transfer in the antenna complexes of photosynthetic organisms [J]. Chemical Reviews, 2017,117(2):249-293.
[43] Tikhonov A N. Induction events and short-term regulation of electron transport in chloroplasts: an overview [J]. Photosynthesis Research, 2015,125(1/2):65-94.
[44] Teo C L, Atta M, Bukhari A, et al. Enhancing growth and lipid production of marine microalgae for biodiesel production via the use of different LED wavelengths [J]. Bioresource Technology, 2014,162: 38-44.
[45] Olga S, Virginie M, Lionel U, et al. Modulation of lipid biosynthesis by stress in diatoms [J]. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences, 2017,372(1728): 20160407.
Regulation of light quality ongrowth and metabolism.
GAN Yu-hua, WEI Qun*, MA Xiang-meng, LI Zhong-tang, JIN Yuan-rong, LI Shu-yuan
(School of Resources, Environment and Materials, Guangxi University, Nanning 530004, China)., 2022,42(9):4296~4303
In order to evaluate effects of light quality on the growth ofand metabolic mechanisms, this study was designed to monitor the growth ofunder different light qualities with transcriptome sequencing. The results show that red and blue lights were effective forgrowth, and the algal cell density was 52.96% and 61.11% higher than that of the white light control group after 7days of cultivation with red and blue light culture, respectively.demonstrated unique physiological characteristics under different light qualities, and the blue light group had the highest concentration of Chl, Chland Car with (17.84±0.26), (8.39±0.19) and (6.04±0.08)mg/L, respectively; the carbohydrate and lipid contents of the microalgae were the highest after 7 days of red light incubation, reaching (115.60±1.81)μg/mg and (18.64±0.54)%, respectively. Gene expression ofdiffered under different light qualities as indicated by transcriptome sequencing. The gene expression of carbonic anhydrase, acetyl coenzyme A carboxylase and fatty acid synthase were most significant under red light, and majority of the differentially expressed genes were involved in fatty acid synthesis and carbon fixation; the gene expression of RubisCO enzyme was the highest under blue light and the differentially expressed genes enriched in the photosynthetic system were up-regulated, and the photosynthetic rate and carbon fixation rate were the fastest; the gene expression of most of the genes in microalgae under green light was low with poor metabolic potential. The TCA cycle ofwas active under white light, which was not conducive to the storage of carbohydrates and lipids.
light quality;;growth;metabolism;gene;high-throughput sequencing
X52
A
1000-6923(2022)09-4296-08
2022-02-14
广西重点研发计划项目(桂科AB1850006)
*责任作者, 教授, hustweiqun@163.com
甘钰华(1996-),女,广西贵港人,广西大学硕士研究生,从事水污染控制方面研究.

