部分反硝化耦合厌氧氨氧化IFAS系统脱氮性能
余浩涛,于莉芳*,李 韧,高 宇,张 琼,乔冰闯,郑兰香,彭党聪
部分反硝化耦合厌氧氨氧化IFAS系统脱氮性能
余浩涛1,于莉芳1*,李 韧1,高 宇1,张 琼1,乔冰闯1,郑兰香2,3,彭党聪1
(1.西安建筑科技大学环境与市政工程学院,陕西 西安 710055;2.宁夏大学生态环境学院,宁夏 银川 750021;3.中国葡萄酒产业技术研究院,宁夏 银川 750021)
采用部分反硝化活性污泥耦合厌氧氨氧化生物膜处理低碳氮比废水(C/TN=1.63),考察生物膜-活性污泥复合系统(IFAS)进行部分反硝化耦合厌氧氨氧化(PD/A)处理低碳氮比废水的可行性及其耦合后两相中功能菌活性与菌群分布变化规律.结果显示,系统耦合运行期间,出水TN为(5.07±0.2)mg/L,去除率为(90.7±0.1)%,厌氧氨氧化途径对TN去除的贡献率高达(86.61±3.4)%;固着相对厌氧氨氧化活性的贡献率为100%,悬浮相上,(NO3--N)占比为99.32%,(NO2--N)占比为99.22%;与耦合前相比,悬浮相中硝酸盐还原酶(Nar)活性由(0.43±0.05)μmol/(mg protein·min)增加至(0.49±0.09)μmol/(mg protein·min),亚硝酸盐转化率明显升高[(70±2.2)%~(90.01±2.3)%];Illumina MiSeq结果显示,固着相上的优势菌属为,且耦合前后丰度无明显变化(33.61%~33.43%),悬浮相上反硝化菌属,,OLB8丰度增加.以上结果表明,在IFAS系统中可以实现稳定的PD/A协同脱氮,耦合后部分反硝化由悬浮相主导,厌氧氨氧化由固着相主导,厌氧氨氧化菌(AnAOB)与反硝化菌对NO2--N的竞争强化了悬浮相部分反硝化能力.
生物膜-活性污泥复合工艺;低碳氮比;部分反硝化;厌氧氨氧化;群落结构;高通量测序
厌氧氨氧化(Anammox)作为新型生物脱氮工艺,具有无需外加有机碳源、污泥产量低、脱氮效率高、温室气体排放少等优点,在城镇污水处理厂升级改造中具有广阔的应用前景[1-2].但其在实际应用中主要受以下因素限制:(1)电子受体NO2--N无法稳定供给;(2)Anammox生物量很难富集并保持;(3)有机物对厌氧氨氧化菌(AnAOB)的生长存在一定的抑制作用.已有研究表明,部分反硝化(PD)能在低碳氮比条件和不同温度下将NO3--N还原为NO2--N, Anammox反应所需NO2--N可由PD来提供[1,3-4],且PD利用有机碳作为电子供体,可以为Anammox解除有机物的抑制[5].此外,Anammox产生的NO3--N可通过PD继续生成NO2--N用于Anammox,提高了脱氮性能,因此部分反硝化耦合厌氧氨氧化(PD/A)工艺成为当前低碳氮比废水处理研究的热点[4,6-7].
PD/A系统中两种功能菌存在显著的生理差异,反硝化菌为异养菌,有较高的产率系数(0.3gVSS/g NH4+-N)和底物吸收速率,需要良好的传质效率[8];而AnAOB为自养菌,产率系数低(0.066gVSS/g NH4+-N),需要长污泥龄来保留和维持稳定的生物量[8].而在生物膜-活性污泥复合工艺(IFAS)中,悬浮相污泥龄调控灵活,可为生长较快的微生物提供更好的传质效果,适合反硝化菌的生长;固着相载体能为微生物提供大量的附着点位和生长空间,也能提供抵御不利环境的防护屏障[9],可强化AnAOB在生物膜中的保留[10-11].因此,IFAS系统可成为有效的PD/A耦合形式,但耦合后系统处理低碳氮比废水的可行性及微生物群落结构变化有待进一步研究.
本研究在实现PD的基础上,采用IFAS系统进行PD/A耦合处理低碳氮比废水(C/TN=1.63),考察耦合后IFAS系统脱氮性能及氮转化途径,对比分析了耦合前后功能微生物代谢活性、酶活性变化情况,采用Illumina MiSeq方法分析了微生物群落结构变化,以期为该工艺的实际应用提供技术参考.
1 材料与方法
1.1 试验装置及运行条件
试验装置采用有效容积为3L的SBR反应器(图1),并通过恒温水浴系统控制反应器内温度为25℃,为了充分混合,反应器设置了恒速搅拌系统,转速为70r/min.试验所用的接种污泥取自西安市某污水处理厂缺氧池,MLSS为(2323.4±62)mg/L,MLVSS为(1713.6±34)mg/L,Anammox填料取自实验室已稳定运行2年的固定床生物膜反应器,填料比表面积为500m2/m3,负荷为0.39mg NH4+-N/(m3·d),最大活性为122.25mg N/(L·d).
试验分为PD培养阶段(0~95d)及PD/A耦合阶段(96~155d).其中,PD阶段污泥龄为15d,换水比恒为50%,前42d以4h/周期运行(进水5min,搅拌190min,沉降30min,排水10min,闲置5min);43~95d将搅拌时长缩短为70min,以2h/周期运行;PD/A阶段悬浮相污泥龄为15d,生物膜填充率为15%,换水比调整至33%,将搅拌时长重新增加为190min,以4h/周期运行.

图1 PD/A阶段反应器装置
1.2 试验用水
本试验用水采用人工模拟低碳氮比废水,并通过添加NH4Cl、NaNO3和CH3COONa配制进水所需的氨氮、硝酸盐氮及COD.其中,PD阶段进水水质为:60mg/L NO3--N,180mg/L COD, 11.1mg/L KH2PO4, 6mg/L CaCl2·2H2O,3mg/L MgSO4·7H2O; PD/A阶段参考西安市某污水厂进水,进水水质为:30mg/L NO3--N,25mg/L NH4+-N,90mg/L COD, 30mg/L KH2PO4, 140mg/L CaCl2·2H2O,140mg/L MgSO4·7H2O;微量元素见文献[6,12].
1.3 检测分析方法
本试验中常规水质(NH4+-N、NO2--N和NO3--N)采用标准方法测定[12];pH值采用雷磁PHS-3C pH计测定;COD采用COD快速分析仪(HACA DRB 200)测定;PD活性测定方法见文献[13],分别用(NO3--N)和(NO2--N)表示NO3--N还原速率和NO2--N积累速率;Anammox活性(NH4+- N)(以氨氮计)测定方法见文献[14].
试验采用低温高压连续细胞破碎仪(JN-02C,广州聚能纳米生物科技有限公司)进行粗酶的提取,具体方法参照文献[15],通过Lowry法测定蛋白质的浓度以表示粗酶的含量.硝酸盐还原酶(Nar)和亚硝酸盐还原酶(Nir)活性单位以µmol/(mg protein·min)表示,详细测定方法见文献[17];肼脱氢酶(HDH)活性测定体系包括:0.01mol/L磷酸钾缓冲液(pH=8.0)、50µmol/L马心细胞色素C、适量酶液及25µmol/L肼,单位以µmol细胞色素C/(mg protein·min)表示,具体方法见文献[16].
1.4 指标计算
(1)PD和PD/A阶段NO2--N转化率(NTR)计算方法分别见公式(1)[12]和公式(2)[6]:

式中:[NO2--N]eff表示出水NO2--N浓度,mg/L; [NO3--N]eff表示出水NO3--N浓度,mg/L;[NO3--N]inf表示进水NO3--N浓度,mg/L.
(2)
式中:[NO2--N]表示时刻的NO2--N浓度,mg/L;[NO2-- N]amx表示Anammox反应理论上消耗的NO2--N浓度,mg/L;[NO3--N]inf表示进水NO3--N浓度, mg/L; [NO3--N]amx表示Anammox 反应理论上产生的NO3-- N浓度,mg/L;[NO3--N]表示时刻的NO3--N浓度, mg/L.
(2)完全反硝化和厌氧氨氧化是PD/A阶段的主要脱氮途径,忽略细胞合成消耗的NH4+-N,根据Anammox反应式[13]计算[6]:
厌氧氨氧化脱氮贡献率:

完全反硝化脱氮贡献率:

式中:[NH4+-N]inf表示进水NH4+-N浓度,mg/L; [NH4+-N]eff表示出水NH4+-N浓度,mg/L; ∆TN表示进出水TN变化浓度,mg/L.
(3)部分反硝化代谢活性和反硝化酶活性占比计算方法分别见公式(5)和公式(6):


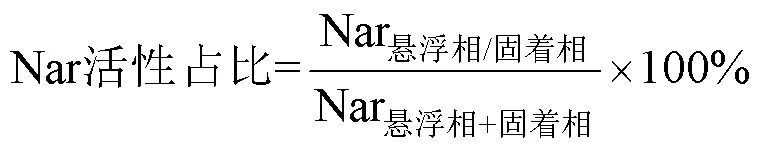

1.5 微生物群落分析
微生物群落结构分析采用Illumina MiSeq高通量测序,取耦合前活性污泥和接种填料及耦合阶段运行第60d的活性污泥和生物填料进行高通量测序分析.将活性污泥耦合前后样品分别命名为PD1和PD2,生物填料耦合前后样品分别命名为A1和A2.样品由北京奥维森基因科技有限公司提供测序技术支持,采用引物序列515a(GTGCC- AGCMGCCGCGGTAA)和806(GGACTACHVGG- GTWTCTAAT)对样品16S V4区进行扩增,具体方法见文献[17].
2 结果与讨论
2.1 部分反硝化阶段
2.1.1 PD阶段运行特性 如图2所示,在1~42d,以4h/周期,HRT=8h运行.反应器启动第1d, NTRPD仅为26.32%,之后NTRPD快速上升,并在第10d达到了60.89%,相比生物膜系统,本研究采用活性污泥可以更快地实现部分反硝化[2,13].11~31d,反应器稳定运行,出水NO2--N稳定维持在(40±1.4)mg/L,平均NTRPD达到(63.64±2.8)%;但32~42d出水NO2--N降低, NTRPD降低至(57.14±1.3)%,其原因是停留时间偏长时发生了内碳源反硝化[16].因此,在43~95d,以2h/周期,HRT=4h运行,在此期间出水NO2--N恢复并稳定在(42±1.6)mg/L,平均NTRPD恢复至(70±2.2)%,实现了PD的稳定运行,PD阶段亚硝酸盐转化率逐渐升高到趋于稳定, 变化规律与以往研究结果类似[2].
2.1.2 PD阶段典型周期 由图3可知,0~15min,反硝化菌利用COD快速将NO3--N还原,NO2--N迅速从16.87mg/L积累至36.41mg/L,与生物膜系统相比,本研究中亚硝酸盐的积累速度更快,达到峰值所需时间更短[2].15~120min,由于COD浓度保持在较低水平,反硝化过程受到抑制,NO3--N缓慢降至4.2mg/L,对应NO2--N浓度增加至39.9mg/L,由公式(1)计算可得,平均NTRPD为(70.7±1.2)%.理论上,部分反硝化(NO3--N→NO2--N)不会产生碱度,但乙酸钠的消耗会导致pH值增加,结合pH值变化曲线,0~15min,pH值快速上升并到达峰值,15~120min, pH值逐渐下降,与Gong等[18]典型周期中pH值变化规律一致.

图2 PD阶段进出水氮浓度及NTRPD变化

图3 PD阶段典型周期内氮素、COD和pH值变化(第70d)
2.2 部分反硝化耦合厌氧氨氧化阶段
2.2.1 PD/A阶段运行特性 由图4可知,反应器在加入厌氧氨氧化生物膜后,快速实现了PD/A协同脱氮,耦合后第一天(96d),NH4+-N由进水的22.15mg/L降至2.29mg/L(去除率为89.66%),NO3--N由进水32.39mg/L降至5.6mg/L(去除率为82.4%),出水TN为7.95mg/L,去除率为85.42%;之后反应器运行稳定,出水NH4+-N降至(1.1±0.3)mg/L,出水NO3--N降至(3.1±0.4)mg/L,出水TN为(5.07±0.2)mg/L,去除率为(90.7±0.1)%.由公式(2)计算,耦合阶段运行稳定期间平均NTRPD/A为(90.01±2.3)%,显著高于PD阶段中的NTRPD(70±2.2)%,这与Jiang等[19]实验得出耦合后NTRPD/A高于耦合前的变化规律一致,这可能是因为Anammox对NO2‑-N(PD过程产物)的快速消耗强化了系统的部分反硝化能力,而PD过程又可以为Anammox过程提供更多的电子受体.由此可见,IFAS系统内,部分反硝化和厌氧氨氧化可以相互促进,可有效实现PD/A协同脱氮[2].

图4 PD/A阶段反应器脱氮性能
(a)进出水氮浓度(b)TN及其去除率(c)两种脱氮途径对TN去除贡献率
如图4c所示,厌氧氨氧化途径对TN去除的平均贡献率为(86.61±3.4)%,而完全反硝化途径对TN去除的平均贡献率仅为(13.57±2.4)%.显然,厌氧氨氧化途径在脱氮过程中起主导作用,这说明AnAOB对NO2--N的竞争能力强于反硝化菌,这对NH4+-N和NO2--N的稳定去除起着关键作用[3]. Cao等[20]接种具有较高NTRPD(80%)的PD活性污泥进行PD/A,在C/NO3--N=3条件下,厌氧氨氧化途径对TN去除贡献率为90%,TN去除率达到了97%,这可能是由于高NTRPD条件下,更多的NO2--N通过厌氧氨氧化途径而不是完全反硝化途径生成N2,进一步表明高NTRPD对PD/A实现高效稳定的脱氮性能起关键作用.

图5 PD/A阶段典型周期内各氮素转化、COD和pH值变化 (第136d)
2.2.2 PD/A阶段典型周期 如图5所示,PD/A工艺可以清晰地划分为PD和Anammox两个阶段. 0~21min,PD过程所需底物NO3--N和COD充足,PD利用有机物快速将NO3--N还原,NO2--N浓度迅速积累至9.67mg/L,反应前期PD过程占主导.而由于有机物对Anammox活性有抑制作用,有机物的消耗通常在Anammox反应之前进行[5].21~240min,观察到NO2--N和NH4+-N同时被消耗,NO3--N浓度开始缓慢上升,这个阶段COD浓度较低,反硝化过程受限,使得NO2--N通过Anammox途径去除.周期内NTRPD/A(91.23%)显著高于PD阶段中的NTRPD((70.7±1.2)%),说明耦合后厌氧氨氧化竞争NO2--N提高了NTR.经计算,耦合阶段中∆NO2--N/∆NH4+- N=1.22,略大于Anammox反应式中的∆NO2--N/ ∆NH4+-N=1.146,说明系统中存在完全反硝化过程,但反应后期对氮的去除主要依靠Anammox途径,因此反应后期Anammox占主导.
2.2.3 不同生物相代谢活性变化 如图6a所示,在PD阶段,随着培养时间的增加,(NO3--N)和(NO2-- N)均逐渐上升并趋于稳定.耦合前,(NO3--N)稳定在(4664.14±51)mgN/(L·d),(NO2--N)稳定在(4468.22±32)mgN/(L·d),(NO2--N)/(NO3--N)为(0.95±0.08),(NO3--N)和(NO2--N)相近,可以保证NO2--N的稳定积累,部分反硝化活性的增加使得PD阶段NTRPD从26.32%增长到(70±2.2)%;耦合后,(NO3--N)和(NO2--N)低于耦合前,随着运行时间的增加,活性有恢复趋势,在136d,(NO3--N)恢复至3531.11mgN/(L·d),(NO2--N)恢复至3267.53mgN/ (L·d).由公式(5),(6)计算,悬浮相上,(NO3--N)占比为99.32%,(NO2--N)占比为99.22%.在悬浮相上没有检测到Anammox活性,这可能是AnAOB在固着相上没有脱落或者脱落的生物量在悬浮相中活性较低导致.

图6 悬浮相(a)和固着相(b)上代谢活性变化
如图6b所示,耦合前(95d),(NH4+-N)为122.25mgN/(L·d),耦合后活性低于耦合前,这是由于PD/A阶段运行初期,有机物存在时反硝化菌会与AnAOB争夺底物NO2--N,对Anammox活性造成了影响[21],随着微生物对运行条件的适应,(NH4+-N)有恢复趋势,在第136d,(NH4+-N)逐渐恢复至104.97mg N/(L·d),这与Du等[12]实验得出耦合后Anammox活性先下降后上升变化趋势一致.值得注意的是,恢复后活性数值仍低于耦合前,这是由于除了有机物对AnAOB的抑制作用外,耦合前Anammox生物膜培养环境从高负荷(0.39mg NH4+- N/(m3·d))、35℃变为低负荷(0.05mg NH4+-N/ (m3·d))、25℃也对厌氧氨氧化活性造成了影响.在固着相上检测到了反硝化活性,但占比极低,固着相上对Anammox活性贡献率为100%.而Anammox活性数值较低主要与厌氧氨氧化菌的生长速率低于反硝化菌有关[3].虽然Anammox活性下降,但并未影响反应器运行状况.因此,NO2--N的稳定积累是PD/A阶段实现稳定高效脱氮的关键[2].
2.2.4 不同生物相酶活性变化 如图7a所示,PD阶段,Nar活性逐渐上升并稳定在(0.43±0.05) μmol/(mg protein·min),Nir活性逐渐降至较低水平(0.05±0.01)μmol/(mg protein·min),Nar/Nir为(8.47±0.14),显然,Nar在PD阶段占据主导地位,并与PD阶段中反硝化活性和NTRPD逐渐上升相符,这也从酶活性方面说明,保持Nar与Nir的巨大差异对PD的实现至关重要[5].耦合后,Nar活性较耦合前有所上升(0.49±0.09)μmol/(mg protein·min),Nir则维持较低活性,Nar/Nir为8.76,说明AnAOB与反硝化菌竞争NO2--N强化了PD过程,符合PD/A阶段中NTRPD/A高于PD阶段的结果.由公式(7),(8)计算,悬浮相上,Nar占比为97.34%,Nir占比为65.89%.在悬浮相中没有检测到HDH活性,这与活性结果一致.
如图7b所示,耦合前,HDH活性为0.10 µmol细胞色素C/(mg protein·min).耦合后,HDH活性出现降低,随着Anammox菌对反应器运行条件的适应,第155d,HDH活性恢复至0.075µmol细胞色素C/(mg protein·min).耦合后HDH活性与Anammox活性变化规律一致,分析原因与进水中有机物和Anammox生物膜在耦合前后的运行条件变化有关.在生物膜上检测到了Nar和Nir存在,但占比很低,与反硝化活性在悬浮相和固着相上差异巨大的结果一致.

图7 悬浮相(a)和固着相(b)上酶活性变化
2.3 微生物群落结构变化
如图8a所示,悬浮相上,耦合后Bacteroidota (45.3%~41.1%)和Proteobacteria(27.9%~16.9%)丰度降低,而Verrucomicrobiota丰度增加(11.61%~ 21.63%),这3种菌门都包含反硝化菌属,其丰度变化可能与反硝化菌属丰度的变化有关.固着相上,包含AnAOB菌属的Planctomycetota(38.75%~36.21%)[1]与和反硝化菌属有关的Proteobacteria(20.97%~ 21.39%)和Bacteroidota(7.4%~7.1%)丰度均无明显变化.
如图8b所示,悬浮相上,、、、、OLB8是已被报道的反硝化菌属[22-24],其中和菌属可以将NO3--N还原为NO2--N,在PD中发挥关键作用[6,25];、和是反硝化菌,能够进行完全反硝化过程(NO3--N→N2)[22-24].属于Verrucomicrobia菌门,其丰度的增加导致了耦合后Verrucomicrobia菌门丰度增加[24];以上反硝化菌属总丰度从耦合前的13.38%增加到了耦合后的51%.悬浮相上检测到了菌属丰度的增加,但丰度仅为1.01%,表明AnAOB基本没有脱落,与悬浮相中没有检测到生物代谢活性和酶活性结果一致.固着相上,丰度最高的是与Anammox相关的菌属,且耦合前(33.61%)和耦合后(33.43%)的丰度并未发生明显变化,耦合后部分反硝化菌属和丰度有所增加.
部分反硝化实现亚硝酸盐积累的两个途径可以分为:(1)富集培养具有部分反硝化能力的菌群[26];(2)利用反硝化菌中Nar和Nir对电子供体的竞争能力差异导致亚硝酸盐积累[27],在可进行完全反硝化过程的菌属占优势时,NO3--N残留浓度(>2mg/L)是保证PD的关键,NO3--N的存在会阻碍Nir接受细胞色素C传递的电子从而抑制NO2--N的还原[27].本研究中,IFAS系统的Nar和Nir酶活性主要来源于悬浮相 (图7),耦合后悬浮相的可进行完全反硝化过程的菌属显著增加并占绝对优势(图8b);而典型周期内NO3--N最低浓度为2.2mg/L(图5).因此,可以看出IFAS系统中,耦合后Anammox过程通过上述第(2)种途径强化悬浮相部分反硝化能力.本研究中生物膜上的AnAOB几乎没有脱落,而且其上生长的少量反硝化菌属没有明显的活性贡献,与以往耦合研究中反硝化菌属丰度增加会引起厌氧氨氧化丰度降低[4]有所区别,部分反硝化由悬浮相主导,厌氧氨氧化由固着相主导.说明IFAS系统中生物膜对AnAOB有很好的持留性能,悬浮相反硝化菌对碳源有较高的利用效率,采用IFAS系统进行PD/A耦合可以同时为两种功能微生物提供良好的生长环境.

图8 悬浮相和固着相微生物群落相对丰度
(a)门水平(b)属水平
3 结论
3.1 PD/A在IFAS系统中可实现协同脱氮.出水TN为(5.07±0.2) mg/L,厌氧氨氧化途径对TN去除的平均贡献率为(86.61±3.4)%,厌氧氨氧化对TN去除的贡献占主导地位.
3.2 固着相对厌氧氨氧化活性的贡献率为100%,悬浮相上,(NO3--N)占比为99.32%,(NO2--N)占比为99.22%.耦合后IFAS系统中部分反硝化由悬浮相主导,厌氧氨氧化由固着相主导,耦合后NTRPD/A和Nar的上升说明AnAOB与反硝化菌竞争NO2--N强化了部分反硝化能力.
3.3 耦合后固着相上优势菌为,相对丰度为33.43%;悬浮相中完全反硝化菌属丰度占绝对优势,残留NO3--N的存在,抑制了NO2--N还原,保证了高NO2--N积累特性. IFAS系统中生物膜对AnAOB有很好的持留性能,可以同时为两种功能微生物提供良好的生长环境.
[1] Wang Z, Bin L, Xiao L, et al. Microbial diversity reveals the partial denitrification-anammox process serves as a new pathway in the first mainstream anammox plant [J]. Science of the Total Environment, 2021,764:142917.
[2] Chen K, Zhang L, Sun S, et al. In situ enrichment of anammox bacteria in anoxic biofilms are possible due to the stable and long- term accumulation of nitrite during denitrification [J]. Bioresource Technology, 2020,300:122668.
[3] Du R, Cao S, Li B, et al. Synergy of partial-denitrification and anammox in continuously fed upflow sludge blanket reactor for simultaneous nitrate and ammonia removal at room temperature [J]. Bioresource Technology, 2019,274:386-394.
[4] Gao R, Peng Y, Li J, et al. Nitrogen removal from low COD/TIN real municipal sewage by coupling partial denitrification with anammox in mainstream [J]. Chemical Engineering Journal, 2021,410:128221.
[5] Du R, Peng Y, Ji J, et al. Partial denitrification providing nitrite: Opportunities of extending application for anammox [J]. Environment International, 2019,131:105001.
[6] Du R, Cao S, Li B,et al. Performance and microbial community analysis of a novel DEAMOX based on partial-denitrification and anammox treating ammonia and nitrate wastewaters [J]. Water Research, 2017,108:46-56.
[7] Li W, Shan X Y, Wang Z Y, et al. Effect of self-alkalization on nitrite accumulation in a high-rate denitrification system: Performance, microflora and enzymatic activities [J]. Water Research, 2016,88:758-765.
[8] Wang L, Hong Y, Gu J-D, et alInfluence of critical factors on nitrogen removal contribution by anammox and denitrification in an anammox-inoculated wastewater treatment system [J]. Journal of Water Process Engineering, 2021,40:101868.
[9] Mehrdadi N, Azimi A A, Bidhendi G R N, et al. Determination of design criteria for comparison of h-ifas reactor and extended aeration activated sludge process [J]. Iranian Journal of Environmental Health Science and Engineering, 2007,3(1):53-64.
[10] 刘国华,李钦渝,徐相龙,等.IFAS污水处理工艺的研究进展[J]. 环境工程, 2022,40(2):214-224.
Liu G H, Li Q Y, Xu X L, et al. Research progress of IFAS process for wastewater treatment [J]. Environmental Engineering, 2022,40(2): 214-224.
[11] Yang S, Peng Y, Zhang L, et al. Autotrophic nitrogen removal in an integrated fixed-biofilm activated sludge (IFAS) reactor: Anammox bacteria enriched in the flocs have been overlooked [J]. Bioresource Technology, 2019,288:121512.
[12] Du R, Peng Y, Cao S, et al. Mechanisms and microbial structure of partial denitrification with high nitrite accumulation [J]. Applied Microbiology and Biotechnology, 2016,100(4):2011-2021.
[13] 于莉芳,张兴秀,张 琼,等.生物膜系统中部分反硝化实现特性[J]. 环境科学, 2021,42(9):4390-4398.
Yu L F, Zhang X X, Zhang Q, et al. Characteristics of partial denitrification in biofilm system [J]. Environmental Science, 2021, 42(9):4390-4398.
[14] 吕 恺,王康舟,姚雪薇,等.基于氨氮,硝氮及乙酸条件下Anammox菌的培养[J]. 中国环境科学, 2020,40(10):4348-4353.
Lv K, Wang K Z, Yao X W, et al. Enrichment of Anammox under conditions of ammonium, nitrate and acetic acid as substrates [J].China Environmental Science, 2020,40(10):4348-4353.
[15] Yu L, Li R, Mo P, et al. Stable partial nitrification at low temperature via selective inactivation of enzymes by intermittent thermal treatment of thickened sludge [J]. Chemical Engineering Journal, 2021,418(3): 129471.
[16] Shimamura M, Nishiyama T, Shigetomo H, et al. Isolation of a multiheme protein with features of a hydrazine-oxidizing enzyme from an anaerobic ammonium-oxidizing enrichment culture [J]. Applied and Environmental Microbiology, 2007,73(4):1065-1072.
[17] 于莉芳,汪 宇,滑思思,等.城市污水处理厂进水氨氧化菌对活性污泥系统的季节性影响[J]. 环境科学, 2021,42(4):1923-1929.
Yu L F, Wang Y, Hua S S, et al. Seasonal effects of influent ammonia oxidizing bacteria of municipal wastewater treatment plants on activated sludge system [J]. Environmental Science,2021,42(4):1923-1929.
[18] Gong L, Huo M, Yang Q, et al. Performance of heterotrophic partial denitrification under feast-famine condition of electron donor: a case study using acetate as external carbon source [J]. Bioresource Technology, 2013,133:263-269.
[19] Jiang H, Wang Z, Ren S, et al. Enrichment and retention of key functional bacteria of partial denitrification-Anammox (PD/A) process via cell immobilization: A novel strategy for fast PD/A application [J]. Bioresource Technology, 2021,326:124744.
[20] Cao S, Peng Y, Du R, et al. Feasibility of enhancing the denitrifying ammonium oxidation (DEAMOX) process for nitrogen removal by seeding partial denitrification sludge [J]. Chemosphere, 2016,148:403-407.
[21] Deng S, Peng Y, Zhang L, et al. Advanced nitrogen removal from municipal wastewater via two-stage partial nitrification-simultaneous anammox and denitrification (PN-SAD) process [J]. Bioresource Technology, 2020,304:122955.
[22] Roy D, Lemay J F, Drogui P, et alIdentifying the link between MBRs' key operating parameters and bacterial community: A step towards optimized leachate treatment [J]. Water Research, 2020,172: 115509.
[23] Liang B, Kang F, Yao S,et alExploration and verification of the feasibility of the sulfur-based autotrophic denitrification integrated biomass-based heterotrophic denitrification systems for wastewater treatment: From feasibility to application [J]. Chemosphere, 2022,287: 131998.
[24] Gong Q, Wang B, Gong X, et al. Anammox bacteria enrich naturally in suspended sludge system during partial nitrification of domestic sewage and contribute to nitrogen removal [J]. Science of the Total Environment, 2021,787:147658.
[25] Huang X, Mi W, Ito H, et al. Unclassified Anammox bacterium responds to robust nitrogen removal in a sequencing batch reactor fed with landfill leachate [J]. Bioresource Technology, 2020,316:123959.
[26] Le T, Peng B, Su C, et al. Nitrate residual as a key parameter to efficiently control partial denitrification coupling with anammox [J]. Water Environment Research, 2019,91(11):1455-1465.
[27] Rijn J V, Tal Y, Barak Y. Influence of volatile fatty acids on nitrite accumulation by a pseudomonas stutzeri strain isolated from a denitrifying fluidized bed reactor [J]. Applied and Environmental Microbiology, 1996,62(7):2615-2620.
[28] Zhang H, Du R, Cao S, et al. Mechanisms and characteristics of biofilm formation via novel DEAMOX system based on sequencing biofilm batch reactor [J]. Journal of Bioscience and Bioengineering, 2019,127(2):206-212.
Performance and microbial community of the partial denitrification coupled with anaerobic ammonia oxidation in an IFAS system.
YU Hao-tao1, YU Li-fang1*, LI Ren1, Gao Yu1, ZHANG Qiong1, QIAO Bing-chuang1, ZHENG Lan-xiang2,3, PENG Dang-cong1
(1.School of Municipal and Environmental Engineering, Xi'an University of Architecture and Technology, Xi'an 710055, China;2.School of Ecological Environment, Ningxia University, Yinchuan 750021, China;3.China Wine Industry Technology Institute, Yinchuan 750021, China)., 2022,42(9):4107~4114
In this study, an integrated fixed-film activated sludge (IFAS) system was established to explore the feasibility of treating low carbon/nitrogen (C/TN=1.63) wastewater by coupling partial denitrification (PD) suspended sludge and anaerobic ammonia oxidation (Anammox) biofilm. During the experiment, As a result, the TN removal efficiency could be up to (90.7±0.1)% with the effluent TN of (5.07±0.2) mg/L, and the Anammox pathway contributed to TN removal reached (86.61±3.4)%. And the contribution of biofilm to anammox activity was 100%,(NO3--N) accounted for 99.32%,(NO2--N) accounted for 99.22% in the suspended sludge; indicating that partial denitrification process was dominated in the suspended sludge and Anammox process in the biofilm. Compared with that before coupling, the nitrate reductase (Nar) in the suspended sludge increased from (0.43±0.05) to (0.49±0.09) μmol/(mg protein·min). The nitrite transformation ratio significantly increased from (70±2.2)% to (90.01±2.3)%. In other words, the competition of nitrite between denitrifying bacteria and anaerobic ammonia oxidation bacteria (AnAOB) partially strengthened the partial denitrification process in the suspended sludge. Illumina MiSeq sequencing results show that the abundance of, the dominant bacteria in the biofilm (33.61~33.43)%, had no obvious change before and after coupling. In the phase of suspended sludge, the abundance of,, and OLB8tended to increase. Evidently, the PD/A technology in the IFAS system will provide technical guidance for its practical application.
integrated fixed-film activated sludge (IFAS);low carbon/nitrogen wastewater;partial denitrification;anaerobic ammonia oxidation;community structure;high-throughput sequencing
X703.5
A
1000-6923(2022)09-4107-08
2022-02-08
陕西省重点研发计划项目(2019ZDLSF0605);国家重点研发计划项目(2019YFD1002500);西安建筑科技大学基金项目(ZR20020)
*责任作者, 副教授, yulifang@xauat.edu.cn
余浩涛(1994-),男,山西阳泉人,西安建筑科技大学硕士研究生,主要研究方向为污水生物处理理论与技术.发表论文1篇.

