黑果枸杞根际耐盐碱细菌的筛选及其促生特性分析
热孜亚·吐尔逊,郑 勇,阿丽亚·外力,特列吾·哈杰提,黄晶晶,玛依拉·买苏提,依丽米努尔·艾力,艾斯凯尔·玉苏普,旭格拉·哈布丁
(新疆师范大学生命科学学院,新疆干旱区植物逆境生物学实验室,新疆特殊环境物种保护与调控生物学实验室,新疆特殊环境物种多样性应用与调控重点实验室,沙漠藻研究院,新疆 乌鲁木齐 830054)
盐生植物根际存在大量的耐盐、耐碱细菌,其通过自身代谢物特征与宿主植物互作促进植物生长[1-2].根际耐盐碱细菌能够通过耐盐、耐碱、固氮、溶磷、产铁载体、分泌吲哚乙酸(IAA)和1-氨基环丙烷-1-羧酸(ACC)脱氨酶促进植物生长发育,并赋予植物抗盐、抗碱、抗旱等特性,避免或降低逆境中盐碱对植物的伤害.基于根际耐盐碱细菌促进植物生长的特性,研发高效的微生物肥料以替代化肥与农药,及降低化肥与农药对土壤环境的污染已成为研究热点之一[3-6].
黑果枸杞(Lyciumruthenicum)是具有强根蘖性、抗盐碱、耐土壤贫瘠的多年生盐生灌木植物,主要分布于我国西北盐碱荒漠地区,兼具重要药用、经济和生态价值[7-8].其果实含有大量的大分子物质和微量元素(Mn、Sr、Se、Zn、Cu等)、葡萄糖、甜菜碱、甾醇类、香豆酸、枸杞多糖等多种成分[9].此外,黑果枸杞具有贮盐功能,能承受一定浓度的盐胁迫,在一定含盐量的土壤环境中生长发育,可作为我国改良土壤盐渍化和保护生态环境的先锋树种,具有广泛的经济前景与开发潜力[10-11].近年来,新疆大力推广种植黑果枸杞,据不完全统计种植面积已达14~18万亩,是我国主要生产区,对新疆地区盐碱地的生态建设、保护、修复及改良利用发挥着推动作用,为当地带来了经济、社会和生态效益[12-13].
植物根际细菌的数量分布及促进植物生长的特性不仅与植物种类有关,还与植物所处的环境和土壤条件密切相关[14].本研究从新疆鄯善县黑果枸杞根际分离、筛选耐盐碱菌株,并初步研究菌株的生物学特性,以期为研发适于盐碱环境的微生物肥料提供理论依据和菌种资源.
1 材料与方法
1.1 实验材料
1.1.1 供试土样
供试土壤在2020年10月采自位于90.386° E、42.867° N、海拔773 m的新疆鄯善县黑果枸杞根际土壤.共设5个采样点,各采样点选取生长较好的黑果枸杞,去掉树枝落叶层,小心挖取离地表30 cm深处的根;将根际表面土壤用刷子刷落在无菌白纸上,并混匀5个采样点土壤,再装入无菌袋中,低温保存带回实验室.
1.1.2 培养基
无机磷培养基(g/L):C6H12O610,Ca3(PO4)210,NaCl 50,KCl 10,MgCl2·6H2O 5,MgSO4·7H2O 0.3,FeSO4·7H2O 0.03,MnSO4·7H2O 0.03,琼脂粉20;pH 7.5.
有机磷培养基(g/L):C13H24O410,NaCl 50,C6H12O610,C46H89NO8P 5,牛肉膏3,琼脂粉20;pH 7.5.
阿须贝无氮培养基(g/L):C6H14O610,K2HPO40.2,NaCl 50,MgSO4·7H2O 0.2,CaSO4·7H2O 0.5,CaCO35,琼脂粉20;pH 7.5.
改良ISP2培养基(g/L):C6H12O64,酵母提取物4,麦芽浸粉5,C13H24O44,NaCl 50,琼脂粉 20;pH 7.5.
使用King培养基[15]检测菌株分泌IAA的能力,使用CAS固体培养基和MKB液体培养基[16]测定菌株分泌铁载体的能力.
1.1.3 主要试剂
基因组DNA提取试剂盒(EasyPure Genomic DNA Kit)、高保真PCR试剂盒(2×High Fidelity PCR SuperMix)等购自北京全式金生物技术有限公司;革兰氏染色液(包括结晶紫染色液、碘溶液、脱色液、沙黄染色液或复红染色液);氢氧化钾溶液、钼酸钠稀硫酸溶液、磷标准溶液等用于钼蓝比色法.
1.2 实验方法
1.2.1 根际土壤理化性质测定
供试土样送至中国科学院新疆生态与地理研究所生态与环境分析测试中心进行pH、总盐、SO42-、Cl-、Na+、Mg2+、K+、有机质、全氮、水解性磷、有效磷等指标的测定.
1.2.2 根际细菌的分离、纯化及保存
采用梯度稀释涂布培养的方式稀释所采集的土壤样品,取稀释土悬液200 μL涂布于改良ISP2培养基上,37 ℃条件下静置培养待菌落长出;将长出来的菌落根据不同菌落形态通过平板划线法分别进行分离纯化.将纯化菌株分别划线于无机磷培养基、有机磷培养基和阿须贝无氮培养基进行筛选,并选取在这3种培养基上都能生长的菌株保存于改良ISP2斜面培养基中,4 ℃保存备用;50%(体积分数)甘油按体积比1∶1加入培养的菌液中,-80 ℃保存.
1.3 菌种鉴定
1.3.1 菌落形态特征鉴定
将测试菌株划线于阿须贝无氮培养基上,长出单菌落后观察菌落大小、颜色、表面、透明度、边缘、质地等形态特征.挑取单菌落进行革兰氏染色,显微镜下观察菌体特征.
1.3.2 基于16SrRNA基因序列分子鉴定
采用EasyPure Genomic DNA Kit提取细菌总DNA.采用2×High Fidelity PCR SuperMix进行16SrRNA基因序列扩增,扩增引物为27F(5’-AGAGTTTGATCCTGGCTCAG-3’)和1492R(5’-GGTTACCTTGTTACGACTT-3’).PCR反应体系(50 μL):2×High Fidelity PCR SuperMix 25 μL,引物27F(20 μmol/L)1 μL,引物1492R(20 μmol/L)1 μL,基因组DNA 1 μL,用无菌双蒸水补充至50 μL.PCR反应程序:94 ℃预变性5 min;94 ℃变性45 s,55 ℃退火45 s,72 ℃延伸90 s,33次循环;72 ℃保温10 min.1%(质量分数)琼脂糖凝胶电泳检测:取4 μL PCR反应产物与1 μL DNA上样缓冲液混匀,上样进行电泳检测.根据电泳检测结果将PCR产物送至上海生工生物工程技术股份有限公司测序.将测序结果提交至NCBI(http:∥www.ncbi.nlm.nih.gov)数据库进行Blast序列比对,并分析细菌多样性.
1.4 耐盐、耐碱能力测定
1.4.1 耐盐能力测定
将待测菌株活化后,按1%接种量将菌株分别接种于50 mL改良ISP2液体培养基,37 ℃、180 r/min振荡培养,制备波长600 nm处吸光度(A600)为0.5的菌液悬浮液.
定性测定:取5 μL悬浮液,用微量移液枪分别点种于NaCl质量分数为2%,5%,10%,15%,20%,25%的改良ISP2固体培养基上,37 ℃恒温培养箱倒置培养待菌落长出,观察菌落特征,每组3个平行.
定量测定:按1%接种量将菌株分别接种于NaCl质量分数为2%,5%,10%,15%,20%,25%的50 mL改良ISP2液体培养基中,37 ℃、180 r/min振荡培养24 h后,利用分光光度计测量菌悬液的A600,每组3个平行样.
1.4.2 耐碱能力测定
定性测定:将菌种取5 μL分别接种于pH为5,6,7,8,9,10,11,12的改良ISP2固体培养基上,37 ℃ 恒温培养箱倒置培养待菌落长出,观察菌落特征,每组3个平行样.
定量测定:按1%接种量将菌株分别接种于pH为5,6,8,9,10,11,12(以NaOH计)的50 mL改良ISP2液体培养基中,37 ℃、180 r/min振荡培养24 h后,利用分光光度计测量菌悬液的A600,每组3个平行样.
1.4.3 除盐、除碱能力测定
将待测菌株按1%接种量接种于pH为9、NaCl质量分数为8%的改良ISP2液体培养基中,37 ℃、180 r/min振荡培养,在12,24,36,48 h取样测定.
利用AgNO3溶液滴定法测定菌株除盐能力:取2 mL 发酵液,滴加1滴10%(质量分数)铬酸钾溶液作为指示剂,用0.1 mol/L AgNO3溶液滴定;边滴边摇晃,直至三角瓶中出现砖红色沉淀且颜色不褪去,即为滴定终点;记录AgNO3溶液用量,并计算氯离子浓度,每组3个平行样.c(Cl)=c(AgNO3)×V1/V2.式中:V1为滴定时消耗AgNO3溶液的体积(mL);V2为滴定时所取发酵液的体积,即2 mL.
菌株除盐效率η1=(c(Cl)max-c(Cl)min)/c(Cl)max×100%,式中,c(Cl)max为培养基中Cl-降解前浓度,c(Cl)min为培养基中Cl-降解后浓度.
利用pH计测定发酵液前后pH值,并计算除碱效率η2:η2=(pHini—pHter)/pHini×100%,式中,pHini为接种前的培养基pH,pHter为反应终止时菌株降解后的培养基pH.
1.5 根际细菌生物活性检测
1.5.1 阿须贝无氮培养基中生长能力测定
以1%接种量将待测菌株接种于100 mL阿须贝无氮液体培养基,在37 ℃、180 r/min振荡培养,每2 h 取5 mL发酵液测定(0,2,4,8,10,12,…,72 h),记录A600并绘制生长曲线(3个生物学重复).
1.5.2 溶磷能力测定
采用打孔法在无机磷固体培养基中打4个孔,直径为6 mm,每孔中分别加入50 μL发酵液(108 cfu/mL,cfu为菌落形成单位),3个生物学重复;在37 ℃恒温培养箱中倒置培养15 d后,记录各菌株的溶磷圈直径,初步判断菌株的溶磷能力.
将菌株按1%接种于装有50 mL无机磷液体培养基的100 mL锥形瓶中,置于37 ℃、180 r/min摇床中振荡培养5 d,4 ℃、10 000 r/min离心10 min后取上清液,采用钼蓝比色法测定上清液中有效磷的含量[17].
1.5.3 分泌IAA能力测定
参考Glickmann等[18]的方法,将菌株按1%接种量接种至装有3.0 mL King液体培养基的12.0 mL试管中(添加0.5 g/LL-色氨酸),每组3个生物学重复.37 ℃、180 r/min振荡培养3 d,4 ℃、10 000 r/min离心10 min后取50 μL上清液,加入100 μL Sackowcki’s显色剂,在室温下避光静置15~20 min.观察颜色变化,颜色变红说明能够分泌生长素,且颜色越深表示分泌生长素能力越强.
取上清液加入等体积显色液(10.8 mol/L H2SO4、4.5 g/L FeCl3),混匀避光静置30 min,测定其在波长540 nm处的吸光度(A540).用0.5~20 μg/mL IAA标准液测定并绘制标准曲线,根据标准曲线计算菌液中IAA含量[19].
1.5.4 分泌铁载体能力测定
在CAS固体培养基中打4个直径为6 mm的孔,分别加入50 μL菌液,每组3个生物学重复,置于37 ℃恒温培养箱中培养3~5 d.若菌落周围产生橘黄色晕圈,则该菌株能够分泌铁载体,且黄色圈的直径大小与该菌株分泌铁载体能力大小成正比[20].
1.6 盆栽促生试验
设计3个处理,即空白对照(不加NaCl溶液、不接种根际细菌)、阴性对照(加入300 mmol/L NaCl溶液、不接种根际细菌)和阳性对照(加入300 mmol/L NaCl溶液、接种根际细菌),每组3个生物学重复.选择直径为14 cm的花盆,每盆装入500 g经高温灭菌的土壤,挑选饱满度较好、大小基本一致的黑果枸杞种子在70%(体积分数)乙醇中表面消毒3 min,用灭菌的蒸馏水冲洗3~5次,在37 ℃水浴锅中24 h恒温催芽,每盆中种植5颗种子,放置在12 h光照/12 h黑暗、温度25 ℃/20 ℃条件下培养14 d后,连续3次浇灌NaCl溶液,以保持盐浓度在300 mmol/L.从第4天开始,各菌株在37 ℃、180 r/min振荡过夜培养,4 ℃、10 000 r/min离心10 min后弃上清,沉淀用无菌水洗涤2次后,用无菌水重悬;调节重悬菌液A600=0.50±0.04,取1 mL灌根相应盆中的幼苗.同时,阴性对照组和空白对照组用NaCl溶液和无菌水灌根培养,每隔2 d灌根一次.培养60 d后,盆中黑果枸杞连根拔起,用蒸馏水冲洗干净后擦干称量,记录为鲜质量(g);随后放入干燥箱中75 ℃干燥24 h再称量,记录为干质量(g).用游标卡尺测量其株高(cm)和根长(cm);另测定叶绿素含量及叶片数等指标.
1.7 耐盐碱根际细菌系统进化树构建
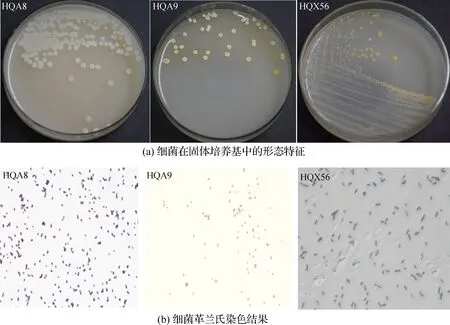
图1 黑果枸杞根际3株代表性细菌的菌落形态Fig.1 Morphology of three typical bacterial colonies in rhizosphere of L.ruthenicum
根据基于16SrRNA基因测序的Blast比对结果,选取所需的参照菌株及其16SrRNA基因序列,采用MEGA7.0软件通过邻接法构建系统进化树.
2 结果与分析
2.1 根际土壤理化性质
鄯善县野生黑果枸杞根际土壤理化性质测定结果显示:根际土壤pH为8.86,总盐含量为0.838 mg/g,根际土壤有机质含量为2.66 g/kg,总氮含量为0.16 g/kg,速效磷3.37 mg/kg,Na+0.843 mg/g,K+0.043 mg/g,Mg2+0.086 mg/g,Cl-0.990 mg/g,SO42-0.556 mg/g.可见鄯善县黑果枸杞根际土壤属于有机质、氮、磷元素严重匮乏,微量元素不平衡的极端盐碱土壤.
2.2 根际细菌的筛选
采用4种不同培养基分离鄯善县黑果枸杞根际土壤样品,获得110株根际细菌.经过菌株形态、颜色、黏稠性及生长大小的不同重排结果后得到37株根际细菌,各菌落形态及菌体特征见附录(http:∥jxmu.xmu.edu.cn/upload/html/20220516)表S1.图1(a)与(b)显示其中3株代表性菌株在固体培养基上及显微镜下的革兰氏染色结果.
测序得到的16SrRNA基因序列提交至NCBI数据库进行Blast序列比对发现,筛选所得的37株根际细菌分别属于9个属,其中芽孢杆菌属(Bacillus)为优势菌属(22株),其次为链霉菌属(Streptomyces,4株),此外分别为节杆菌属(Arthrobacter,2株)、类芽孢杆菌属(Paenibacillus,2株)、假单胞菌属(Pseudomonas,2株)、杆菌属(Bacterium,2株)、短芽孢杆菌属(Brevibacillus,1株)、葡萄球菌属(Staphylococcus,1株)、肠杆菌属(Enterobacter,1株),与其相似菌B.halotoleransDSM 8802(MN483266)、B.rugosusSPB7(MK453326)、B.subtilissubsp. HUB-I-047(GQ892930)、PriestiamegateriumIAM 13418(AF311995)、B.paramycoidesMCCC 1A04098(KJ812444)、P.putidaATCC12633(JN630890)等菌株的相似度为99%或100%.
2.3 根际细菌的耐盐、耐碱及除盐、除碱能力
2.3.1 耐盐、耐碱能力
37株根际细菌分别在NaCl质量分数为2%~25%的改良ISP2液体培养基和pH为5~12的改良ISP2液体培养基中接种培养,结果显示(图2):其中10株根际细菌兼有较好的耐盐及耐碱能力,在NaCl质量分数为2%~20%和pH为5~11的液体培养基中均能生长,其生长最适NaCl质量分数为5%,最适pH为7,其中菌株HQA8、HQA9、HQX34和HQX56耐盐、耐碱的综合能力最好.
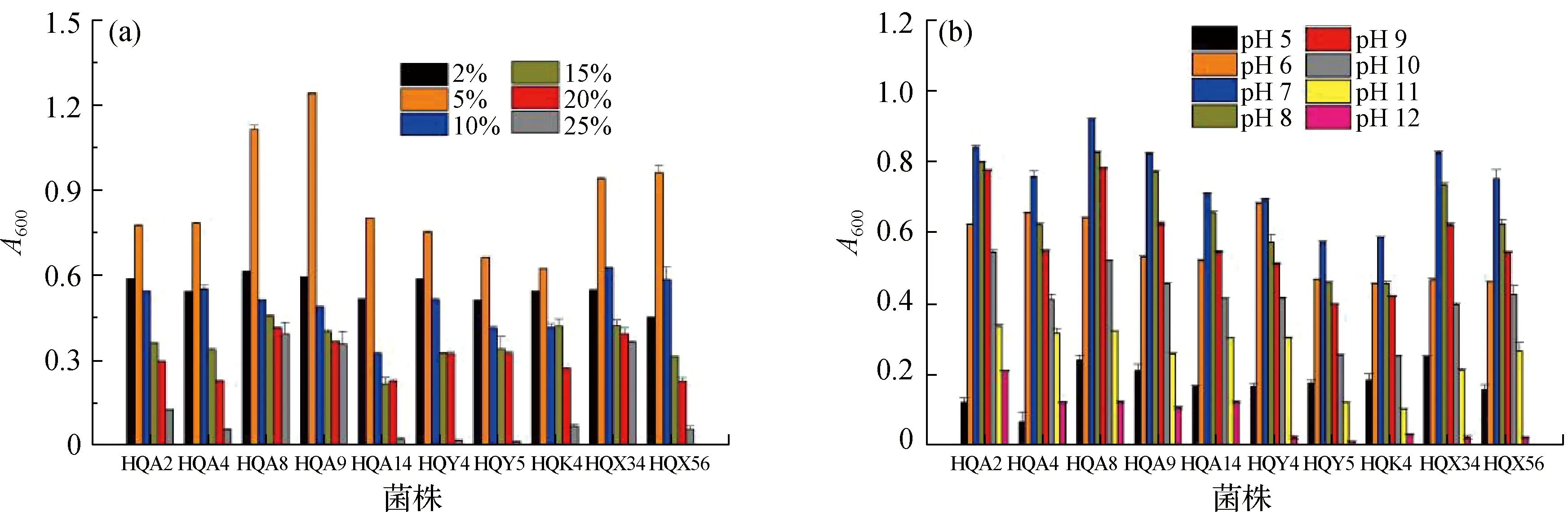
图2 10株根际细菌的耐盐(a)和耐碱(b)能力Fig.2 Salt tolerance (a) and alkali tolerance (b) abilities of 10 rhizosphere bacteria
2.3.2 除盐、除碱能力
根据耐盐、耐碱能力实验结果,将上述10株根际细菌分别在pH为9、NaCl质量分数为8%的改良ISP2液体培养基中接种培养,结果显示(图3):10株根际细菌培养至36 h时除盐、除碱效率最高,其中菌株HQA8的除盐、除碱效率分别达到最高值75%和46%.
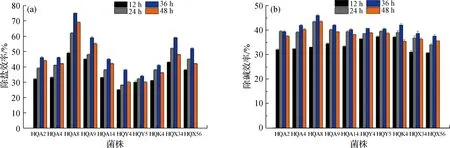
图3 10株根际细菌的除盐(a)和除碱(b)能力Fig.3 Desalination (a) and alkali removal (b) abilities of 10 rhizosphere bacteria
2.4 根际细菌的生物活性
2.4.1 根际细菌在阿须贝无氮培养基中的生长曲线
10株根际耐盐碱细菌在阿须贝无氮液体培养基中的生长情况如图4所示:在6 h左右进入对数生长期,26 h左右对数生长期达到最高值,30 h左右进入生长平台期,32~46 h生长曲线略有下降趋势,46 h左右进入生长衰竭期.可见这10株菌株在阿须贝无氮培养基中对数生长期和平台期时间较长,表明其具有一定的固氮能力.
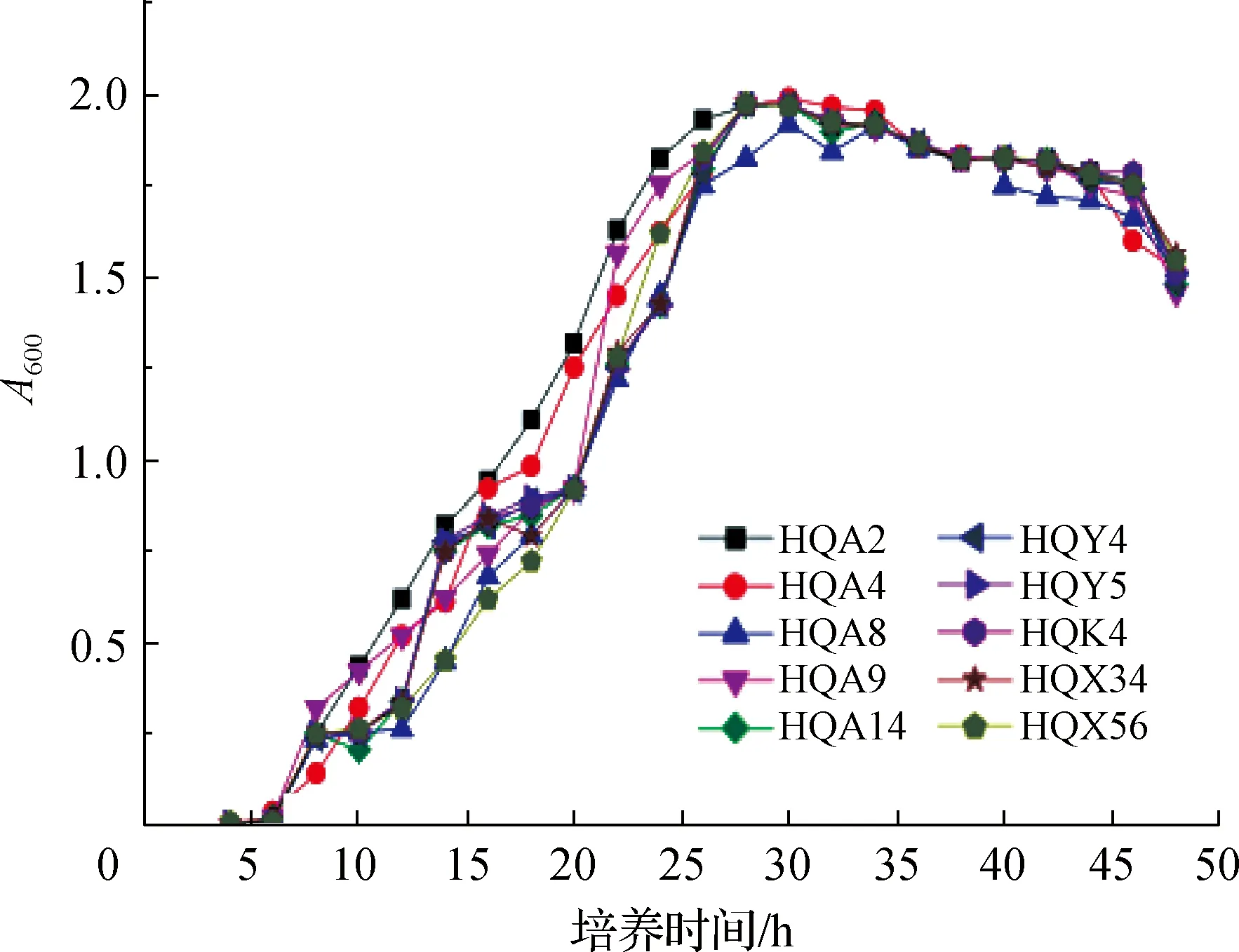
图4 10株根际细菌在无氮培养基中的生长曲线Fig.4 Growth curves of 10 rhizosphere bacteria in nitrogen-free medium
2.4.2 溶磷能力
10株耐盐碱根际细菌在NaCl质量分数为5%的无机磷固体培养基上培养15 d后进行溶磷能力测定,结果显示:10株根际细菌产生大小不同的溶磷圈,溶磷圈直径为8.5~23.6 mm,其中菌株HQA2的溶磷圈直径最大,达23.6 mm(图5(a)).进而将10株根际细菌在无机磷液体培养基中培养5 d,结果显示:10株根际细菌的溶磷量为28.20~52.63 mg/L,其中HQA2的溶磷量最大,达52.63 mg/L,与产溶磷圈实验结果一致;同时,无机磷液体培养基的pH值由初始的9降低至4.82~5.55(图5(b)).

图5 10株根际细菌溶磷圈直径(a)及溶磷量和培养基的pH值(b)Fig.5 Diameters of phosphate solubilizing zones of 10 rhizosphere bacteria (a), and their phosphorus solubilization amount and pH value of culture medium (b)
2.4.3 分泌IAA能力
对上述10株根际细菌在培养48,60,72 h的产IAA能力进行测定,结果显示:10株根际细菌均具有大小不同的产IAA能力,其中菌株HQA2产IAA能力最强,在60 h达到最大值54.21 mg/L(图6).
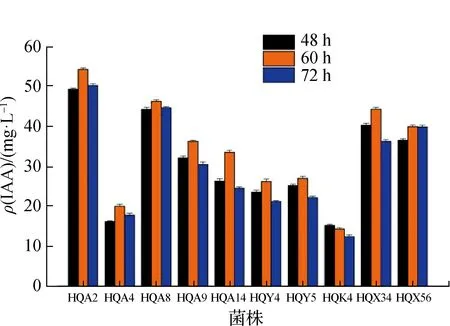
图6 10株根际细菌在不同时间的IAA产量Fig.6 IAA production of 10 rhizosphere bacteria at different time
2.4.4 分泌铁载体能力
进一步对上述10株根际细菌进行产铁载体能力测定,结果显示:各菌株在CAS固体培养基上产生大小不同的黄色晕圈,可以初步判断这10株根际细菌均具有产铁载体的能力,其中菌株HQA2周围所产生的黄色晕圈直径最大,为37.25 mm(图7).
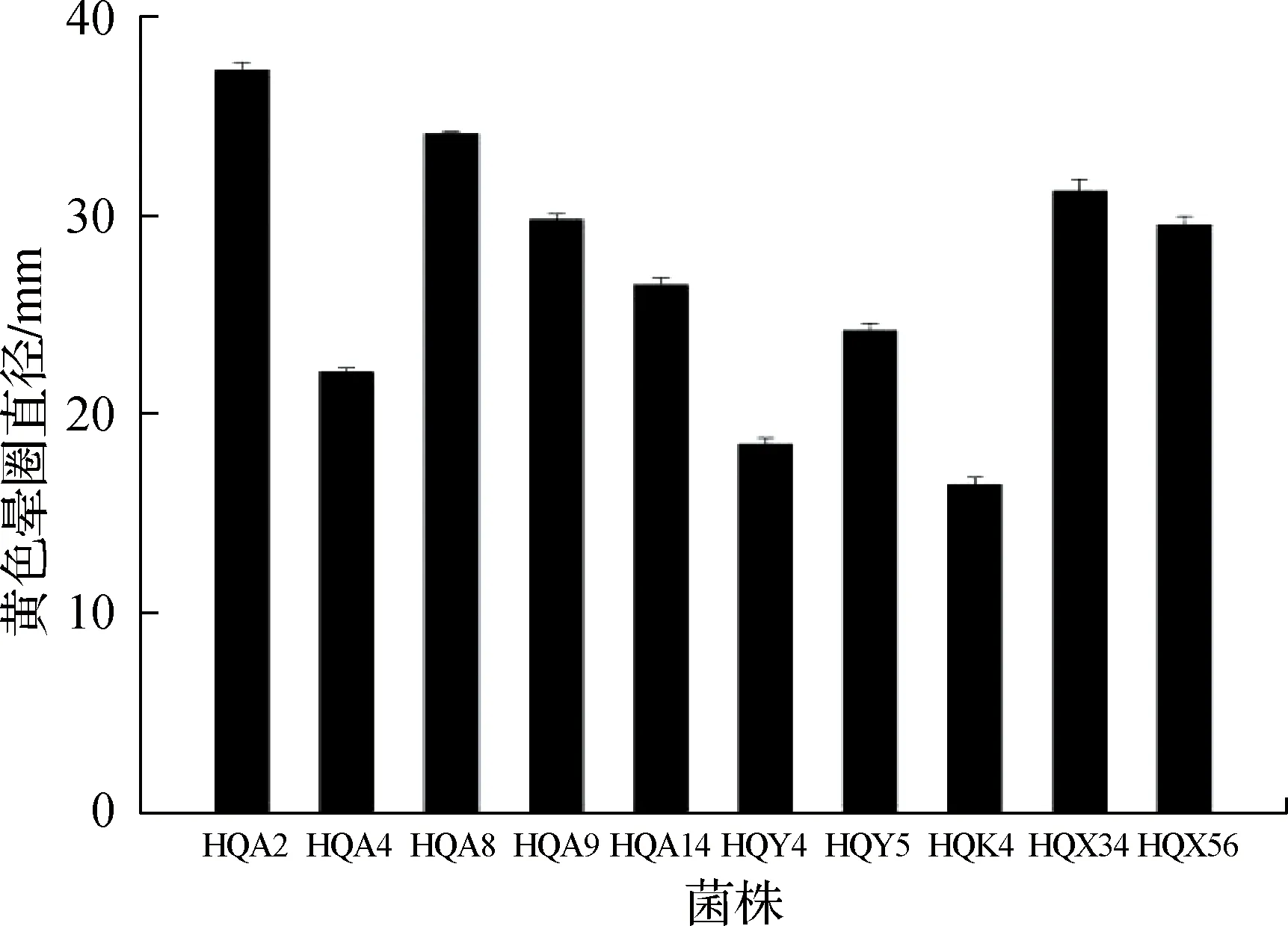
图7 10株根际细菌在CAS固体培养基上产生的黄色晕圈直径Fig.7 Diameters of surrounding yellow circles produced by 10 rhizosphere bacteria on CAS solid medium
采用CAS检测方法[20]测定各菌株A/Ar的值(A表示CAS液体培养基的吸光度,Ar表示菌液吸光度,A/Ar表示铁载体的相对含量,其值越大表示铁载体相对含量越低).结果如表1所示:HQK4的A/Ar值最大,约1.98;HQA2的A/Ar值最小,约0.62.
2.5 盐胁迫下接种根际细菌对黑果枸杞幼苗生长的影响
基于以上10株根际细菌的耐盐、耐碱、除盐、除碱能力以及溶磷能力、产IAA能力和产铁载体能力的分析结果进行盆栽试验.结果显示:与空白对照组相比,阴性对照组的黑果枸杞幼苗生长受到严重抑制,鲜质量、干质量、株高、叶片数和叶绿素含量较空白对照组分别减少69.4%,86.2%,42.4%,28.5%和32.7%.分别用10株耐盐碱根际细菌处理植株,与阴性对照组相比,各根际细菌对黑果枸杞幼苗生长有不同程度的促进作用,其中菌株HQA8处理的黑果枸杞幼苗各项指标与阴性对照组相比促进作用最明显,鲜质量、干质量、株高、叶片数和叶绿素含量较阴性对照组分别增加300.0%,725.0%,54.6%,44.8%和49.3%(表2).
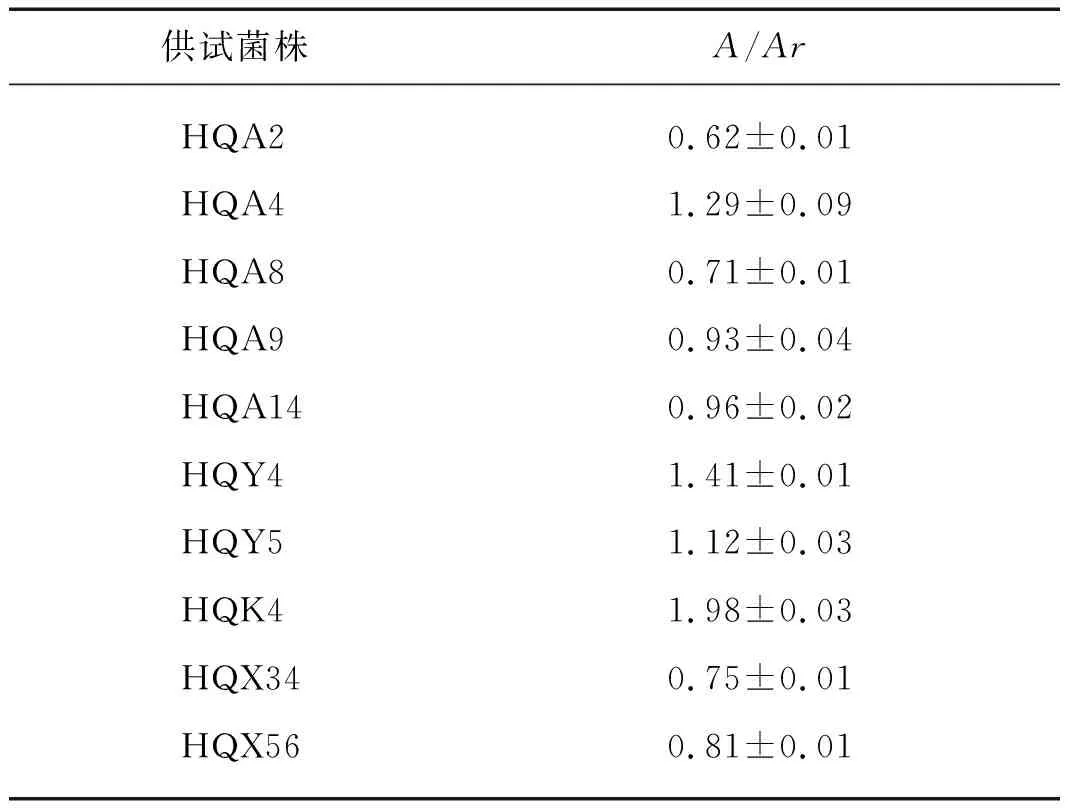
表1 10株根际细菌产铁载体量Tab.1 Iron carrier production of 10 rhizosphere bacteria
2.6 根际耐盐碱菌株鉴定
将测序所得16SrRNA基团序列提交至NCBI数据库进行Blast序列比对,并将序列提交GenBank,获得10株根际耐盐碱细菌的登录号.构建菌株系统进化树的结果显示:菌株HQA9、HQA4与B.halotoleransDSM 8802(MN483266),菌株HQA2、HQK4、HQY5、HQX56与B.rugosusSPB7(MK453326),菌株HQA8与B.subtilissubsp. HUB-I-047(GQ892930),菌株HQA14与P.megateriumIAM 13418(AF311995),菌株HQX34与B.paramycoidesMCCC 1A04098(KJ812444),菌株HQY4与P.putidaATCC 12633(JN630890)的序列具有最高同源性(图8).
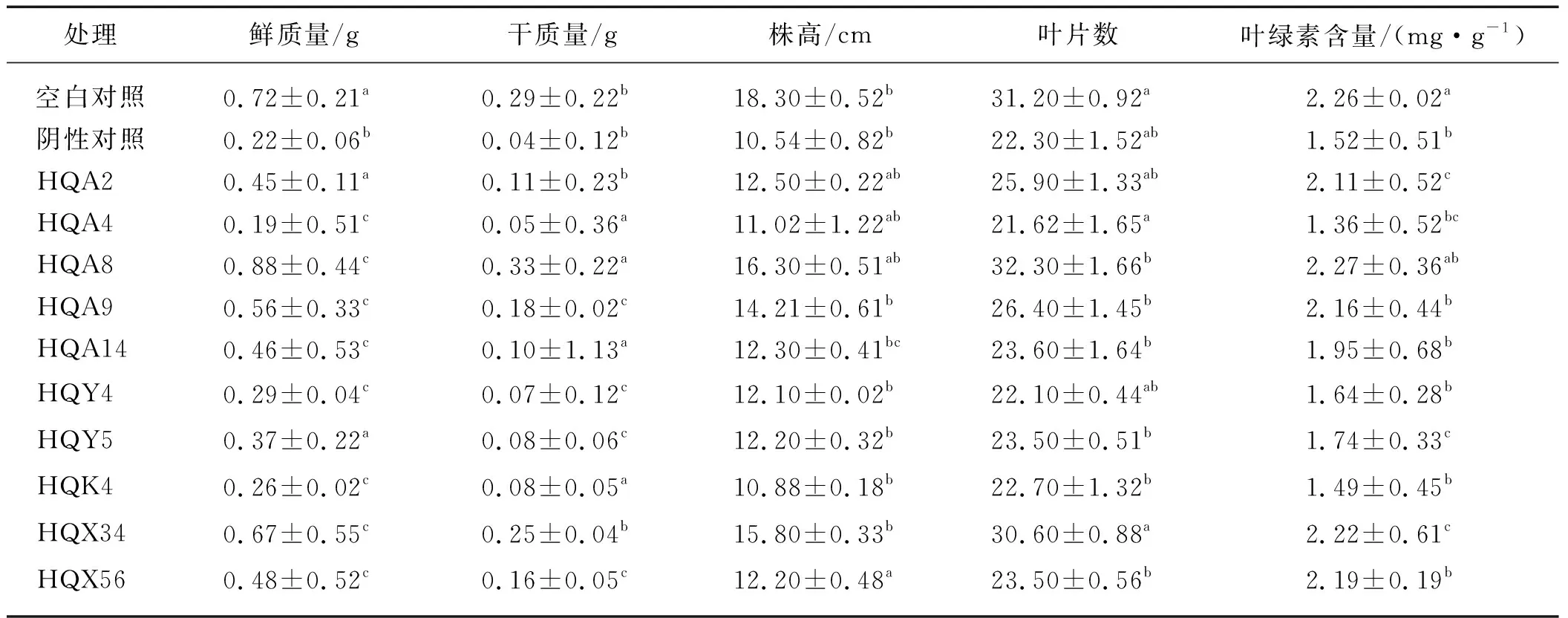
表2 不同根际细菌处理对黑果枸杞幼苗生长的影响Tab.2 Effects of different rhizosphere bacterial treatments on the growth of L.ruthenicum seedlings
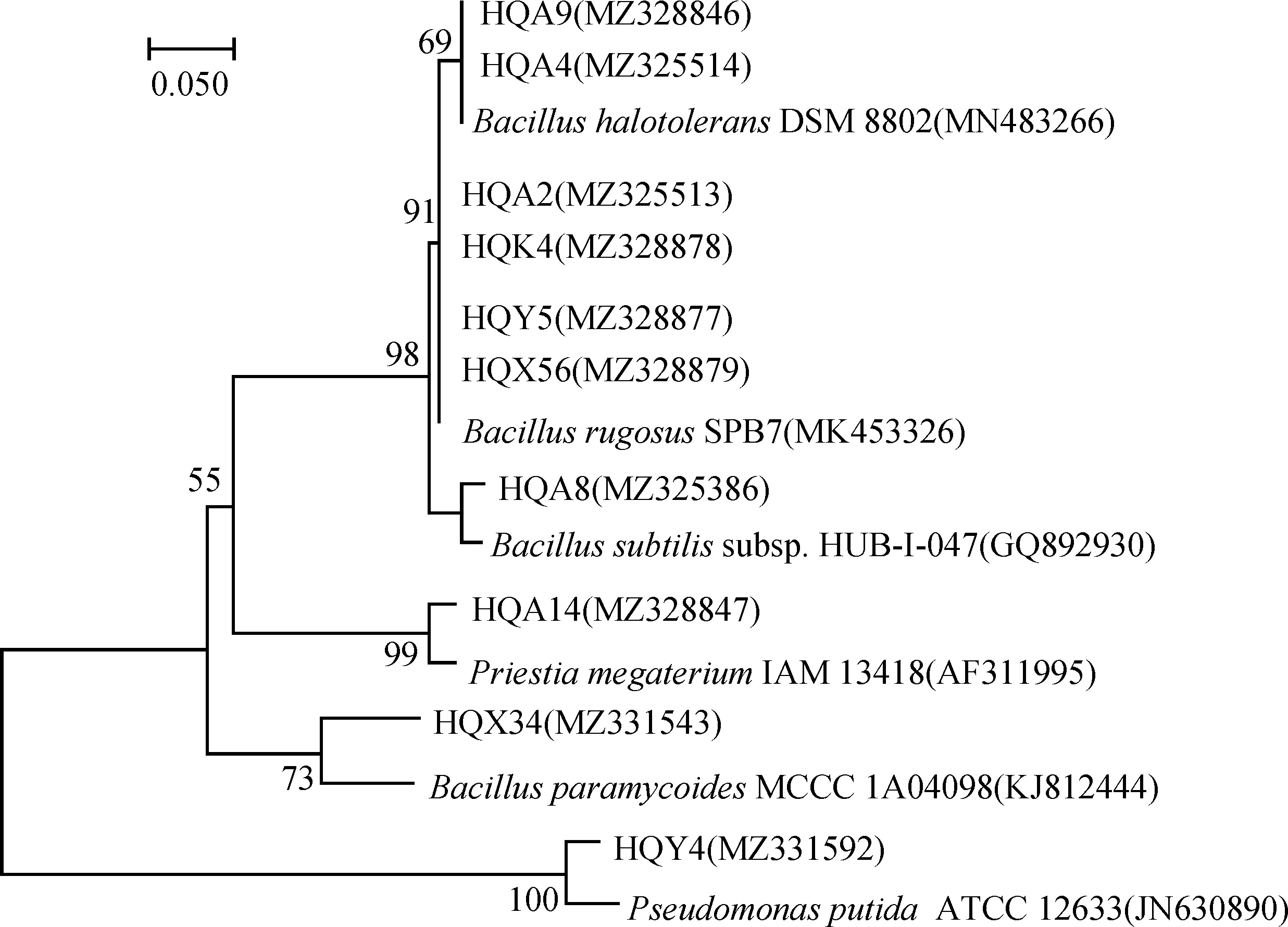
图8 基于10株根际耐盐碱细菌16S rRNA基因序列的系统进化发育树Fig.8 Phylogenetic tree based on 16S rRNA gene sequences of 10 rhizosphere saline alkali tolerant bacteria
3 讨 论
土壤盐碱化是世界上最严重的环境问题之一.我国的盐碱化土壤主要分布在我国西北干旱半干旱的甘肃、新疆等地区,尤其是新疆受不同程度盐碱危害的耕地面积约占新疆耕地总面积的1/3[21].土壤盐碱化造成的植物营养不足、微量元素极度缺乏等会抑制植物的正常生长.通过文献与实地调研了解到,新疆吐鲁番地区鄯善县黑果枸杞种植基地为干燥、高温、多风、年均降水量低、蒸发强烈、水资源和土壤营养元素匮乏的极端盐碱内陆荒漠区[22-23].对新疆鄯善县根际土壤理化性质进行分析,发现该土壤的pH值和盐含量偏高,属于有机质及氮、磷元素严重匮乏,微量元素不平衡的极端盐碱地,因此确保黑果枸杞生产稳定的重要措施之一就是合理施肥种植技术.然而,施用大量的化肥会造成土壤养分流失、水土失衡、土壤板结、盐碱化程度加深、土壤源污染等生态问题;而微生物肥料的出现则降低了化学肥料使用量,有利于保护农业生态环境.
微生物群落多样性和组成在不同生境的差异性与土壤理化性质密切相关,不同生境下根际微生物群落有所不同[24].刘国强等[25]对新疆阿克陶县黑果枸杞根际促生菌的筛选及促生能力分析研究表明,链霉菌属、芽孢杆菌属、微杆菌属(Microbacteriumsp.)为阿克陶县黑果枸杞根际微生物中的优势属.李岩等[26]对新疆精河县、乌苏市、路旁荒地和五家渠等不同生境下黑果枸杞根际与非根际土壤微生物群落多样性的研究报道中,已验证Haliea、Pelagibius、Microbulbifer、Acidobacteria Gp10、假单胞菌属等是北疆地区黑果枸杞根际土壤细菌优势属.张春林等[27]在寒旱区对柠条(Caraganakorshinskii)根际细菌群落结构与多样性的研究发现:3个不同地区优势菌种的丰度存在较大差异,同地区不同取样点微生物分布具有更多相似性;不同地区间乌兰察布和赤峰间的微生物组成相对更接近,表明柠条根际微生物结构在同一地域具有一定的稳定性和均匀性,而随着地域不同显示出一定差异性,这可能与土质、气候条件等有关.本研究从黑果枸杞根际土壤中分离与纯化具有耐盐、耐碱以及除盐、除碱能力的微生物,并进行各种生物活性的测定,为改良根际土壤微生物生态环境、开发天然无害微生物肥料、提高植物胁迫耐受性等问题提供了理论依据.
本研究从生长在新疆鄯善县盐碱区的黑果枸杞根际土壤中筛选出110株根际微生物,根据菌落形态和生长特性选择37株进行16SrRNA基因序列比对,发现共9个属的25种,其中芽孢杆菌属为优势菌属;对这37株菌进行耐盐、耐碱及除盐、除碱能力的测定并筛选,其结果显示菌株HQA2、HQA4、HQA8、HQA9、HQA14、HQY4、HQY5、HQK4、HQX34和HQX56具有较好的耐盐、耐碱能力,这一结果与宋郭柳等[28]筛选所得耐盐菌的耐盐能力结果相似.本研究筛选的10株根际细菌在不同时间阶段除盐、除碱能力不同,培养至36 h时菌株HQA8的除盐、除碱率达最高值,分别为75%和46%;而赵媛等[29]从青海湖分离的耐盐微生物除盐效率最高达17.30%,除碱效率最高达7.60%.进一步研究生物活性测定发现,10株根际耐盐碱菌均能在阿须贝无氮培养基中生长,这一结果与靳海洋等[30]关于稻田土壤固氮菌的分离筛选以及促生潜力研究的报道一致.此外,这10株耐盐碱根际细菌均有不同大小的溶磷、产IAA和产铁载体等能力.Patel等[31]在盐碱环境中筛选的15株溶磷菌的最大溶磷量为45 mg/L,刘国强等[25]在新疆阿克陶县盐碱土壤中筛选的根际促生菌的最大溶磷量为49.97 mg/L,本研究筛选得到的10株根际细菌的溶磷量为28.20~52.63 mg/L,同时无机磷液体培养基的pH值由初始的9降低到4.82~5.55,可以初步判断这些菌株既能提高土壤肥力又能降低土壤碱性环境,从而实现盐碱化土壤的生物改良.
菌株HQA2在60 h时产IAA含量达到最高值54.21 mg/L,且随后10株根际细菌产IAA能力总体开始减弱,可能是由于后期营养不足所致;参考Datta等[32]的研究报道,也可能是由于在一定时间段内IAA降解酶(如IAA氧化酶和过氧化物酶)的释放使产生的IAA被降解所致.土壤根际微生物所产生的铁载体可以抑制有害病原菌并促进植物生长[33].本研究中10株根际细菌都有不同大小的产铁载体的能力,提示这些菌株可能具备抑制病原菌的特性.
盆栽试验结果显示,施用10株耐盐碱根际细菌对黑果枸杞幼苗生长有明显的促进作用,其中菌株HQA8处理下各项指标与阴性对照相比增加幅度最大.叶绿素含量的增加可以间接促进植物的光合作用,Nadeem等[34]证实在盐胁迫下根际促生菌处理植物可以使叶绿素含量增加,而且大幅度提高了植物的光合作用效率.在盐胁迫下,这10株耐盐碱根际细菌可以有效地缓解盐害对黑果枸杞幼苗生长的抑制.
综上,本研究筛选得到10株黑果枸杞耐盐碱根际细菌,并测定了这些菌株的除盐、除碱、固氮、溶磷、分泌IAA以及分泌铁载体等生物特性,最后对其综合能力给予评价:其中菌株HQA8、HQA9、HQX56、HQX34和HQA2有较高的促进植物生长的潜力,其次为HQA14、HQY4、HQY5、HQA4和HQK4.这些结果可为生物菌肥开发提供优良菌株,为改良土壤极端环境和扩大适用范围提供理论依据.

