细胞自噬对拟南芥种子萌发的影响
李喜豹, 张佳素, 周鹏康, 高颖苗, 陈春苗, 高彩吉, 杨 超, 沈文锦
(华南师范大学生命科学学院/广东省植物发育生物工程重点实验室, 广州 510631)
细胞自噬是依赖于液泡的一种蛋白质和细胞器降解途径,参与调控细胞成分降解、更新、结构重建及逆境胁迫条件下营养成分的再利用,从而在植物正常生长发育与环境胁迫响应中发挥重要作用。目前,在模式植物拟南芥中已鉴定得到40多个自噬相关基因(Autophagy-related genes,ATGs),这些自噬基因编码蛋白相互协作,参与调控植物细胞自噬过程[1]。细胞自噬的发生受到细胞内多种信号网络的严格调控。自噬的激活可以看作一种细胞应激反应,植物细胞可以感受多种环境信号(如营养匮乏、高温、低温、低氧、高盐和植物激素等)[2-10],适时地激活自噬途径而帮助细胞清除逆境胁迫所诱发的有毒有害物质的积累,并协调植物不同组织、器官内营养成分的循环利用,从而使植物更好地存活[11-12]。细胞自噬也可以被程序性地激活,从而参与调控植物特定组织、器官的发育,例如调控叶片的衰老、花粉的萌发和种子的成熟等过程[9,13-21]。但未知细胞自噬是否参与调控植物种子萌发。
种子萌发是指有活力的种子吸胀后,重新开始物质合成与代谢活动,促使胚根露出种皮的过程,是种子植物生命周期的起始[22]。种子萌发极易受到光照、温度、水分和盐分等外部环境因素的影响[22],而这些外部环境都可以调控细胞自噬的活性[2-10]。拟南芥为十字花科植物,其种子为典型的油料种子,其萌发分为4个阶段:第1阶段,种子快速吸水膨胀,胚根突破种皮;第2阶段,生理代谢激活,胚根继续生长突破胚乳;第3阶段,胚乳内营养物质快速分解,胚根迅速生长;第4阶段,胚芽突破种皮,长出子叶[22]。在拟南芥种子萌发过程中,植物激素发挥重要调控作用。在种子萌发早期,赤霉素(GA)可以拮抗脱落酸(ABA),促进种子萌发过程,在种子萌发早期和晚期均发挥重要作用[23-27]。研究[5]表明,GA处理还可以诱导拟南芥细胞自噬,并促进细胞内有害物质的清除而维持细胞内稳态。但细胞自噬是否也会在GA调控的种子萌发过程中发挥作用还不清楚。
本研究以拟南芥为材料,通过分析种子萌发过程中的自噬基因表达和蛋白积累,证实在拟南芥种子萌发过程中细胞自噬途径被激活;并通过比较分析种子萌发情况,发现拟南芥自噬突变体种子的萌发速度比野生型种子的慢,说明自噬的确参与了种子萌发的过程。
1 材料与方法
1.1 植物材料
拟南芥(Arabidopsisthaliana)野生型Columbial(Col-0)种子和突变体atg5-1(SAIL_129_B07)、atg7-2(GK-655B06)种子均由本实验室保存。
1.2 实时荧光定量PCR
称取100 mg在w(琼脂)=0.8%的固体培养基上萌发3、17、30、40、50 h的拟南芥野生型种子,于液氮中彻底研磨后,采用TIANGEN植物总RNA提取试剂盒(DP432)提取拟南芥种子的总RNA,然后用TransGen反转录试剂盒(AT311-02)进行反转录,从而得到cDNA。将得到的cDNA稀释10倍后,采用TaKaRa荧光定量试剂盒(SYBR Green Mix,DRR041A),利用Bio-Rad CFX96荧光定量PCR仪进行PCR分析。以AtUBQ10为内参基因,最终采用2-△△CT方法计算自噬基因的相对表达量。所用引物序列见表1。

表1 本研究所用引物信息
1.3 ATG8蛋白免疫印迹实验
称取100 mg在w(琼脂)=0.8%的固体培养基上萌发3、17、50、80 h的拟南芥野生型种子,于液氮中彻底研磨后,加入300 mL的总蛋白提取缓冲液 (0.5 mol/L三(羟甲基)氨基甲烷(Tris-HCl),pH 6.8;w=5%的十二烷基硫酸钠(SDS),φ=20%的甘油,φ=10%的β-巯基乙醇,0.2 mg/L溴酚蓝)充分研磨后,将提取液倒入1.5 mL的EP管中,在95 ℃的金属浴中加热10 min后,13 000 r/min离心10 min,所得上清液即为种子总蛋白。取20 μL蛋白样品,使用w=15%的SDS-PAGE胶进行电泳,最后转PVDF膜,使用anti-ATG8 (抗体按1∶3 000稀释使用)检测种子萌发过程中ATG8蛋白的积累情况,使用Histone 3抗体(anti-H3)检测内参蛋白Histone 3的表达水平。最终采用Image J软件分析ATG8蛋白条带和Histone 3蛋白条带的灰度值。ATG8抗体由华南农业大学李发强教授惠赠,Histone 3抗体购自Abcam公司。
1.4 种子萌发实验
1.4.1 3-MA处理 将拟南芥野生型种子经φ=30%的次氯酸钠溶液表面消毒后,平铺在分别添加有0.0、0.5、1.0、2.0 mmol/L的w(琼脂)=0.8%的固体培养基上,于22 ℃、全日照培养箱中培养,并在培养30、42、48、72、96、120 h后使用体式显微镜拍照并统计种子萌发率(以胚根突破种皮为萌发标准)。每个实验重复3次,每次重复不少于100粒种子。
1.4.2 自噬突变体种子萌发 将相同批次拟南芥野生型种子和自噬突变体atg5-1、atg7-2种子经φ=30%的次氯酸钠溶液表面消毒后,平铺在w(琼脂)=0.8%的固体培养基上,于22 ℃、全日照培养箱中培养,并在培养30、42、48、72 h后使用体式显微镜拍照并统计种子萌发率。每个实验重复3次,每次重复不少于100粒种子。
1.4.3 PAC处理 将相同批次拟南芥野生型种子和自噬突变体atg5-1、atg7-2种子经φ=30%的次氯酸钠溶液表面消毒后,分别平铺在添加有1 mol/L PAC的w(琼脂)=0.8%的固体培养基上和1 mol/L PAC+10 mol/L GA3的w(琼脂)=0.8%的固体培养基上,于22 ℃、全日照培养箱中培养,并在培养后24、48、72、96、120 h后使用体式显微镜拍照并统计种子萌发率。每个实验重复3次,每次重复不少于100粒种子。
1.5 数据处理
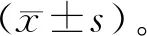
2 结果与讨论
2.1 种子萌发时间段确定
种子萌发受湿度、光照、温度等环境因子及种子质量、活力等内在因素的影响,为了确定后续自噬基因表达分析和蛋白检测的最佳取样时间点,使用收获后室温存储2个月的拟南芥野生型种子进行种子萌发实验。实验条件为:温度22 ℃,全光照(光照强度为120 μmol/(m2·s)),w(琼脂)=0.8%的固体培养基作为基质保湿。结果发现,在w(琼脂)=0.8%的固体培养基上培养3、17 h后,种子均未萌发;在30 h时,种子种皮破裂,个别种子的胚根突破胚乳;在40 h时,大部分种子的胚根已突破胚乳,胚根伸出,少数种子尚未萌发;在50 h时,种子均已萌发,部分种子开始长出子叶。结合文献[22],确定本实验条件下拟南芥野生型种子萌发的5个关键时间点为:种子铺板后的第3 h(完成第一阶段吸涨过程)、17 h(完成第二阶段吸涨过程)、30 h(种皮破裂)、40 h(胚根突破胚乳,胚根伸出)和50 h(子叶生长)。
2.2 种子萌发过程中自噬对基因表达的影响
为了探究种子萌发过程是否与自噬作用相关,通过荧光定量PCR检测了ATG4b、ATG5、ATG6、ATG7、ATG8、ATG9和ATG10等12个自噬相关基因在拟南芥野生型种子萌发3、17、30、40、50 h后的基因表达情况(图1)。研究结果表明:在种子萌发过程中,自噬基因显著上调表达,其中ATG8b、ATG8f和ATG10在种子萌发17 h时,相对于萌发早期(3 h),相对表达量上升超过10倍,而其他自噬基因也都有2~6倍的上调表达;而在种子萌发中后期(30~50 h),虽然ATG8b、ATG8c、ATG8d、ATG8f和ATG10的相对表达量相对于17 h时有所下降,但依然比种子萌发早期的相对表达量高;而其他自噬基因(如ATG4b、ATG5和ATG9)则持续高表达。

图1 种子萌发不同阶段的自噬基因表达量
2.3 种子萌发过程中对ATG8蛋白量的影响
为了进一步确定种子萌发过程中细胞自噬的激活,提取拟南芥野生型种子萌发不同时间点的总蛋白,使用蛋白免疫印迹实验检测ATG8蛋白的积累。结果(图2)表明:随着种子萌发时间延长,ATG8蛋白逐渐增多,表明在该过程中细胞自噬被逐渐激活。
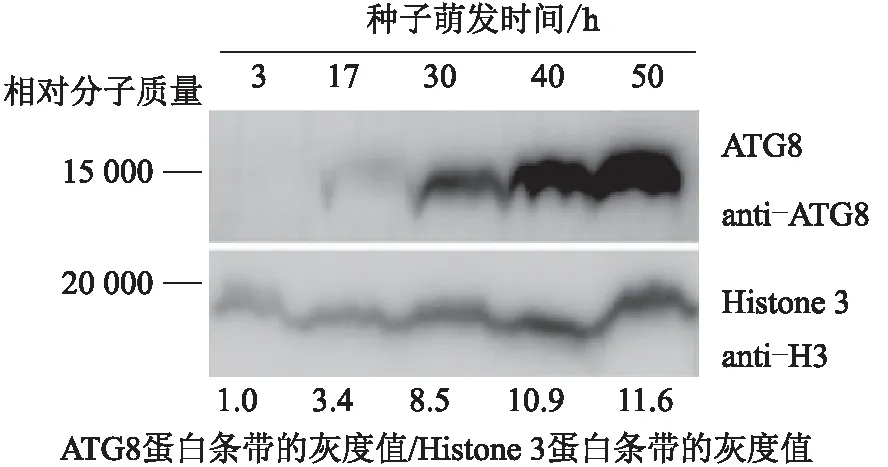
图2 拟南芥野生型种子萌发过程中ATG8蛋白表达
2.4 自噬抑制剂(3-MA)处理对拟南芥种子萌发的影响
3-甲基腺苷(3-methyladenine,3-MA)是一种磷脂酰肌醇-3激酶(phosphatidylinositol-3-kinase,PI3K)的抑制剂,可以有效抑制细胞自噬[28]。通过设定4个浓度梯度实验,分析3-MA是否通过抑制细胞自噬功能来影响种子萌发进程。结果(图3)表明自噬抑制剂3-MA可以抑制拟南芥野生型种子萌发,且抑制效果具有浓度和时间梯度特征:(1)3-MA可以显著抑制种子萌发和后续幼苗生长(图3A)。(2)在同一时间点,随着3-MA浓度的升高,种子萌发率依次降低;当3-MA浓度达到2 mmol/L时,种子在96 h后才完全萌发,比不添加3-MA的条件下延迟了48 h(图3B)。
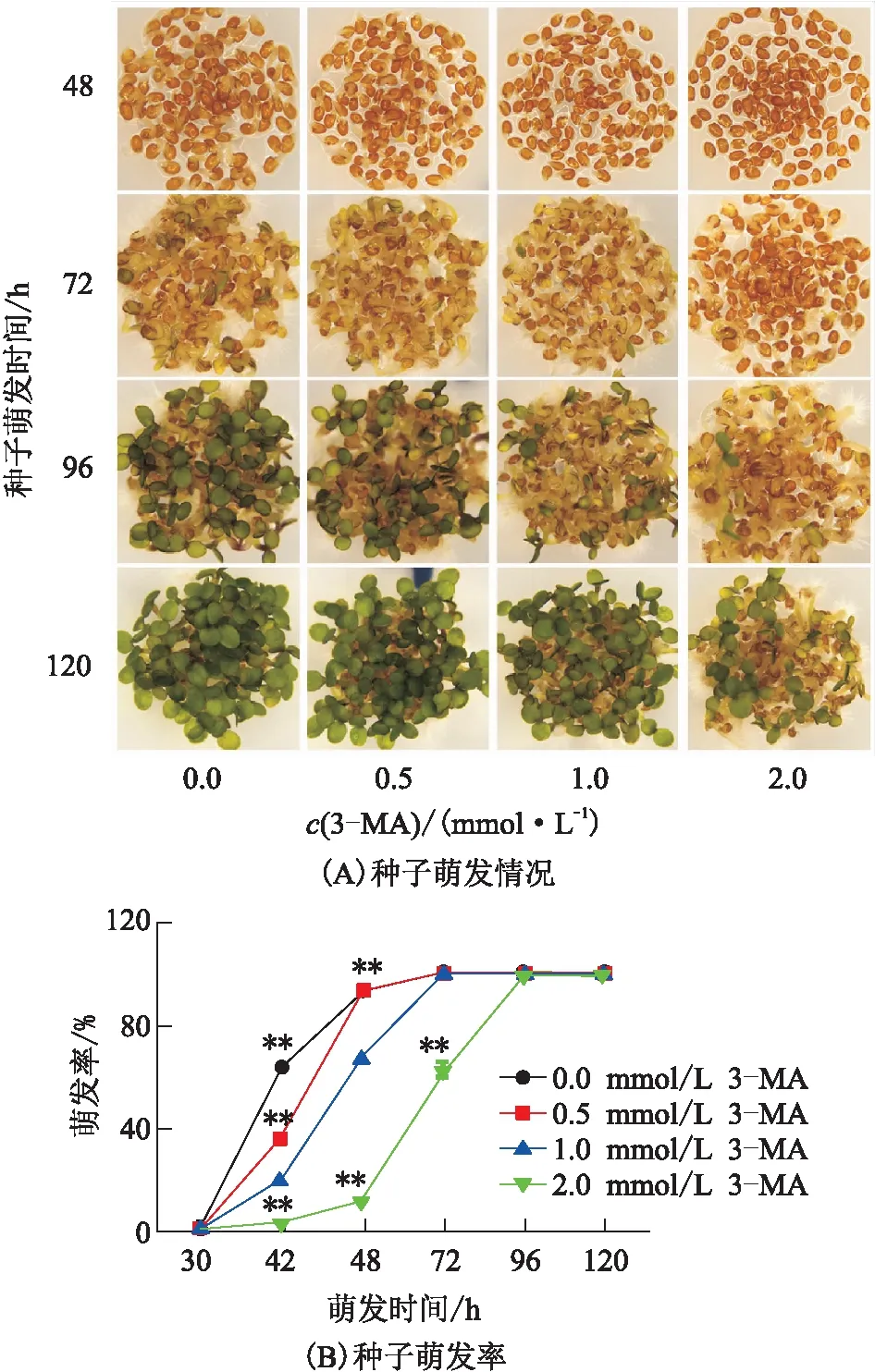
图3 不同浓度的3-MA处理对拟南芥野生型种子萌发及幼苗生长的影响
2.5 自噬突变体种子与野生型种子的萌发速率比较
为了直观分析自噬是否影响种子萌发,比较分析了拟南芥野生型种子和自噬突变体atg5-1、atg7-2种子的萌发速率。结果(图4)表明细胞自噬不是种子萌发所必需的,但自噬途径缺失会减缓种子的萌发:在42 h时,拟南芥野生型种子的萌发率为60%,而自噬突变体种子的萌发率为45%;在48 h时,拟南芥野生型种子全部萌发完成,而自噬突变体种子的萌发率为95%;在72 h时,自噬突变体种子才全部萌发。

图4 拟南芥自噬突变体种子的萌发速率
2.6 PAC处理对自噬突变体种子萌发的影响
种子萌发过程中,植物激素赤霉素(GA)会促进种子萌发。为了进一步研究细胞自噬在GA调控的种子萌发过程中是否发挥作用,本文比较了拟南芥野生型种子和自噬突变体种子在GA合成抑制剂(PAC)处理条件下的萌发速率。由结果(图5)可知:1 μmol/LPAC处理5天后,拟南芥野生型种子的萌发率达到100%,自噬突变体atg5-1、atg7-2种子的萌发率分别仅为15%、30%,表明拟南芥自噬突变体对PAC处理超敏感。

图5 1 μmol/L PAC处理对拟南芥野生型种子和自噬突变体种子萌发的影响
用GA和PAC同时处理拟南芥野生型种子和自噬突变体atg5-1、atg7-2种子,结果(图6)表明:处理3天后,拟南芥野生型种子和自噬突变体种子的萌发率均达到100%,表明拟南芥自噬突变体的种子萌发对PAC处理的超敏感确实是由于抑制了GA造成的。

图6 1 μmol/L GA和1 μmol/L PAC处理3天对拟南芥野生型种子和自噬突变体种子萌发的影响
3 讨论
在拟南芥野生型种子的萌发过程中,自噬基因持续上调表达(图1),并且细胞自噬重要调控蛋白ATG8在种子萌发过程中逐渐积累(图2),表明在种子萌发过程中细胞自噬被激活。使用不同浓度的自噬抑制剂3-MA处理,种子萌发率呈现不同程度的下降,说明了自噬激活与种子萌发速率的正相关性(图3);并且自噬突变体atg5-1、atg7-2种子的萌发速度比野生型种子的慢(图4),进一步证明自噬在种子萌发过程中的作用。
拟南芥种子的主要储存物质为油脂(主要成分为甘油三脂(triacylglycerol,TAG)),占种子干种的40%左右。种子中的TAG被一层半单位膜所包围,形成许多大小不一的但相对稳定的亚细胞微滴,这些小的亚细胞微滴被称为油体(oil body)或油脂体(lipid body)或油质体(oleosome)[29]。在种子萌发过程中,油体内的TAG在TAG脂肪酶的作用下被氧化,形成甘油和脂肪酸,为种子的早期萌发和后期生长提供能量[22]。KELLY等[30]的研究表明,虽然TAG的降解不是拟南芥种子萌发所必需的,但也在萌发中发挥重要作用,TAG脂肪酶突变后,种子的萌发速度明显慢于野生型种子的。最近对蓖麻的研究[31]发现,在萌发前期的胚乳中自噬基因表达持续上调,并且与脂类代谢基因的表达呈现明显的正相关,表明自噬可能通过影响脂质代谢而影响种子萌发过程。
2020年,FAN等[32]发现:细胞自噬参与调控饥饿诱导条件下拟南芥叶片内油体的降解过程,进而参与调控植物脂肪代谢;黑暗诱导的碳饥饿会促使油体相关蛋白OLE1与mCherry-ATG8e标记的自噬体共定位,且诱导油体通过自噬途径进入液泡降解,为植物生长提供能量。因此,在种子萌发过程中,细胞自噬也可能通过促进种子中油体的液泡降解而影响种子萌发速率。LUO等[4]的研究表明:在1/2 MS+1%蔗糖培养基中,拟南芥自噬突变体种子萌发速率与野生型种子的没有明显差别,说明外源添加碳源,可以恢复自噬突变体种子萌发变慢的表型。TAG脂肪酶缺失突变体的表型也类似[33],说明自噬途径介导脂质的液泡降解和TAG脂肪酶介导的TAG氧化降解都对种子萌发起重要作用。
已有研究[2-4,6-8,10]表明营养胁迫、盐胁迫、干旱胁迫、淹水胁迫和氧化胁迫等多种逆境胁迫对自噬突变体植物的生长发育具有明显抑制作用,但对种子萌发过程的影响却少有报道。2017年,LUO等[4]的研究发现:盐胁迫处理可以明显诱导植物细胞自噬;在150 mmol/LNaCl的处理条件下,自噬突变体种子的萌发明显慢于野生型种子的,表明细胞自噬在缓解盐胁迫抑制的种子萌发过程中发挥重要作用。高盐条件下,拟南芥由于盐形成的渗透势阻碍种子吸水,同时促进种子内ABA的积累并抑制GA的合成,从而降低种子萌发速率[34]。本研究发现:在添加GA合成抑制剂PAC的条件下,拟南芥自噬突变体种子的萌发速率显著低于野生型种子的(图5),表明自噬途径对缓解PAC抑制的种子萌发至关重要。以上研究表明:自噬途径与种子萌发存在关联,特别是在种子遭遇非生物胁迫条件下的萌发中发挥重要作用。
值得注意的是,拟南芥自噬突变体种子中积累的脂质和蛋白质含量明显低于野生型种子的[20,32],因此不能完全排除种子质量的下降导致萌发速度变慢。此外,3-MA对拟南芥野生型种子萌发速率的影响明显强于对自噬突变体种子的(图3,图4),说明3-MA还可能通过影响自噬途径以外的其他途径(如囊泡运输途径)而减慢种子的萌发速度[28]。但本研究证明:细胞自噬途径在拟南芥种子萌发过程中被激活,而且自噬突变体种子的萌发速度慢于野生型种子的,且对GA合成抑制剂PAC处理超敏感。本研究解析了细胞自噬在油料种子萌发过程中的作用,并为研究细胞自噬在其他类型种子萌发 (如水稻等淀粉种子)过程中的作用奠定了基础。
4 结论
本研究证明自噬参与了种子萌发过程:在种子萌发过程中,自噬基因表达上调并且ATG8蛋白水平也上调,说明了自噬与种子萌发正相关;对自噬突变体种子萌发状况的进一步探究结果表明自噬突变体种子的萌发速率明显低于野生型种子的;自噬抑制剂导致拟南芥野生型种子的萌发速率降低,说明了自噬在种子萌发过程中至关重要。本研究结果可为淀粉作物和油料作物种子萌发过程中细胞自噬的研究提供理论依据。

