血清相关细胞因子水平检测在急性髓系白血病患者疗效评估、复发率预测中的应用价值
王亚南,赵晶晶,李凤莉,聂玉龙,戴旭阳,刘瑞丽
(新乡医学院第一附属医院 检验科,河南 新乡 453100)
1 资料与方法
1.1 一般资料选取新乡医学院第一附属医院2019年8月至2020年11月收治的98例AML患者纳入疾病组,选取同期59例健康体检者纳入健康对照组。疾病组男55例、女43例,年龄37~68(52.19±6.84)岁,体质量指数19.6~28.3 (23.59±1.84)kg·m-2,疾病分型M023例、M221例、M319例、M420例、M515例;健康对照组男33例、女26例,年龄35~69(51.72±7.66)岁,体质量指数19.3~28.9(23.27±1.90)kg·m-2。两组年龄、体质量指数、性别、疾病分型均衡可比(P>0.05)。本研究经新乡医学院第一附属医院医学伦理委员会审核批准。
1.2 选取标准
1.2.1纳入标准 符合AML相关诊断标准[7];为首诊患者,未接受相关放疗、化疗、分子靶向治疗等;对本研究内容知情,自愿签署知情同意书;临床资料完整。
1.2.2排除标准 放化疗禁忌证;伴有多细胞系病态造血的AML;骨髓增生异常综合征;其他因素引起的AML;严重心脑血管疾病;自身免疫性疾病;获得性免疫缺陷综合征;肝、肾衰竭;合并白血病;合并肿瘤;妊娠期、哺乳期女性;有长期免疫抑制剂使用史。
1.3 方法
1.3.1血清相关细胞因子水平检测方法 采集患者治疗前后静脉血约4 mL,离心处理(3 500 r·min-1,10 min),取上清液,低温保存,使用速率散射比浊法及配套试剂盒(北京九强公司)测定血清β2-MG水平,使用酶联免疫吸附法及配套试剂盒(北京晶美生物科技有限公司)检测血清HGF、TGF-β1水平。
1.3.2治疗方法 患者确诊后根据其疾病特点、意愿实施综合治疗,包括支持治疗(化疗前预处理、抗感染、输成分血、防治并发症、纠正凝血功能障碍)、联合化疗(诱导缓解治疗、缓解后治疗)。
1.3.3疗效评估标准 参照《血液病诊断及疗效标准》[8]进行评估。完全缓解:临床症状、体征消失,外周血血小板≥100×109L-1、中性粒细胞绝对值≥1.5×109L-1,红细胞、巨噬细胞恢复正常,白血病细胞、骨髓原粒细胞≤5%。未缓解:临床体征、症状、血常规、骨髓象等均未达到上述标准。
1.3.4复发评估标准 治疗后,随访1 a,统计AML患者复发情况,若骨髓原始细胞>5%即可判定为复发,反之则为未复发[9]。
当前,我国依旧处于工业化、城市化快速发展的阶段,人地矛盾明显,为保障国家经济的长远发展,土地资源无法避免的会被利用。现如今,在耕地数量不断缩减的环境下,考虑到耕地质量改变造成的耕地存量损失,保障土地资源质量,改变耕地使用方法,加大耕地产量与生产能力等,对确保社会粮食安全及农产品质量是非常关键的,而耕地质量级别监测为满足上述要求奠定良好基础。
1.4 观察和分析内容(1)健康对照组、疾病组血清相关细胞因子水平,包括血清HGF、β2-MG、TGF-β1水平。(2)治疗前后不同疗效、复发情况血清相关细胞因子水平。(3)分析血清相关细胞因子水平与疗效、复发的关系。

2 结果
2.1 健康对照组、疾病组治疗前血清相关细胞因子水平治疗前疾病组血清HGF、β2-MG水平较健康对照组高,血清TGF-β1水平较健康对照组低(P<0.05),见表1。不同疾病分型的AML患者血清HGF、β2-MG、TGF-β1水平比较,差异无统计学意义(P>0.05)。见表2。
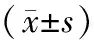
表1 健康对照组、疾病组血清相关细胞因子水平
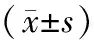
表2 疾病组不同分期的血清相关细胞因子水平
2.2 不同疗效患者血清相关细胞因子水平治疗后完全缓解、未缓解患者治疗后血清HGF、β2-MG水平均降低,且完全缓解患者水平低于未缓解患者,但TGF-β1水平较未缓解患者高(P<0.05)。见表3。
2.3 不同复发情况患者血清相关细胞因子水平治疗后,复发、未复发患者血清HGF、β2-MG水平均降低,且复发患者水平较未复发患者高,但治疗后血清TGF-β1水平较未复发患者低(P<0.05)。见表4。
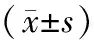
表3 不同疗效患者血清相关细胞因子水平
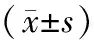
表4 不同复发情况血清相关细胞因子水平
2.4 血清相关细胞因子水平与AML患者疗效、复发的关系相关性分析显示,AML患者疗效与治疗后血清HGF、β2-MG水平呈负相关,与TGF-β1水平呈正相关(P<0.05);AML患者复发情况与治疗后血清HGF、β2-MG水平呈正相关,与TGF-β1水平呈负相关(P<0.05)。见表5。
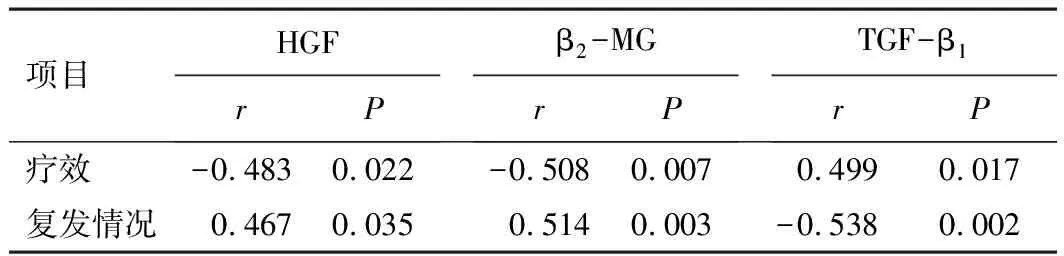
表5 血清相关细胞因子水平与AML患者疗效、复发的关系
3 讨论
对于AML的发生,临床尚未明确其具体机制,但认为环境、饮食习惯、遗传等为主要病因,主要病理特征表现为骨髓与血液中原始、幼稚髓性细胞异常增生。化疗为临床主要治疗手段,但部分患者存在耐药情况,难以达到理想治疗效果。相关数据报告,我国约70%的AML患者在治疗、出院后会出现复发或进展为难治性白血病,最终导致死亡。因此,积极寻找高效预测AML疗效、复发相关的标志物具有积极意义。
本研究发现,疾病组血清HGF、β2-MG水平较健康对照组高,血清TGF-β1水平较健康对照组低,提示AML患者血清HGF、β2-MG、TGF-β1水平存在异常表达情况。进一步实施治疗后发现,完全缓解患者和未复发患者血清HGF、β2-MG水平更低,且血清TGF-β1水平更高,变化更为明显,进一步说明血清HGF、β2-MG、TGF-β1参与AML的产生、发展,并可影响临床治疗效果。β2-MG由淋巴、多形核白细胞产生,可参与多种恶性肿瘤的病理过程,且水平越高,恶性程度越高。有研究发现,β2-MG参与白血病的发生,且水平与疾病活动程度有关,动态监测其水平有利于医生为患者制定个性化治疗方案[10-11]。HGF最早在急性重型肝炎患者血浆和鼠血小板中发现,随着研究深入,逐渐发现其在髓系白血病患者骨髓、血浆水平中异常表达。HGF在机体免疫中占重要地位,其异常表达可提示骨髓造血微循环改变。有研究指出,HGF可通过影响细胞黏附及细胞周期来促进K562及K562/G01细胞增殖,并能降低药物对白血病细胞的杀伤作用[12]。HGF一方面通过与特异性受体c-Met结合,促进内皮细胞运动、增殖、黏附、管腔生成,并可通过调节其他血管生成因子表达间接促进血管生成,从而影响AML的发生、发展。TGF-β1能调控机体生物学进程,包括组织修复、炎症、肿瘤发生发展,同时也是分泌白细胞介素17 T细胞亚群(Th17)分化的关键因子,在诱导初始T细胞分化为Th17细胞的过程中发挥着重要的辅助作用[13]。作为多效性细胞因子,TGF-β1能刺激成纤维细胞生长,调节造血、修复创伤,抑制肿瘤细胞增殖,且多项研究表明,其表达与AML的发生、发展、预后有关[14-15]。
相关性分析显示,AML患者疗效与血清HGF、β2-MG水平呈负相关,与TGF-β1水平呈正相关;AML患者复发情况与血清HGF、β2-MG水平呈正相关,与TGF-β1水平呈负相关,初步表明血清HGF、β2-MG、TGF-β1水平可为临床诊治AML患者提供重要参考数据。
综上,血清HGF、β2-MG、TGF-β1可参与AML的产生、发展,且其水平与患者治疗效果、复发等有关,临床密切监测其水平能指导诊疗方案的制定。

