GALNT2通过EGFR信号通路影响胰岛素自身免疫综合征的作用机制
奥日瀚,格日勒图
(1.内蒙古自治区人民医院内分泌科,内蒙古 呼和浩特 010017;2.内蒙古自治区人民医院眼科)
胰岛素自身免疫综合征又称自身免疫性低血糖,是由于血中非外源性胰岛素诱导产生高浓度免疫活性胰岛素和高效价胰岛素自身抗体引起的,以反复发作性、严重自发性低血糖为特征的一种罕见病[1,2]。胰岛素自身免疫综合征在1970年由日本Hirata首次报道,故又称Hirata病,在日本被列为自发性低血糖症的第三大原因,需要与胰岛素瘤和胰腺外肿瘤相互区分[3]。目前胰岛素自身免疫综合征的确切发病机制尚不明确,但是被广泛认可的原因是与自身免疫缺陷和含巯基药物的作用相关,产生胰岛素自身抗体导致高胰岛素血症,引发低血糖[4,5]。
糖基化修饰是常见的蛋白质翻译后修饰类型之一,影响着如细胞增殖、迁移、凋亡等多种细胞功能[6,7]。研究表明蛋白质主要有N型和O型两种糖基化修饰类型,而GALNT2是调控黏蛋白O型糖基化起始步骤的重要酶[8,9]。有研究发现GALNT2的表达与酪氨酸激酶受体的活化有关,而EGFR是最早报道也是研究最多的酪氨酸激酶的受体,可以通过下游的PI3K/AKT信号通路参与细胞信号转导和多种细胞功能调节[10,11]。在肝癌细胞等肿瘤细胞中,GALNT2可以通过糖基化修饰EGFR,进而促进EGFR的磷酸化,激活其下游信号通路,影响肿瘤细胞的恶性程度[12]。
GALNT2和EGFR在多种肿瘤的恶性进展中发挥的功能已经被多次报道,然而在代谢疾病发生发展中所起的作用,以及对该作用的分子机制却仍需要探索。本研究表明GALNT2通过影响EGFR的翻译后修饰,激活PI3K/AKT信号通路,从而促进PPAR-γ和PEPCK的表达,提高了细胞对葡萄糖的摄取和代谢。胰岛素自身免疫综合征患者在发病时会呈现血糖高低交替现象,并且出现严重的糖尿病酮症酸中毒和低血糖[13]。我们的结果证实GALNT2通过EGFR及其下游信号通路,参与了细胞内的葡萄糖代谢过程,引起体内血糖和胰岛素水平的变化,GALNT2的异常表达可能是胰岛素自身免疫综合征发病的原因之一。
1 材料与方法
1.1 细胞培养与细胞转染
使用含有10%胎牛血清的DMEM培养基,在37℃恒温、CO2浓度为5%及饱和湿度的细胞培养箱中进行培养。为了防止细菌污染,培养基可添加青/链霉素抗生素,其中青霉素的终浓度为100 U/mL,链霉素的终浓度为100μg/mL。使用阳离子脂质体转染试剂转染细胞。提前24 h接种待转染的细胞,细胞密度以第二天转染时汇合度达到50%~70%为宜。将过表达质粒或者siRNA与转染试剂加入到不含血清的DMEM培养基中吹打混匀,室温孵育20 min,逐滴加入上述转染混合液,轻轻混匀后放于培养箱中培养。转染后6~8 h更换新鲜培养基,并继续培养24~48 h后进行后续实验。
1.2 蛋白免疫印迹(Western blot)
收集处理后的各组细胞,用RIPA裂解液置于冰上裂解30 min,然后用BCA蛋白定量试剂盒进行蛋白浓度的测定。取20~60μg蛋白样品,用SDSPAGE进行分离,将分离后的蛋白质转移到NC膜上,5%BSA室温封闭1~2 h,分别加入稀释的一抗4℃孵育过夜,洗膜后加入对应种属的HRP标记的二抗,室温孵育1 h,使用化学发光法进行曝光显影,以β-actin作为内参。
1.3 凝集素下拉试验
将细胞裂解液与长柔毛野豌豆外源凝集素琼脂糖珠在4℃共同孵育12 h,通过离心收集凝集素/糖蛋白复合物。将凝集素/糖蛋白煮沸变性分离,用Western blot检测发生O型糖基化的EGFR蛋白含量,以细胞内总EGFR蛋白含量作为对照。
1.4 葡萄糖、乳酸和NADP+/NADPH含量检测
将待检测细胞接种至6孔板中,待细胞生长至90%汇合度时,更换新鲜培养基继续培养6 h,收集上清液用葡萄糖分析试剂盒和乳酸分析试剂盒测定葡萄糖和乳酸的含量,通过从培养基初始浓度中减去最终浓度来计算葡萄糖消耗量。使用NADP+/NADPH分析试剂盒在450 nm的光密度下测定细胞裂解物中的NADP+/NADPH比率。
1.5 RNA提取和RT-qPCR实验
使用Trizol试剂提取总RNA,取1μg总RNA按照试剂盒说明书反转录成cDNA。对合成的荧光定量PCR试剂盒进行RT-qPCR检测,取2μL cDNA作为模板,加入特异基因引物,50μL体系进行扩增,每个孔均设置3个重复,以β-actin作为内参。
1.6 细胞葡萄糖摄取能力检测
将待检测细胞接种至96孔板中,待细胞生长至90%汇合度时,用不含葡萄糖的DMEM培养基清洗细胞2次后,加入不含葡萄糖的培养基培养15 min。加入用不含葡萄糖的培养基稀释的探针,37℃下培养15 min,洗去多余的探针后在荧光显微镜下观察葡萄糖摄取情况。
1.7 统计学方法
所有数据均采用SPSS 21.0统计学软件进行处理,计量资料采用均值±标准差的形式表示,两组间比较采用t检验。检验水准为α=0.05,当P<0.05时,认为两组样本均值之间差异有统计学意义。
2 结果
2.1 GALNT2对EGF刺激下EGFR磷酸化的影响
将转染GALNT2过表达质粒和转染siRNA的L-02细胞无血清处理6 h,随后加入100 ng/mL的EGF刺激10 min,随后收集细胞进行Western blot试验。结果表明过表达GALNT2增强了EGF诱导的EGFR磷酸化水平,而敲低GALNT2的细胞EGFR磷酸化水平明显降低(见图1)。
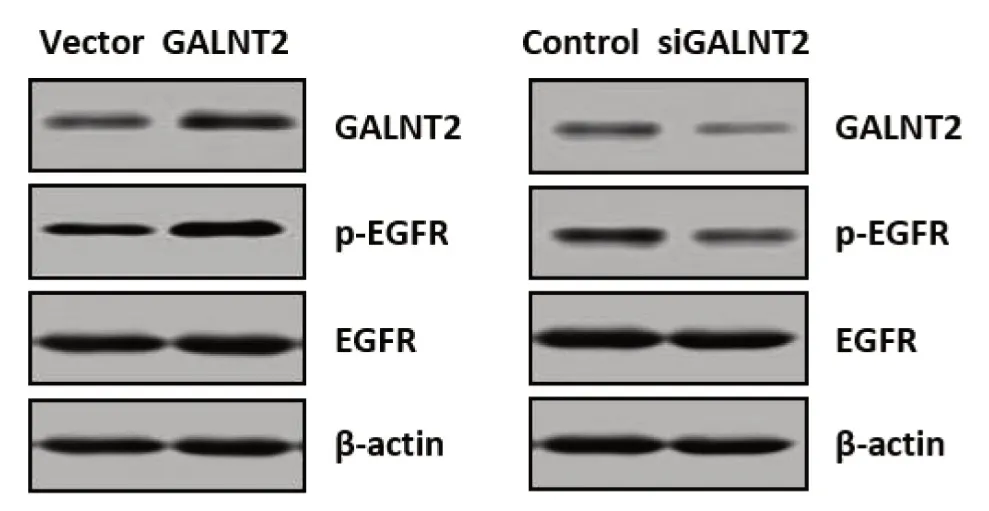
图1 GALNT2对EGF刺激下EGFR磷酸化的影响
2.2 GALNT2对EGFR的O型糖基化水平的影响
为了探究GALNT2是否影响EGFR在L-02细胞中的O型糖基化水平,我们进行了凝集素下拉试验。如图2所示,过表达GALNT2增加了EGFR的O型糖基化,而敲低GALNT2的细胞EGFR的O型糖基化水平降低。
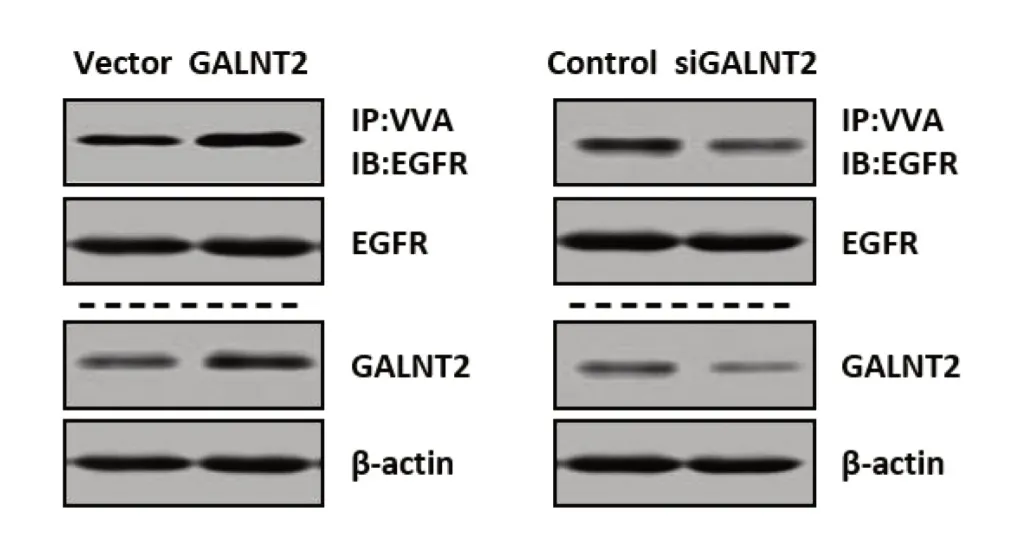
图2 GALNT2对EGFR的O型糖基化水平的影响
2.3 GALNT2对EGFR下游PI3K/AKT通路活性的影响
前面的实验结果证实了在L-02细胞中GALNT2能够促进EGFR的磷酸化,随后我们检测了EGFR的下游信号通路。结果表明,过表达GALNT2能够促进AKT和mTOR的磷酸化,激活PI3K/AKT通路。而同时加入PI3K抑制剂LY294002则逆转了GALNT2的作用,表明GALNT2确实是通过PI3K/AKT信号通路发挥功能(见图3)。

图3 GALNT2对EGFR下游PI3K/AKT通路活性的影响
2.4 GALNT2对细胞代谢能力的影响
过表达GALNT2的细胞培养基中的葡萄糖消耗增加(t=5.856,P<0.05),乳酸生成增加(t=5.543,P<0.05),并且细胞内的NADPH/NADP+比例升高(t=4.364,P<0.05),而同时加入PI3K抑制剂LY294002则逆转了GALNT2的作用,表明GALNT2能够通过PI3K/AKT信号通路促进细胞代谢(见表1)。
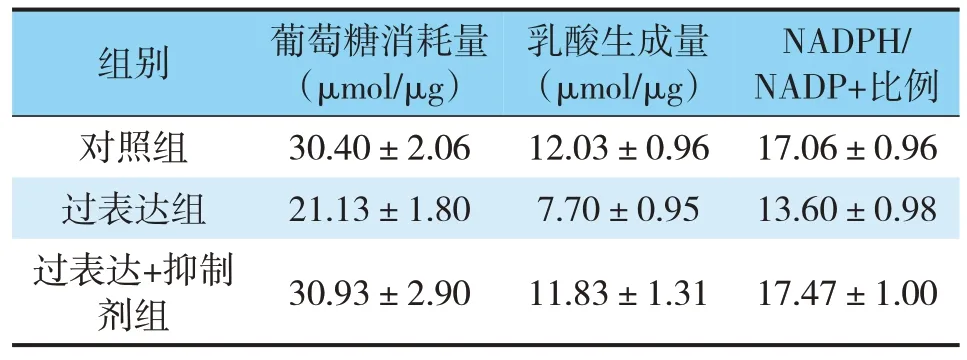
表1 GALNT2对细胞代谢能力的影响
2.5 GALNT2对PPAR-γ和PEPCK表达的影响
随后我们检测了糖代谢通路下游基因PPAR-γ和PEPCK的mRNA水平,结果表明过表达GALNT2的细胞中PPAR-γ和PEPCK的mRNA含量升高(**P<0.05)(见图4)。
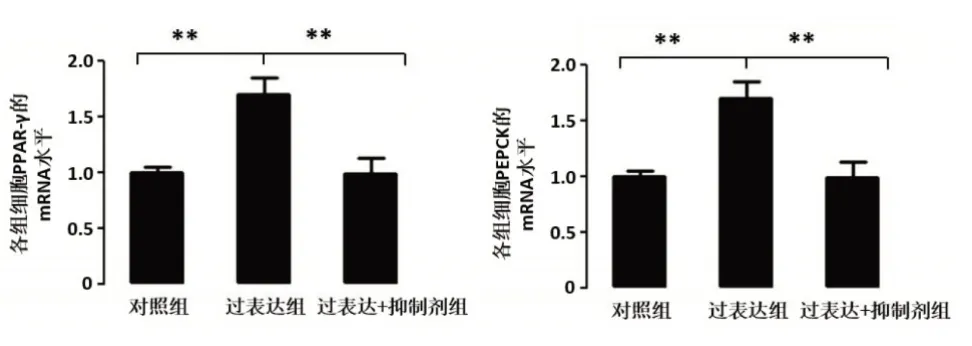
图4 GALNT2对PPAR-γ和PEPCK表达的影响
2.6 GALNT2对胰岛素抵抗模型的细胞葡萄糖摄取能力的影响
最后我们用含有1μmol/L胰岛素的DMEM培养基处理细胞16 h,构建胰岛素抵抗模型,通过葡萄糖摄取实验表明GALNT2增强了胰岛素抵抗模型的细胞对葡萄糖摄取能力(见图5)。

图5 GALNT2对胰岛素抵抗模型的细胞葡萄糖摄取能力的影响
3 讨论
胰岛素自身免疫综合征是一种比较罕见的疾病,可以引发低血糖甚至死亡,在国内外也都有误诊为胰岛细胞瘤而进行手术的病例报告[14]。这提醒我们正确全面地认识这一疾病,探究其发病因素显得尤为重要。我们的研究结果表明,GALNT2通过影响EGFR及其下游信号通路,促进了细胞内的葡萄糖代谢过程,是导致机体血糖降低的原因之一,也初步揭示了胰岛素自身免疫综合征的发病的可能机制。
胰岛素自身免疫综合征的治疗主要以清除胰岛素自身抗体、及时纠正并预防低血糖的发生为主。治疗措施包括停用可能诱发自身免疫的药物、调整饮食结构、选用阿卡波糖,通过延缓葡萄糖的吸收和降低胰岛素的分泌而发挥作用。对于低血糖反复发作且难以控制的患者,可以口服糖皮质激素或进一步使用免疫抑制剂,病情严重的患者甚至需要血浆置换。我们的研究表明,PI3K的抑制剂LY294002能够逆转GALNT2对葡萄糖代谢的影响,延缓细胞代谢速率,对于胰岛素自身免疫综合征患者可能会有积极的作用,在将来的研究中我们可以尝试使用EGFR信号通路的抑制剂来治疗胰岛素自身免疫综合征等细胞代谢疾病。
有研究报道,GALNT2基因多态性与血脂HDLC和TG水平密切相关[15,16]。在GALNT2基因的第一个内含子中存在6个研究较多的突变位点,不同的突变位点具有不同的生物学特性,在未来的研究中会不断发掘GALNT2基因多态性与包括胰岛素自身免疫综合征在内的多种疾病发生的关系。对GALNT2的生理功能进一步探索,将有助于设计针对GALNT2功能的药物,从平衡细胞内的O型糖基化水平的角度来治疗各类疾病,拓宽包括抗恶性肿瘤与调节代谢疾病等方面药物的开发视野,为全人类的健康事业作出更多的贡献。

