四种芋艿蛋白组分的理化性质
黄友如,王教飞
(常熟理工学院 生物与食品工程学院,江苏 常熟 215500)
芋艿起源于印度和东南亚地区,后传入我国,在苏南地区有悠久的栽培历史.芋艿在植物分类学上属天南星科[1],常作一年生作物,实则多年生草本植物.芋艿球茎是地下茎的膨大部分,外皮多为棕色,内部组织多为白色、粉色或紫色.长江中下游地区以白梗芋艿为主[2-3],是食材的主要部分,深受人们喜爱.
王教飞[4]和孙啊敏等人[5]通过碱溶酸沉法分离得到芋艿蛋白,并研究了不同pH环境条件下芋艿分离蛋白的流变特性及金属离子对芋艿分离蛋白功能性质的影响.黄友如等人[6]针对芋艿分离蛋白的等电点、变性温度、氨基酸组成及亚基相对分子质量分布等重要物化性质进行了研究.有关芋艿蛋白的分级分离及各组分理化性质方面的探讨,除了Sumathi等[7]有关芋艿胰蛋白酶抑制剂方面的研究外,国内外文献鲜见报道.
本文以新鲜芋艿球茎为材料制备谷蛋白、醇溶蛋白、球蛋白和清蛋白4种蛋白成分,并对4种芋艿蛋白成分的热稳定性、等电点、亚基相对分子质量分布、氨基酸组成与含量,以及二级结构等重要物化性质进行分析比较,填补了目前在芋艿蛋白各组分理化性质认识上的空白.
1 材料与方法
1.1 材料与试剂
芋艿:产自常熟.
盐酸、氢氧化钠、巯基乙醇、丙烯酰胺、考玛斯亮蓝、十二烷基硫酸钠、甘氨酸、甘油、溴酚蓝等均为分析纯,国药集团化学试剂有限公司.
1.2 仪器与设备
酸度计,DSC3-差示扫描量热分析仪,梅特勒-托利多(上海)公司;FreeZone冻干机,美国Labeonco公司;Chirascan VX圆二色光谱仪,英国Applied Photophysics公司;TGL-16G离心沉淀机,上海安亭科学仪器厂;Mini Gel Tank小型垂直电泳槽,赛默飞世尔科技(中国)有限公司.
1.3 芋艿蛋白组分的分级分离
参考Osborne分级法[8],以新鲜芋艿球茎为材料分离制备谷蛋白、醇溶蛋白、球蛋白和清蛋白4种蛋白组分,分别占新鲜芋艿总蛋白质量的38.27%,2.99%,3.97%和43.38%.该4种组分占了新鲜芋艿总蛋白质量的88.61%,其他蛋白占总蛋白质量的11.39%.分离所得芋艿蛋白各组分的蛋白质纯度(即蛋白质含量)分别为96.27%,89.90%,93.21%和91.32%,凯氏定氮法测定,换算因子N=6.25.
1.4 芋艿蛋白各组分等电点的测定
参考文献[6]中1.4节芋艿分离蛋白等电点的测定.
1.5 芋艿蛋白各组分的非还原和还原SDS-聚丙烯酰胺凝胶电泳(polyacrylamide gel electrophoresis,PAGE)分析
参考文献[6]中1.5节芋艿分离蛋白的非还原和还原SDS-聚丙烯酰胺凝胶电泳分析.
1.6 芋艿蛋白各组分的热稳定性测定
参考文献[6]中1.6节芋艿分离蛋白热稳定性测定.
1.7 芋艿蛋白各组分的氨基酸组成分析
参考文献[6]中1.7节芋艿分离蛋白的氨基酸组成分析.
1.8 芋艿蛋白各组分的圆二色谱(Circular Dichroism,CD)测定
参考文献[9]中5.3.3 芋艿蛋白组分的圆二色谱测定.
2 结果与分析
2.1 芋艿蛋白组分的等电点
芋艿清蛋白的等电聚焦电泳(isoelectric focusing, IEF)图谱及含量分布见图1.从图1可以看出,芋艿清蛋白可检出4个可辨条带.其中含量较高的条带为3号条带,pI值为5.04,占清蛋白总量的57.43%.其他含量较低的等电点条带分别是条带4、2和1,等电点pI值分别为4.45、6.77和7.03,其含量分别占清蛋白总量的7.93%、20.49%和14.15%.

图1 芋艿清蛋白的IEF图谱及含量分布
芋艿球蛋白的IEF图谱及含量分布见图2.从图2可以看出,芋艿球蛋白可分辨检出7个条带.其中含量最高的条带为6号条带,等电点为5.23,占该球蛋白总量的 50.69%.其他含量较低的 pI条带分别是 7、5、4、3、2 和1 号条带,等电点 pI值分别为 4.56、5.89、6.22、6.67、6.78和8.57,其含量分别占该球蛋白总量的11.01%、2.62%、8.58%、8.59%、13.04%和5.47%.
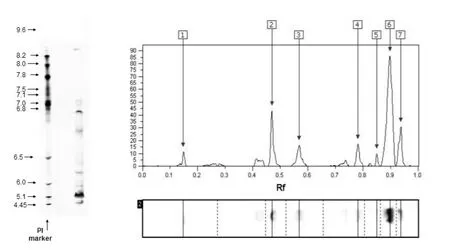
图2 芋艿球蛋白的IEF图谱及含量分布
芋艿醇溶蛋白IEF图谱及含量分布见图3.从图3可以看出,芋艿醇溶蛋白仅可分辨检出1个条带,即条带1,等电点pI值为6.67,含量为醇溶蛋白总量的57.43%左右.其他蛋白条带聚焦不明显.
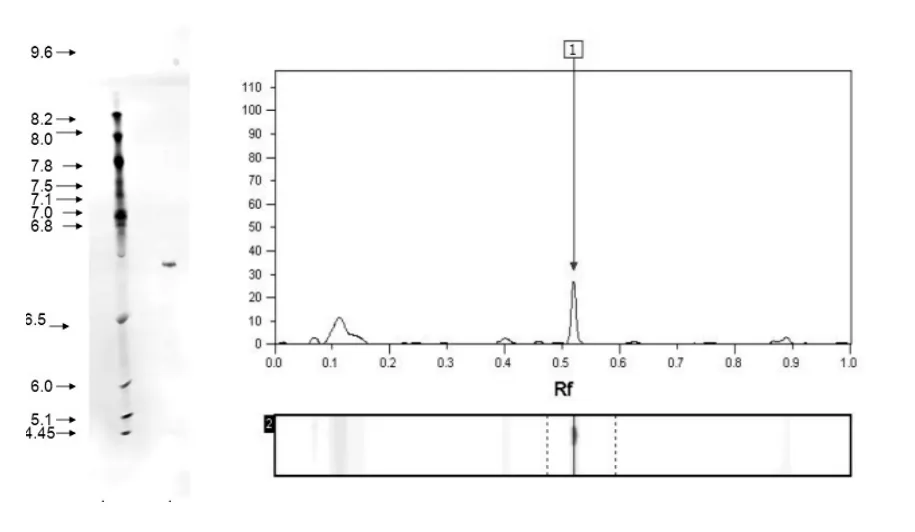
图3 芋艿醇溶蛋白的IEF图谱及含量分布
芋艿谷蛋白的IEF图谱及含量分布见图4.从图4可以看出,芋艿谷蛋白可分辨检出1个非常突出的条带,即条带1,等电点pI值为6.76,占谷蛋白总量的几近100%.未见其他蛋白条带聚焦.
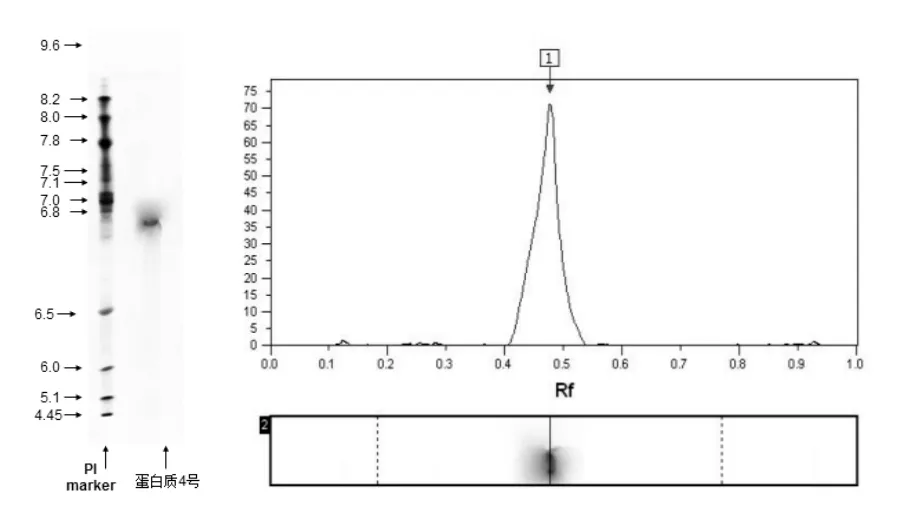
图4 芋艿谷蛋白的IEF图谱及含量分布
2.2 芋艿蛋白组分的SDS-PAGE
图5为芋艿蛋白组分还原与非还原SDS-PAGE.由图5可以看出,在芋艿蛋白4种成分的SDS-PAGE过程中,添加巯基乙醇前后,其电泳条带差异显著.也就是说,是否添加巯基乙醇,会影响其条带的分离.
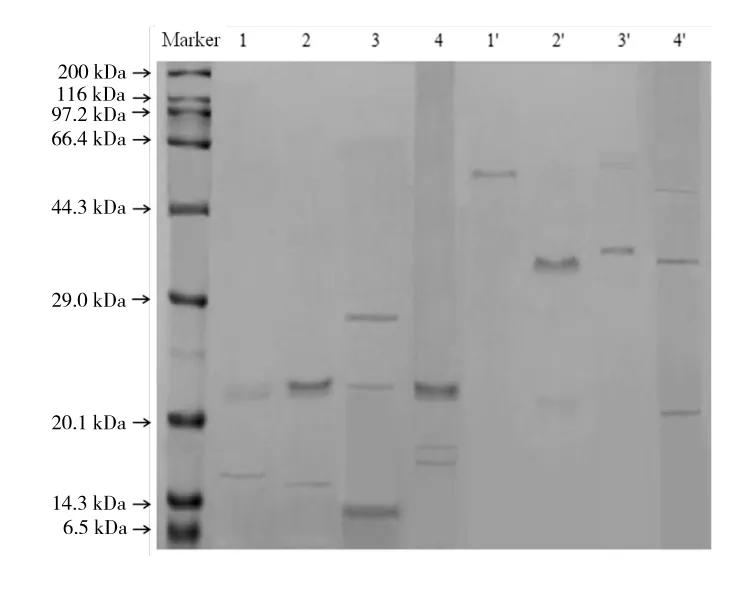
图5 芋艿蛋白组分SDS-PAGE条带
添加巯基乙醇(1、2、3和4泳道)时:清蛋白有2个条带,相对分子质量分别在21.4 kDa(大亚基)和16.5 kDa(小亚基)左右;球蛋白有2个条带,相对分子质量分别在22.1 kDa(大亚基,着色较深)和15.5 kDa(小亚基)左右;醇溶蛋白有3个条带,相对分子质量分别在27.8 kDa(大亚基)、21.9 kDa和11.0 kDa(小亚基,着色较深)左右;谷蛋白有3个条带,相对分子质量分别在22.5 kDa(大亚基,着色较深)、17.5 kDa和16.8 kDa左右.
无巯基乙醇(1'、2'、3'和 4'泳道)时:清蛋白仅 1 个条带,相对分子质量在57.9 kDa左右;球蛋白同样只有1个条带,相对分子质量在38.0 kDa左右;醇溶蛋白有2个条带,相对分子质量分别在58.4 kDa(着色较浅)和39.2 kDa(着色较深)左右;谷蛋白有3个条带,相对分子质量分别在54.8,38.8和21.7 kDa左右.
添加巯基乙醇可打开二硫键,实现亚基之间的分离,出现相对分子质量较低的新条带.上述实验结果说明:清蛋白(57.9 kDa)至少含有2种亚基,拟由2个大亚基(21.4 kDa)和1个小亚基(16.5 kDa)通过二硫键交联组成;球蛋白(38.0 kDa)拟由1种大亚基(22.1 kDa)和1种小亚基(15.5 kDa)通过二硫键交联组成;醇溶蛋白至少含有3种亚基,其着色较深(39.2 kDa)的条带拟由1个大亚基(27.8 kDa)和1个小亚基(11.0 kDa)通过二硫键交联组成,其着色较浅(58.4 kDa)条带的亚基构成较为复杂,可能由3种亚基通过二硫键交联组成,或者也有其他组合的可能;谷蛋白至少含有3种亚基,即1种大亚基和2种相对分子质量较为接近的小亚基,大亚基与小亚基之间,以及小亚基之间拟有二硫键的交联.
2.3 芋艿蛋白组分的热稳定性分析
4种芋艿蛋白成分的热变性情况见图6.由图6可知,芋艿蛋白成分中谷蛋白、醇溶蛋白、球蛋白和清蛋白的变性温度分别是71.2,71.9,70.1 和 67.1 ℃,其ΔH(变性热焓)分别为 1.551,1.470,1.455 和1.434 J/g.图6中呈现的吸热峰显示了芋艿蛋白分子从天然态到变性态的构象转变过程,即因程序加热而经历着的解折叠过程.
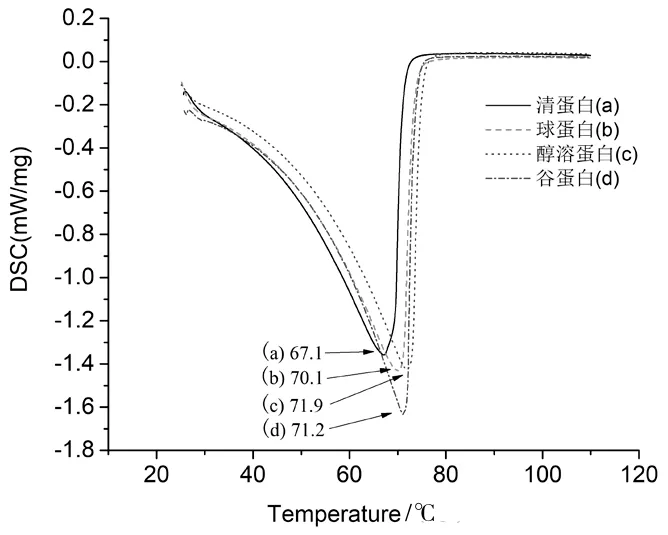
图6 芋艿蛋白组分的热变性曲线
变性温度为71.9 ℃的是芋艿醇溶蛋白,属4种芋艿蛋白中热变性温度最高的组分.变性温度为67.1 ℃的是芋艿清蛋白,属4种芋艿蛋白中热变性温度最低的组分.可见,相比其他蛋白成分,芋艿醇溶蛋白的热稳定性较好.
蛋白亚基之间疏水相互作用的增强可升高蛋白质的变性温度[10],因此醇溶蛋白、球蛋白的热稳定性高于清蛋白.这里芋艿醇溶蛋白和球蛋白的变性温度高于芋艿清蛋白也证明了这一点.结合后面芋艿蛋白组分的氨基酸组成分析可知,芋艿醇溶蛋白中胱氨酸含量占1.86%,高于其他3种蛋白组分.因半胱氨酸残基的巯基氧化而产生的二硫键对蛋白质热变性温度是否有一定程度的贡献,可进一步通过添加诸如巯基乙醇之类还原剂的实验证明.理论上,蛋白质变性并不能断开二硫键,但在蛋白制备过程中二硫键的交联一定会影响最终提取蛋白的三维结构,使蛋白质解折叠所需的能量增加,热变性温度升高.
当然,疏水相互作用不是影响蛋白质变性温度的唯一因素.通常,蛋白质发生热转变前后的变性热焓(ΔH)(图6吸热峰的峰面积)与其有序的二级结构(如β-折叠等)含量有关[8].变性过程中热能的变化主要产生于蛋白质分子内和分子间氢键的断裂[11],而分子间氢键则是稳定β-折叠结构的主要作用力,因此蛋白质高变性温度与其β-折叠结构含量呈正相关[12].芋艿谷蛋白变性焓最高,说明其有序结构所占比例较大,后面圆二色谱中有关芋艿蛋白组分二级结构的分析结果也证明:4种蛋白组分中,芋艿谷蛋白的β-折叠结构含量最高(49.0%).
4种蛋白组分中芋艿清蛋白的变性温度和变性焓均最低,圆二色谱分析也证明其二级结构中β-折叠含量仅有16.6%,是4种芋艿蛋白组分中β-折叠含量相对最低的.
2.4 芋艿蛋白组分的氨基酸组成
芋艿蛋白组分的酸水解不引起消旋作用,产物为L型的氨基酸.除色氨酸被破坏外,另有一小部分丝氨酸及苏氨酸被分解,而天冬酰胺和谷氨酰胺的酰胺基则被水解下来形成相应的天冬氨酸和谷氨酸[6].
图7比较了4种芋艿蛋白质组分中17种氨基酸的组成.由图可知,仅从氨基酸种类比较,4种芋艿蛋白成分中各种氨基酸含量均有差异.

图7 芋艿蛋白各组分的氨基酸组成
一般来说,蛋白质显示最高稳定性的温度取决于极性和非极性相互作用对蛋白质稳定性贡献的相对值[11].
在芋艿蛋白组分中,非极性氨基酸(即脯氨酸、蛋氨酸、苯丙氨酸、丙氨酸、缬氨酸、亮氨酸和异亮氨酸,色氨酸除外)分别占清蛋白、球蛋白、醇溶蛋白和谷蛋白含量的38.38%、36.87%、35.70%和37.27%.
不带电荷的极性氨基酸(如甘氨酸、苏氨酸、丝氨酸、酪氨酸、胱氨酸,谷氨酰胺、天冬酰胺除外)分别占清蛋白、球蛋白、醇溶蛋白和谷蛋白含量的19.82%、22.00%、19.84%和21.04%.带正电荷的极性氨基酸(即精氨酸、组氨酸和赖氨酸)分别占清蛋白、球蛋白、醇溶蛋白和谷蛋白含量的15.54%、14.93%、13.53%和15.10%.带负电荷的极性氨基酸(即谷氨酸与天冬氨酸,含谷氨酰胺与天冬酰胺)分别占清蛋白、球蛋白、醇溶蛋白和谷蛋白含量的26.26%、26.20%、30.93%和26.59%.
众所周知,醇溶蛋白的疏水性较强是其水溶性差的主要原因,但在4种芋艿蛋白组分中芋艿醇溶蛋白的非极性氨基酸含量却是最低的,可见造成芋艿醇溶蛋白水溶性差、热变性温度高的原因不完全与非极性氨基酸含量有关,也与蛋白质高级结构中非极性氨基酸的分布模式有关.
类似的情况也在芋艿清蛋白中出现.一般清蛋白的水溶性较好,但在4种芋艿蛋白组分中芋艿清蛋白的极性氨基酸含量却是最低的.可见造成芋艿清蛋白水溶性好、热变性温度低的原因不完全与极性氨基酸含量有关,也与极性氨基酸在蛋白质高级结构中的分布模式有关.
芋艿蛋白各组分中必需氨基酸含量,除醇溶蛋白较低外,其他均较高.其在清蛋白、球蛋白、醇溶蛋白和谷蛋白中的含量分别为38.47%、39.23%、28.20%和39.02%.半必需氨基酸(即精氨酸、组氨酸)在清蛋白、球蛋白、醇溶蛋白和谷蛋白中的含量分别为10.14%、9.0%、11.37%和9.90%.
2.5 芋艿蛋白组分CD光谱分析
蛋白质的二级结构是指多肽链本身的折叠和盘绕方式.它仅涉及肽链中的主链构象,并不涉及侧链构象.蛋白质的二级结构主要是指无规卷曲、β-转角、β-折叠和α-螺旋,通常采用圆二色谱测定[13].
图8为芋艿蛋白各组分CD光谱.应用圆二色谱仪的机带程序,根据Chen-Yang 原理[14]可计算出芋艿蛋白成分二级结构中无规卷曲、β-转角、β-折叠和α-螺旋所占的比例,结果见表1.
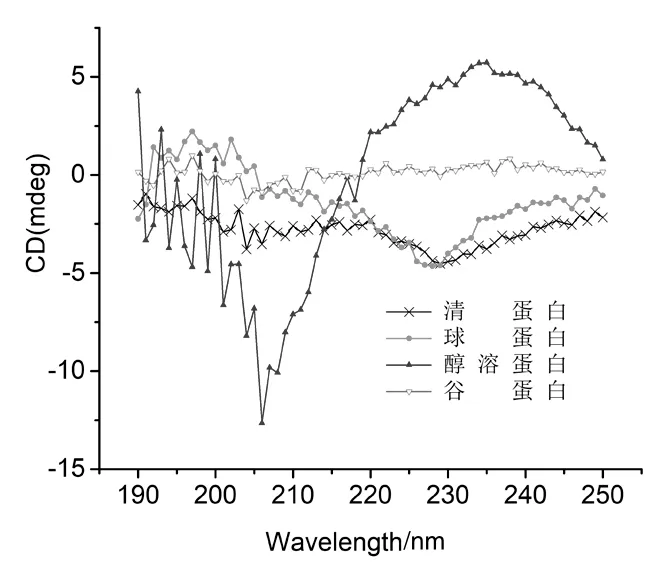
图8 芋艿蛋白各组分CD光谱

表1 芋艿蛋白各组分的二级结构含量 单位:%
4种芋艿蛋白组分中,清蛋白的α-螺旋含量最高,谷蛋白的α-螺旋含量最低.一条多肽链可否形成α-螺旋、形成的螺旋稳定与否,与其氨基酸序列及组成有很大的关联[15].4种蛋白组分中清蛋白的极性氨基酸含量最低(61.62%).因此在同一pH环境下,清蛋白中具有相同电荷的荷电氨基酸相对较少,彼此间静电斥力较低,较易形成链内氢键,有利于α-螺旋结构的形成与稳定.但类似的解释似乎不能用来说明谷蛋白的α-螺旋含量最低的原因,毕竟谷蛋白的极性氨基酸含量也达62.73%,仅次于清蛋白.4种芋艿蛋白组分中,谷蛋白的甘氨酸、异亮氨酸的含量较高(图7),甘氨酸的侧链R基太小,难以形成α-螺旋所需的两面角,是螺旋的破坏者[16].如果肽链中拥有庞大侧链的氨基酸(如异亮氨酸)残基连续出现,鉴于空间位阻的关系,也难以形成有规律的α-螺旋[16].这是造成谷蛋白的α-螺旋含量最低的原因.可见蛋白质侧链基团的荷电性质、侧链基团的大小、空间排列及位阻等对多肽链螺旋的形成有影响.
4种芋艿蛋白组分中,谷蛋白的β-折叠含量最高,清蛋白的β-折叠含量最低.如果把氢键看作是维持蛋白质α-螺旋与β-折叠的主要作用力,则芋艿蛋白4种组分的变性热焓与其α-螺旋和β-折叠的总量之间呈正相关(图9).分子间氢键是稳定β-折叠结构的主要作用力,4种芋艿蛋白组分中,β-折叠含量与其对应的变性温度之间的关系也证实了“蛋白质高变性温度与其β-折叠结构含量呈正相关”[12](图9).

图9 芋艿蛋白各组分分析指标的比较
一般认为“β-转角主要存在于球状蛋白分子中”[12],但在4种芋艿蛋白组分中,球蛋白的β-转角含量最低(15.2%).
3 总结
参考Osborne分级法[8],以新鲜芋艿球茎为材料分离制备谷蛋白、醇溶蛋白、球蛋白和清蛋白4种蛋白成分,分别占新鲜芋艿总蛋白质量的38.27%,2.99%,3.97%和43.38%.该4种组分共占新鲜芋艿总蛋白质量的88.61%,其他蛋白占总蛋白质量的11.39%.分离所得芋艿蛋白各组分的蛋白质纯度(即蛋白质含量)分别为96.27%,89.90%,93.21%和91.32%.
等电聚焦电泳分析发现,芋艿谷蛋白、醇溶蛋白、球蛋白、清蛋白4种主要蛋白成分的等电点分别位于pH 6.76(占谷蛋白总量的几近100%)、6.67(占醇溶蛋白总量的 57.43%)、5.23(占球蛋白总量的 50.69%)和5.04(占清蛋白总量的57.43%).
SDS-PAGE分析表明:清蛋白(57.9 kDa)至少含有2种亚基,拟由2个大亚基(21.4 kDa)和1个小亚基(16.5 kDa)通过二硫键交联组成.球蛋白(38.0 kDa)拟由1种大亚基(22.1 kDa)和1种小亚基(15.5 kDa)通过二硫键交联组成.醇溶蛋白至少含有3种亚基,其着色较深(39.2 kDa)的条带拟由1个大亚基(27.8 kDa)和1个小亚基(11.0 kDa)通过二硫键交联组成;其着色较浅(58.4 kDa)条带的亚基构成较为复杂,可能由3种亚基通过二硫键交联组成,或有其他组合的可能;谷蛋白至少含有3种亚基,即1种大亚基和2种相对分子质量较为接近的小亚基,大亚基与小亚基之间,以及小亚基之间拟有二硫键的交联.
热稳定性(DSC)分析显示:谷蛋白、醇溶蛋白、球蛋白和清蛋白的变性温度分别是71.2、71.9、70.1和67.1℃,其ΔH(变性热焓)分别为1.551,1.470,1.455和1.434 J/g.两者的趋势走向较为一致.芋艿清蛋白变性温度最低,醇溶蛋白的变性温度最高.与其他蛋白成分相比,芋艿醇溶蛋白的热稳定性较好.
氨基酸分析表明:在芋艿蛋白组分中,非极性氨基酸分别占清蛋白、球蛋白、醇溶蛋白和谷蛋白含量的38.38%、36.87%、35.70%和37.27%.对应的极性氨基酸分别占清蛋白、球蛋白、醇溶蛋白和谷蛋白含量的61.62%、63.13%、64.3%和62.73%.值得注意的是,谷蛋白、醇溶蛋白、球蛋白和清蛋白的变性温度与其极性氨基酸含量的趋势走向一致.说明蛋白质侧链基团的荷电性质、侧链基团的大小、空间排列及位阻等对多肽链折叠及蛋白质高级结构的形成贡献颇多,并进而影响蛋白质的稳定性.这里,在稳定芋艿蛋白4个组分高级结构的非共价相互作用的4个因素中,氢键、离子键的作用似乎占主导地位,而疏水相互作用、范德华力对蛋白质结构稳定性的贡献较弱.
芋艿蛋白各组分中必需氨基酸含量除醇溶蛋白较低外,其他均较高.其在清蛋白、球蛋白、醇溶蛋白和谷蛋白中的含量分别为38.47%、39.23%、28.20%和39.02%;半必需氨基酸(即精氨酸、组氨酸)在清蛋白、球蛋白、醇溶蛋白和谷蛋白中的含量分别为10.14%、9.0%、11.37%和9.90%.
CD光谱分析证明:4种芋艿蛋白组分中,α-螺旋与β-折叠含量正好相反,如清蛋白的α-螺旋含量最高,β-折叠含量最低;谷蛋白的β-折叠含量最高,α-螺旋含量最低.

