喀斯特生境中山麻杆种群与环境因子的关系
曾嘉庆,陶建平
1. 西南大学 生命科学学院/三峡库区生态环境教育部重点实验室, 重庆 400715;2. 中南大学 冶金与环境学院, 长沙 410083
植物与环境的关系一直是生态学研究的重要内容[1]. 环境因子对植物生长、 发育、 行为和分布有着直接或间接的影响[2], 植物也通过长期演化对不同的环境因子形成适应性反应[3]. 研究植物种群与环境之间的关系有助于了解植物分布的空间特征, 了解植物对生存环境的适应机制[4], 在资源限制度较高的特殊生境中进行环境因子调查, 还可以解释限制植物生长的主要环境因子[5].
喀斯特环境是一种脆弱的生态环境[6]. 喀斯特地区地形地貌特殊、 生境异质性强、 高温多雨但分布不均、 土壤瘠薄、 持水性能差, 生态系统的稳定性和抗干扰能力低[7]. 喀斯特生境的特殊性限制了植被的生存与发展, 因而在喀斯特地区形成了独特的具有嗜钙性、 耐旱性和石生性等特点的物种组成的岩溶植被[8]. 适生岩溶植被作为喀斯特生态系统的主体, 在维护生态系统稳定性、 保护物种多样性、 防止水土流失以及石漠化加剧等生态服务功能方面具有重要作用[9], 对喀斯特地区植被恢复与石漠化治理也具有重要的生态应用价值. 目前, 有关岩溶植物的适应性研究多集中在植物对特殊生境条件的生理生态适应机制方面[3,10], 而有关岩溶植物种群的适应行为研究较少.
山麻杆Alchorneadavidii为大戟科山麻杆属落叶丛生灌木, 喜光照, 对土壤要求不苛刻, 耐旱耐瘠薄, 萌蘖性强, 根系发达, 是较好的水土保持树种, 兼具园林和药用价值. 在喀斯特地区, 山麻杆多属人为干扰迹地自然恢复群落的常见物种, 在一些严重干扰的生境中甚至成为先锋群落的优势种或建群种. 由于严酷的生存环境及较强的生境异质性, 山麻杆种群分布环境差异较大, 环境因子对种群特征的影响明显. 本研究以重庆中梁山喀斯特生境适生岩溶物种山麻杆为研究对象, 阐明生境中环境因子对种群发展及分布的影响, 探究影响种群的主要环境因子以及各环境因子的相对重要性; 分析种群特征(种群密度、 种群盖度、 种群龄级、 种群动态指数、 集群度)与主要环境因子的关系, 揭示山麻杆种群对喀斯特生境的适应机理, 以期为山麻杆种群在喀斯特地区植被恢复中的应用提供理论依据.
1 研究方法
1.1 研究区概况
研究样方设于重庆歌乐山, 地理坐标29°39′-30°03′N, 106°18′-106°56′E. 研究区属亚热带湿润季风气候, 常年平均气温16.8 ℃, 年降水量约1 100 mm. 研究区为典型的喀斯特地貌, 属低山丘陵, 以石灰岩山地为主. 土壤为石灰岩发育的山地黄壤和山地黄棕壤. 1950年以前, 研究区植被主要以亚热带森林为主. 1950年以后, 森林遭到大量砍伐, 且人为干扰持续存在, 研究区分布有大面积亟待生态恢复的喀斯特低山砍伐迹地. 目前, 研究区内主要植被是以南天竹Nandinadomestica、 火棘Pyracanthafortuneana、 盐肤木Rhuschinensis、 芒Miscanthussinensis等为优势种的次生灌草群落. 山麻杆在区内分布广泛, 且多分布于人为干扰后的喀斯特生境中, 为次生演替初期群落的优势种.
1.2 研究方法
1.2.1 样地设置及种群调查方法
选择山顶、 高岩石裸露山坡、 低岩石裸露山坡、 山间洼地共4种生境, 其中山顶生境地势平坦, 植被覆盖度较低; 高岩石裸露山坡生境, 岩石裸露率较高, 植被覆盖度较高; 低岩石裸露生境, 岩石裸露率低, 地势较平坦; 山间洼地生境, 位于相邻丘陵间洼地中, 植被覆盖度最高. 每种生境设置10个5 m×5 m的样方, 共40个样方, 记录样方中灌木的个体数、 盖度、 基径、 高度和冠幅.
对山麻杆进行每木检尺, 记录其个体数、 高度、 冠幅、 基径, 以样方边界为坐标轴准确定位每一株山麻杆的坐标(x,y). 统计每个样方内山麻杆个数, 计算其平均密度、 盖度. 植株体积的计算使用了长短两个冠幅和地上部分高度3者的乘积[11], 依据植株体积的立方根(v)将山麻杆划分为5个大小等级, 并以大小等级反映山麻杆年龄等级: 龄级1,v≤40 cm, 为幼龄阶段; 龄级2, 40 cm
依据文献[13]将样方内山麻杆的群集度划分为1~5共5个等级, 集群等级由低到高植株的生长表现分别为: 单株生长、 小群或小丛生长、 小斑块生长成垫状、 大丛大斑块生长成地毯状以及大群或大片生长覆盖整个样方.
1.2.2 环境因子的调查方法
对所有样方中的环境因子进行调查, 包括地形、 人为干扰、 生物和土壤共4类17个因子.
地形因子: 地形地貌, 坡度、 坡位、 坡向、 岩石出露程度. 坡度和坡向赋值转化为等级, 坡度小于5°赋值为1, 5°~10°(不含)赋值为2, 10°~15°(不含)赋值为3, 15°~20°(不含)赋值为4, 20°~25°(不含)赋值为5, 25°~30°(不含)赋值为6, 超过30°赋值为7; 坡向东坡赋值为1, 西坡赋值为2, 北坡赋值为3, 东北坡或东南坡赋值为4, 南坡赋值为5, 西北坡或西南坡赋值为6[13]; 坡位分为上、 中、 下及洼地4类; 岩石出露程度用百分数计.
人为干扰因子: 依据样方植被距离道路的远近[14-15]及人为干预、 治理、 开发的年限, 采用相对影响法[14]进行量化. 如山间洼地样方1距离道路67 m, 山顶样方1距离道路28 m, 低岩石裸露山坡生境样方1距离道路8 m, 高岩石裸露山坡生境样方1距离道路7 m, 则道路距离因素对山间洼地种群样方1中山麻杆种群的干扰相对值为1, 山顶样方1为67 m/28 m=2.39, 低岩石裸露山坡生境样方1为67 m/8 m=8.38, 高岩石裸露山坡生境样方1为67 m/7 m=9.57. 人为干预、 治理、 开发年限产生的干扰相对值依此计算; 用干扰因子对种群干扰强度相对值的总和量化人为干扰强度.
生物因子: 记录群落物种组成、 高度、 盖度等, 计算每个样方内灌木层的Shannon-Wiener多样性指数、 Simpson优势度指数、 Pielou均匀度指数.
土壤因子: 在每个样方内随机设置3个取样点, 采集0~20 cm土层的土壤样品, 并将每个样地的土壤样品按四分法混合后带回实验室, 风干后进行土壤化学分析. 野外操作时采用IQ150土壤原位pH计(IQ Scientific Instruments, Inc., San Diego, CA, USA)测定土壤pH值; 采用烘干法测定土壤含水量; 土壤有机质(Organic matter, OM)测定采用重铬酸钾外加热法; 土壤全氮(Total nitrogen, TN)含量采用元素分析仪(德国CHNS-O)测定; 用碱解扩散法测定土壤碱解氮(Alkali-hydrolyzabale nitrogen, AN)含量; 土壤全磷(Total phosphorus, TP)、 速效磷(Available phosphorus, AP)含量采用钼锑抗比色法测定; 全钾(Total potassium, TK)、 速效钾(Available potassium, AK)采用原子吸收光谱仪测定.
1.2.3 数据分析
采用主成分分析(Principal component analysis, PCA)法对40个样方内17个环境因子进行降维分析[16-18], 提取出影响山麻杆种群特征的主要环境因子. 对山麻杆种群特征和主要环境因子进行Pearson相关分析, 并选择相关性高的因子进行回归分析. 主成分分析、 相关性分析和回归分析使用SPSS 19.0完成, 作图使用Origin 19.0完成.
2 结果与分析
2.1 山麻杆种群特征及环境因子特征
不同生境中山麻杆种群数量变化较大(表1), 而相同生境中各样方间差异较小. 高岩石裸露山坡生境中种群数量最大, 山顶生境中种群数量最少. 种群密度和种群盖度与种群数量变化规律相似. 各生境下种群集群度差异不大, 集群强度均为3,4等级, 表明山麻杆种群在各生境中多以聚集分布为主. 种群平均龄级在各样方中出现的最大值小于4, 表明各生境下山麻杆种群老龄树种较少, 种群均以幼龄、 中龄为主. 低岩石裸露山坡生境和高岩石裸露山坡生境中种群平均龄级分别为1.7和1.0, 小于山顶和山间洼地生境种群, 表明两个山坡种群多以幼龄为主, 种群处于发展阶段. 种群年龄结构动态指数在各生境种群中有较大差异, 其中高岩裸裸露山坡种群和低岩石裸露山坡种群较高, 较之山顶和山间洼地种群表现出较强的群增长能力. 各生境环境因子具有较大差别(表2), 充分反映了喀斯特生境的异质性特点.
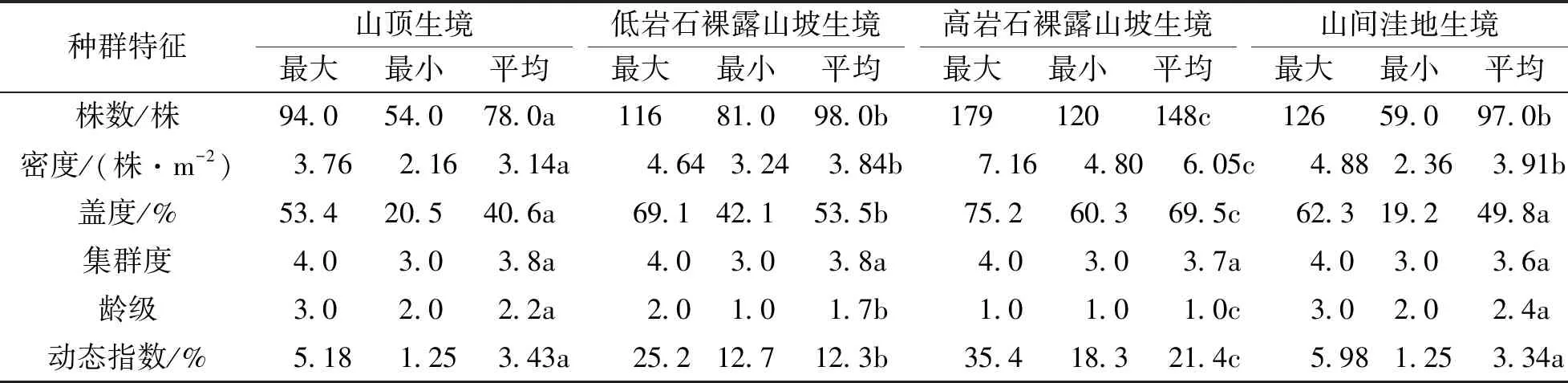
表1 4种生境下山麻杆种群特征
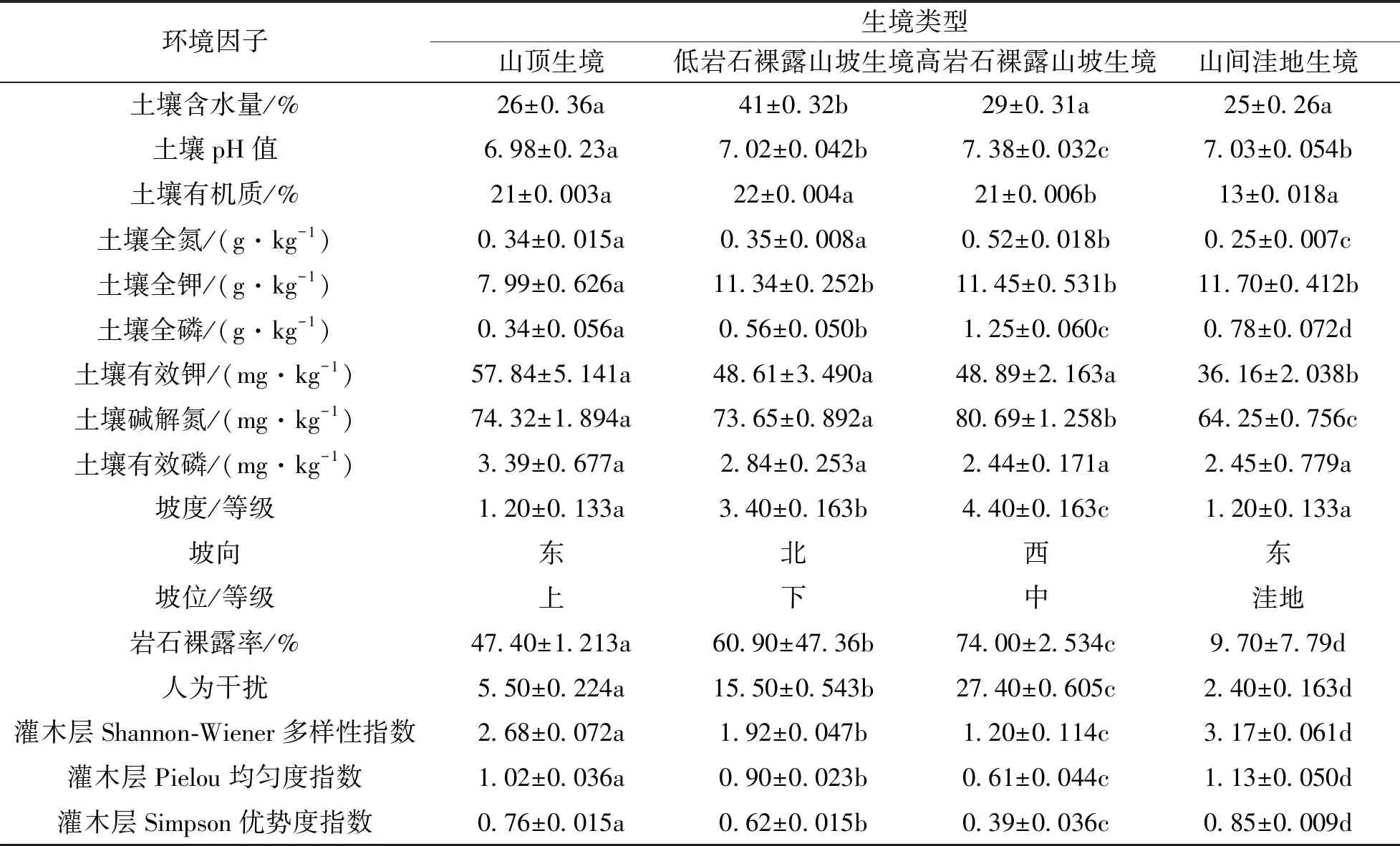
表2 不同种群生境环境因子统计(平均值±标准误)
2.2 山麻杆种群环境因子的主成分分析
特征值大于1.0的主成分有3个, 方差累计贡献率达到80%, 表明前3个主成分包括了绝大部分环境信息. 其中, 第1主成分贡献率为47.921%, 灌木层Shannon-Wiener多样性指数(-0.974)、 灌木层Simpson优势度指数(-0.945)、 灌木层Pielou均匀度指数(-0.909)、 干扰因素(0.957)、 坡度因子(0.904)、 土壤全氮含量(0.873)、 土壤碱解氮含量(0.795)、 岩石裸露程度(0.762)也占有较大负荷. 第1主成分综合了生物因素、 人为干扰和地形因素对种群的影响, 且包含了大多数环境因子的信息. 第2主成分方差贡献率为20.069%, 坡位(0.816)和土壤全钾含量(0.791)负荷量较大. 第3主成分方差贡献率为12.010%, 主要包含了土壤含水量和坡向等因子的信息(表3).
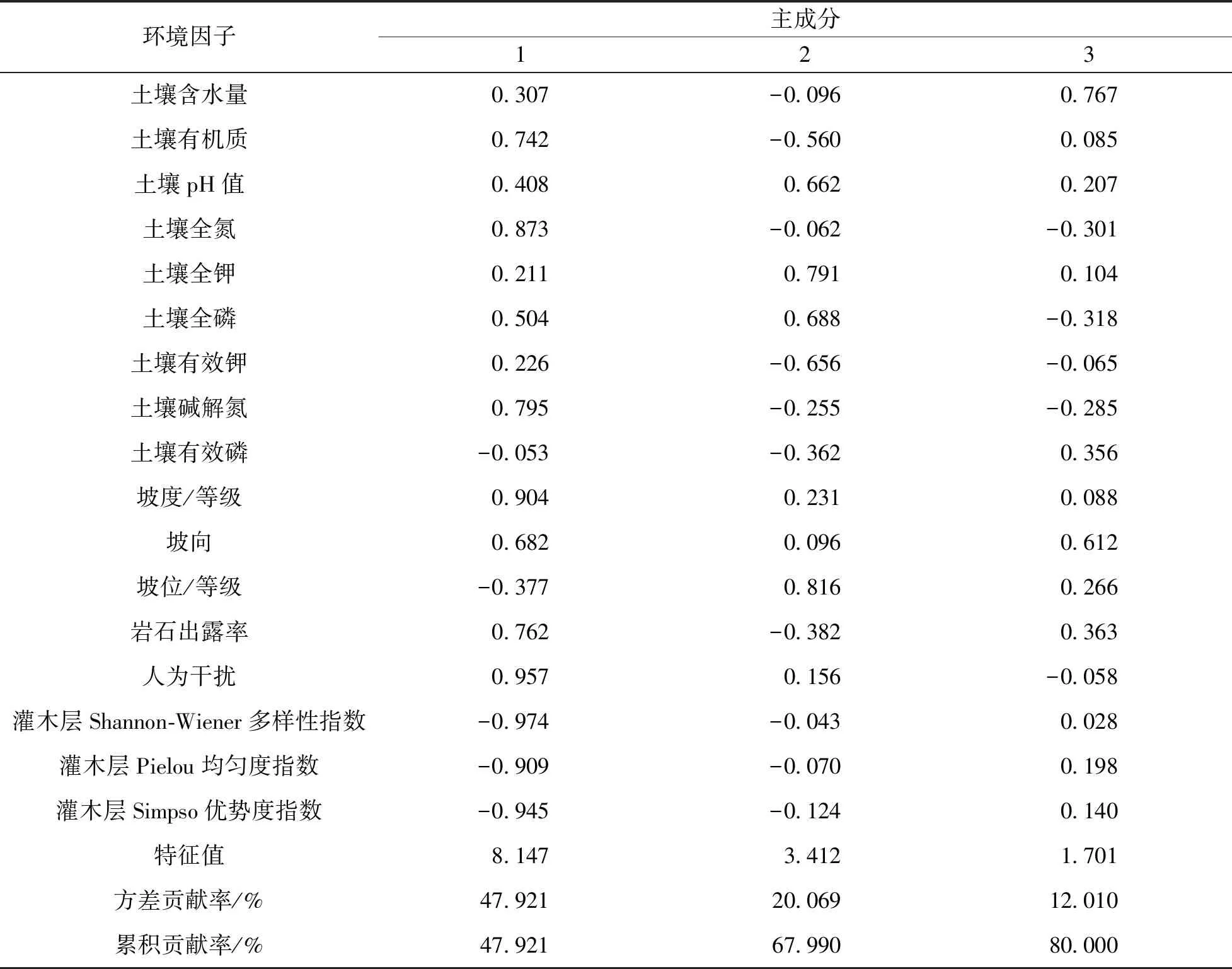
表3 环境因子的主成分载荷矩阵
对表3中3个主成分因子载荷矩阵进行运算, 得到主成分特征向量矩阵(表4). 其中, 各环境因子的权重等于因子i在m个主成分中的系数与各主成分方差贡献率之积求和, 由此计算出各环境因子的贡献率W[19](表4).
表4主成分分析显示, 17种环境因子中, 人为干扰因子(W=0.17), 灌木层Shannon-Wiener多样性指数(W=0.17)、 Pielou指数(W=0.15)和Simpson优势度指数(W=0.16)3个生物因子, 坡度(W=0.18)、 坡向(W=0.17)和岩石裸露率(W=0.11)3个地形因子, 以及土壤全氮(W=0.12)、 土壤全磷(W=0.13)、 土壤全钾(W=0.13)和土壤pH值(W=0.16)4个土壤因子均具有较高的贡献率, 表明这些环境因子是影响山麻杆种群生长和分布的主要因子, 有必要对其进行进一步分析.
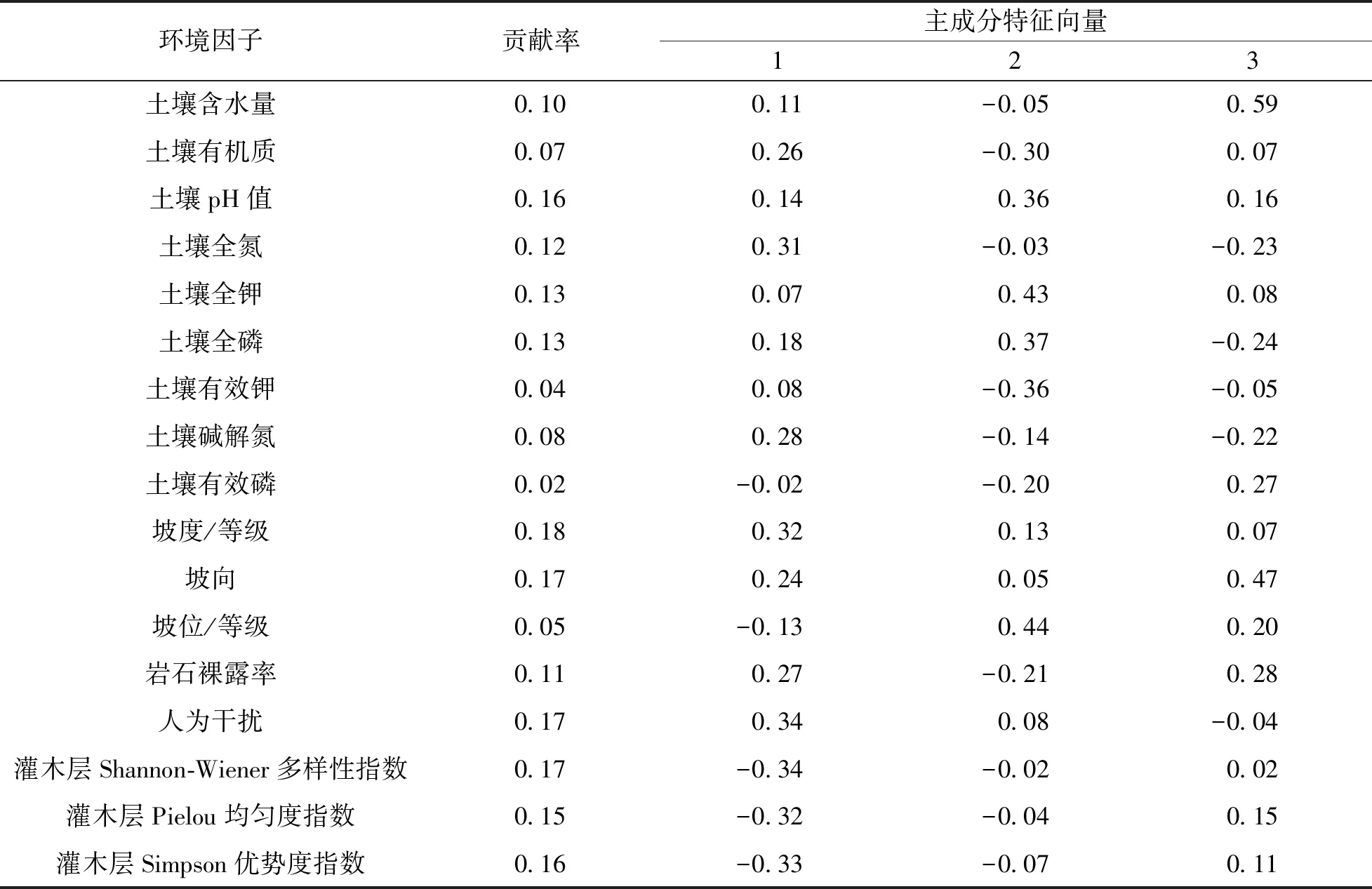
表4 3个主成分的特征向量及环境因子贡献率
2.3 山麻杆种群特征与主要环境因子的相关性分析
对筛选出的7个主要环境因子, 包括3个地形地貌因子(坡度、 坡向、 岩石裸露率)、 1个土壤因子(土壤pH值)、 2个生物因子(灌木层Shannon-Wiener多样性指数、 Simpson优势度指数)和人为干扰因子与样地种群特征(种群盖度、 种群密度、 平均龄级、 集群度、 种群动态指数)进行相关性分析. 结果表明: 山麻杆种群密度与生境地形坡度、 土壤pH值、 人为干扰因子呈显著正相关, 人为干扰对山麻杆种群密度表现为有利影响; 灌木层Shannon-Wiener多样性指数和Simpson优势度指数与种群密度呈显著负相关, 表明生境物种多样性越高, 山麻杆种群密度越小. 种群集群度与7个主要环境因子均无显著相关性. 种群龄级与土壤pH值、 地形坡度、 坡向、 岩石裸露率以及人为干扰均呈显著负相关, 与灌木层Shannon-Wiener多样性指数和Simpson优势度指数呈显著正相关, 表明山麻杆种群中高龄级多出现在物种多样性较高的生境中. 7种主要环境因子与种群年龄结构动态指数均有显著的相关性, 其中土壤pH值、 地形坡度、 坡向、 岩石裸露率以及人为干扰均达到极显著正相关, 与灌木层Shannon-Wiener多样性指数和Simpson优势度指数为显著负相关, 人为干扰等因子促进了种群增长, 而灌木物种多样性越高, 种群增长趋势越小(表5).
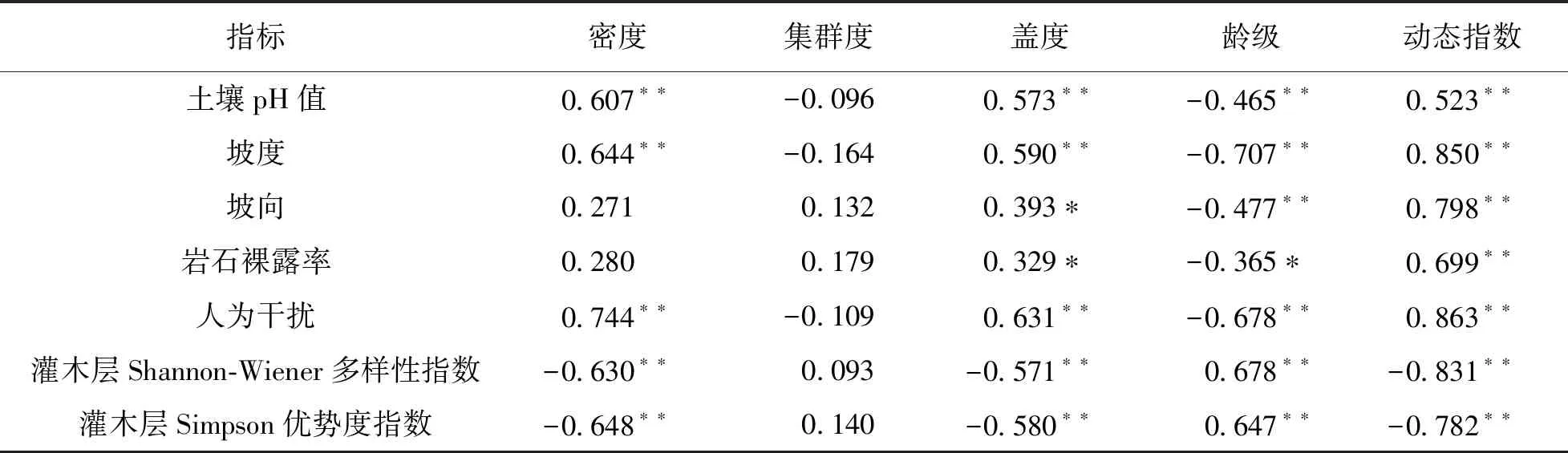
表5 山麻杆种群特征与其主要环境因子的相关系数
2.4 山麻杆种群特征与主要环境因子的回归分析
人为干扰和灌木层Shannon-Wiener多样性指数两个因子与山麻杆种群密度及动态指数间均表现出较好的线性回归关系(图1). 随着人为干扰强度增加, 山麻杆种群密度和种群动态指数也随之升高; 灌木层物种越丰富, 山麻杆种群密度越低, 种群动态指数也表现出下降趋势(图1).
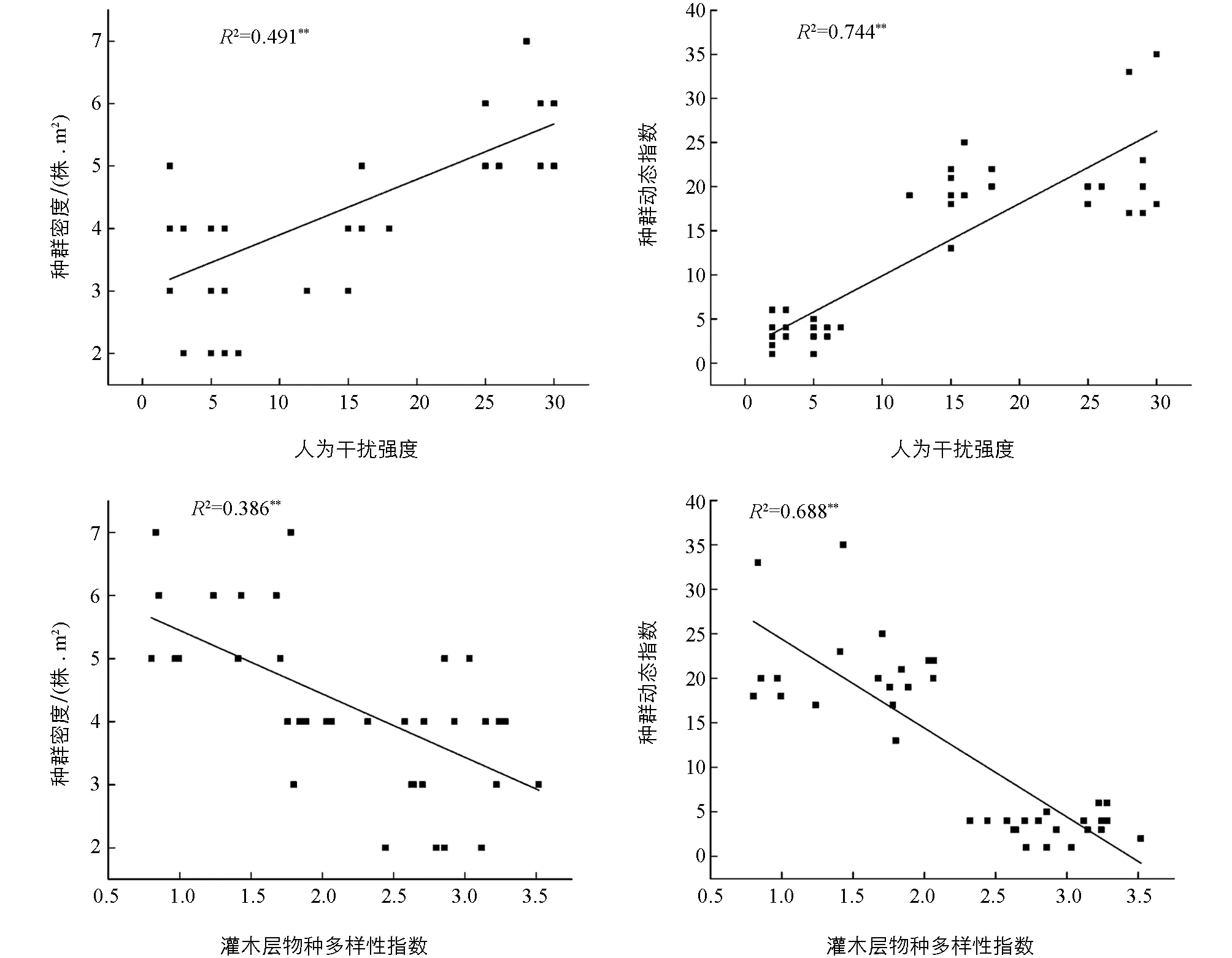
图1 主要环境因子与种群特征间的线性回归
3 讨论及结论
3.1 影响山麻杆种群特征的主要环境因子
不同喀斯特生境中山麻杆种群特征的差异是由区域环境变异和物种生态适应能力差异共同作用的结果, 山麻杆种群在生长和发展过程中受到多方面环境因素的影响. 本研究发现, 人为干扰、 灌木层物种多样性以及地形(坡度、 坡向、 岩石裸露程度)等因素是影响山麻杆种群生长和分布的主要环境因子. 以往的研究发现, 干扰或极度胁迫环境会促使许多木本植物萌蘖, 进而促进木本植物种群更新[20], 这与本研究的结果类似, 表明一定程度的人为干扰对山麻杆种群产生了有利影响, 适当的砍伐和筑路等行为促进了山麻杆的萌生更新, 但高强度和持续性的人为干扰(如研究区内大面积硬化和人工园林景观建设等)超过了种群自然更新能力上限, 将限制种群发展. 人为干扰后, 山麻杆种群形成了兼具实生和萌生的“双重更新”策略, 保留并发展了种群. 但是, 对于一些萌生能力较弱的非喀斯特木本种群, 如秦岭冷杉Abieschensiensis种群、 栓皮栎Quercusvariabilis种群和云南毒药树Sladeniacelastrifolia种群, 较强的人为干扰会使种群数量明显下降, 最终导致种群衰退[21-23]. 不同物种对干扰和生境的适应能力不同, 山麻杆种群适应干扰的更新策略使其在恶劣的喀斯特生境中得以保留, 并为种群提供了更为充分的幼苗库, 促进了种群发展.
物种间相互作用对种群生长和发展也有重要影响[24]. 本研究发现, 灌木层Shannon-Wiener多样性指数、 Simpson优势度指数和Pielou均匀度指数越高, 则山麻杆种群发展受到的限制越大, 这主要是因为物种越丰富的生境, 山麻杆种间面临的竞争压力越大, 因而限制了山麻杆种群的发展. 此外, 地形地貌可以通过对光照、 温度、 水分等因子的影响, 从而对植被的生长和分布产生间接影响[25]. 喀斯特生境异质性强, 岩石裸露率高, 复杂的地形地貌限制了其他物种的分布. 盛茂银等[26]在贵州石漠化地区开展植物多样性研究发现, 石漠化环境中植物群落组成简单, 物种丰富度低, 且随着石漠化加剧, 植被物种明显递减. 山麻杆种群可以在这种异质性高, 物种组成单一的环境中生长, 主要借助于较强的萌生能力, 从而在恶劣的生境中生存并发展种群. 复杂的地形地貌限制了其他物种的分布, 却利于山麻杆种群生长与发展, 这对石漠化治理有特殊意义[27].
本研究发现, 人为干扰、 坡度、 土壤pH值与山麻杆种群密度和盖度之间呈显著正相关, 适度的人为干扰通过增加山麻杆的萌生更新促进种群发展; 地形坡度等因子通过限制其他植被分布对山麻杆种群密度和盖度有利; 土壤酸碱性也是影响植物种群生长的限制性要素[28], 在一定程度上会影响植物物种的分布及多样性[29]. 姜培坤等[30]对石灰岩荒山造林后土壤养分变化的研究发现, 石灰岩荒山表层土壤有较高的土壤pH值, 不利于植物生长, 但山麻杆对碱性土壤具有较强的耐受性, 因此种群可以顺利发展. 此外, 生境灌木层物种多样性指数和优势度指数与种群密度和盖度呈显著负相关, 表明种间竞争是限制种群密度的主要原因. 种群集群度与7个主要环境因子均无显著相关性, 山麻杆种群在不同生境中均多集群分布为主, 不同尺度下种群分布类型可能不同, 本研究中样方尺度单一可能是导致相关性不显著的原因. 种群龄级与生境物种多样性指数、 优势度指数等呈显著正相关, 而与人为干扰、 地形坡度、 岩石裸露程度等因素呈显著负相关. 土壤pH值、 坡度、 坡向、 石漠化程度以及人为干扰与种群动态指数之间均达到极显著正相关, 人为干扰和恶劣的地形均促进了山麻杆种群更新. 物种多样性与动态指数为显著负相关, 生境灌木层物种多样性越高, 个体生长受到竞争的限制越大, 增长能力处于较低水平.
3.2 山麻杆对喀斯特生境的独特适应性
喀斯特是典型的脆弱生态系统, 稳定性差, 抗干扰能力弱, 在遭到人为干扰破坏后, 植被恢复十分困难. 喀斯特生境中的山麻杆能够凭借较强的适应性和独特的种群行为得以保留, 其独特的适应性具有重要的生态应用价值.
本研究发现, 人为干扰通过植株萌蘖对山麻杆种群的发展起到明显的促进作用. 喀斯特生境异质性强, 岩石裸露率高, 复杂的地形地貌限制了植被分布, 但山麻杆可以借助较强的萌蘖能力及耐旱耐贫瘠特性, 在复杂多样的石坑、 石缝等生境中发展种群. 山麻杆独特的适应性是其对喀斯特生境长期适应的结果, 也是将其应用在石漠化地区人为干扰迹地植被恢复中的主要依据.

