新疆和云南番茄潜叶蛾种群对六种杀虫剂的敏感性及其与解毒酶活性的关系
李晓维, 马 琳, 吕要斌
(浙江省农业科学院植物保护与微生物研究所, 农产品质量安全危害因子与风险防控国家重点实验室, 杭州 310021)
番茄潜叶蛾Tutaabsoluta是一种世界性入侵昆虫,其起源于南美洲,2006年传入欧洲,目前已在南美洲、欧洲、非洲和亚洲的90多个国家和地区有报道,是番茄等茄科作物上毁灭性的害虫(Desneuxetal., 2010; Biondietal., 2018)。中国西北和西南接壤的多个国家,如俄罗斯、哈萨克斯坦、吉尔吉斯斯坦、塔吉克斯坦、印度和尼泊尔已被该虫成功入侵(Izhevskyetal., 2011; Camposetal., 2017; Esenali Uuluetal., 2017; Sankarganeshetal., 2017; Zharmukhamedova and Shlyakhtich, 2017; Saidovetal., 2018)。番茄潜叶蛾可为害番茄、马铃薯、茄子、甜椒和烟草等茄科的经济作物,但最嗜好番茄(Desneuxetal., 2010)。其幼虫是主要为害虫态,潜入叶片、嫩芽、茎干、果实为害,严重发生时可造成80%~100%的损失(Desneuxetal., 2010)。2017年,番茄潜叶蛾在新疆伊犁地区发生为害(李栋等, 2019; 李晓维等, 2019; 张桂芬等, 2019),其后在云南地区亦发现该虫(张桂芬等, 2020),目前在贵州、四川、重庆、广西、湖南、江西等地相继发现(陆永跃, 2021),对我国的番茄产业产生重大威胁。
化学农药是防治番茄潜叶蛾的最重要工具之一。然而,番茄潜叶蛾潜入植物组织为害的习性致使喷施化学农药的防效很低(Guedes and Siqueira, 2012; Biondietal., 2018)。另外,由于化学农药的大量不合理使用,番茄潜叶蛾已对多种杀虫剂产生了抗性(Guedesetal., 2019),例如对有机磷类(Siqueiraetal., 2000a; Liettietal., 2005; Haddietal., 2017; Baratietal., 2018), 拟除虫菊酯类(Haddietal., 2012; Biondietal., 2015), 多杀菌素(Camposetal., 2014; Camposetal., 2015b), 阿维菌素 (Siqueiraetal., 2001; Silvaetal., 2016b),巴丹(Siqueiraetal., 2000b),茚虫威(Roditakisetal., 2018)和双酰胺类(Silvaetal., 2019; Boaventuraetal., 2020)等。由于各国用药情况及用药历史并不相同,各地种群对不同杀虫剂的抗性水平差异较大。番茄潜叶蛾作为新入侵我国的外来入侵害虫,其对药剂敏感性尚未知,因此应当加强番茄潜叶蛾的抗药性监测,并根据不同地区的抗药性现状制定合理的用药方案,以期实现对该虫的有效防治。
1 材料与方法
1.1 供试虫源
番茄潜叶蛾室内敏感种群:番茄潜叶蛾初始种群于2018年7月采自新疆维吾尔族自治区伊犁哈萨克自治州察布查尔锡伯自治县安班巴格村的番茄田(43°49′40.00″N, 81°12′11.01″E),在人工气候室内(温度25±1℃,相对湿度60%±5%,光周期16L∶8D),以未接触过杀虫剂的番茄为寄主植物进行继代饲养至实验使用时。
番茄潜叶蛾田间种群:新疆种群幼虫于2019年5月采自新疆维吾尔族自治区伊犁哈萨克自治州察布查尔锡伯自治县安班巴格村的番茄田(43°49′40.00″N, 81°12′11.01″E);云南种群幼虫于2019年6月采自云南省玉溪市的番茄田(24°34′16″N, 102°57′78″E)。田间种群幼虫(F1代)以未接触过杀虫剂的番茄为寄主植物在人工气候室(温度25±1℃,相对湿度60%±5%,光周期16L∶8D)饲养,选取F2代2龄幼虫用于药剂敏感性测定和解毒酶活性测定。
1.2 药剂和试剂
97%甲氨基阿维菌素苯甲酸盐(emamectin benzoate)原药、95%氯虫苯甲酰胺(chlorantraniliprole)原药、96%茚虫威(indoxacarb)原药、95%高效氯氰菊酯(beta-cypermethrin)原药、96%多杀菌素(spinosad)原药、95%溴虫腈(chlorfenapyr)原药均购于江西正邦作物保护有限公司。
细胞色素P450酶(CYP450)抑制剂95%胡椒基丁醚(PBO)、酯酶抑制剂98%磷酸三苯酯(TPP)、谷胱甘肽S-转移酶(GST)抑制剂96%丁烯二酸二乙酯(DEM)购于生工生物工程(上海)股份有限公司。
昆虫细胞色素P450(CYP450)酶联免疫吸附测定试剂盒、昆虫谷胱甘肽S-转移酶(GST)酶联免疫吸附测定试剂盒、昆虫羧酸酯酶(CarE)酶联免疫吸附测定试剂盒购于上海江莱生物科技有限公司。
1.3 室内毒力测定
本研究基于杀虫剂抗性行动委员会(Insecticide Resistance Action Committee, IRAC)第22 号方法进行改进,采用全叶浸叶法测定番茄潜叶蛾室内敏感种群、新疆和云南种群对6种药剂的敏感性(Roditakisetal., 2013)。6种药剂原药先用丙酮配制成高浓度母液,再用含0.1%曲拉通的水溶液将母液稀释配成5~7个浓度(含对照)。将番茄叶片(最长处7~9 cm长,最宽处3~5 cm)在药液中浸15 s,迅速取出并晾干,之后接入滤纸保湿的培养皿(直径10 cm)中,每个培养皿接入2龄幼虫5头,用封口膜密封培养皿边缘,随后放入恒温养虫室(温度25±1℃,相对湿度60%±5%,光周期16L∶8D),48 h后检查幼虫存活状况。用毛笔尖轻触虫体,若虫体无反应或虫体严重变形则视为死亡。每个浓度处理重复6次。抗性倍数=田间种群LC50/室内种群LC50。
1.4 增效剂对杀虫剂的增效作用测定
选取抗性最高的氯虫苯甲酰胺作为供试药剂,对室内敏感种群和新疆的田间抗性种群进行增效剂试验。将酶抑制剂PBO, TPP和DEM用丙酮稀释100 mg/L,分别加入到系列浓度的氯虫苯甲酰胺溶液中,用浸液法处理试虫,方法参照1.3节。统计杀虫剂单用、药剂+增效剂的LC50值,计算增效比(SR)、抗敏增效比(R/S)和相对增效系数r0。SR=LC50(杀虫剂单用)/LC50(杀虫剂+增效剂);R/S=抗性种群的增效比/敏感种群的增效比;r0%=(A-B)/C×100,其中A=杀虫剂单用对抗性种群的LC50-杀虫剂和增效剂联用对抗性种群的LC50,B=杀虫剂单用对敏感种群的LC50-杀虫剂和增效剂联用对敏感种群的LC50,C=杀虫剂单用对抗性种群的LC50(何林, 2003; 段辛乐等, 2011)。
1.5 酶活力测定
室内敏感种群和新疆抗性种群各取10头2龄幼虫,称重后加入玻璃匀浆器,加入预冷的PBS(0.01 mo/L, pH 7.4)(1∶20, m/v),于冰上充分研磨,最后将匀浆液离心,取上清监测。每个种群3个重复。
昆虫CYP450,GSTs和CarE活性测定分别参照试剂盒说明书进行。从室温平衡60 min后的铝箔袋中取出所需板条,设置标准孔、空白孔和样本孔,标准品孔各加不同浓度的标准品50 μL。在样本孔加待测样本50 μL,空白孔加样本稀释液50 μL。空白孔、标准品孔和样本孔每孔加入辣根过氧化物酶(HRP)标记的检测抗体100 μL,用封板膜封住反应孔,37℃水浴锅或恒温箱温育60 min。弃去液体,吸水纸上拍干,每孔加满洗涤液350 μL,静置1 min,甩去洗涤液,吸水纸上拍干,如此重复洗板5次。每孔加入底物A和B各50 μL,15 min内,在450 nm波长处测定各孔的OD值。
以标准品浓度为横坐标,对应OD值为纵坐标,绘制出标准品线性回归曲线,按曲线方差计算各样本酶活性。
1.6 数据分析
用SPSS软件计算LC50、95%置信区间、斜率、标准误。利用独立样本t检验分析比较抗性和敏感种群之间3种解毒酶比活力之间的差异显著性。
2 结果
2.1 不同番茄潜叶蛾种群对6种杀虫剂的敏感性
采用番茄潜叶蛾室内种群建立了其对6种杀虫剂的相对敏感性基线。结果表明,甲维盐、氯虫苯甲酰胺和溴虫腈对番茄潜叶蛾室内敏感种群的毒力较高, LC50值分别为0.033, 0.167和0.599 mg/L,小于1 mg/L;其次是多杀菌素和茚虫威,LC50值分别为1.121和1.582 mg/L,在1~2 mg/L之间;高效氯氰菊酯的毒力最小,LC50值为13.533 mg/L(表1)。
云南种群对6种杀虫剂的敏感性由高到低依次为甲维盐、溴虫腈、多杀菌素、茚虫威和氯虫苯甲酰胺和高效氯氰菊酯。与室内敏感种群相比,云南种群对6种杀虫剂产生了不同水平的抗性。抗性倍数由高到低分别是氯虫苯甲酰胺、甲维盐、溴虫腈、多杀菌素、茚虫威和高效氯氰菊酯。氯虫苯甲酰胺对云南种群的LC50为35.513 mg/L,云南种群对氯虫苯甲酰胺产生了高水平抗性,抗性倍数为212.7;甲维盐对云南种群的LC50为1.982 mg/L,云南种群对甲维盐抗性水平中等,抗性倍数为61.0;溴虫腈、多杀菌素和茚虫威对云南种群的LC50分别为14.323, 22.337 和28.987 mg/L,云南种群对溴虫腈、多杀菌素和茚虫威的抗性水平较低,抗性倍数分别为23.9, 19.9和18.3;高效氯氰菊酯对云南种群的LC50值为53.211 mg/L,云南种群对高效氯氰菊酯的抗性水平最低,抗性倍数为3.9(表1)。
新疆种群对6种杀虫剂的敏感性由高到低依次为甲维盐、溴虫腈、氯虫苯甲酰胺、多杀菌素、茚虫威和高效氯氰菊酯。与室内敏感种群相比,新疆种群对6种杀虫剂产生了不同水平的抗性。抗性倍数由高到低分别是氯虫苯甲酰胺、甲维盐、多杀菌素、溴虫腈、茚虫威和高效氯氰菊酯。氯虫苯甲酰胺对新疆种群的LC50为28.271 mg/L,新疆种群对氯虫苯甲酰胺产生了高水平抗性,抗性倍数为169.3;甲维盐对新疆种群的LC50为2.186 mg/L,新疆种群对甲维盐抗性水平中等,抗性倍数为67.3;多杀菌素和溴虫腈对新疆种群的LC50分别为28.933和13.322 mg/L,新疆种群对多杀菌素和茚虫威的抗性水平较低,抗性倍数为25.8和20.0;高效氯氰菊酯对新疆种群的LC50值为58.044 mg/L,新疆种群对高效氯氰菊酯的抗性水平低,抗性倍数为4.3(表1)。
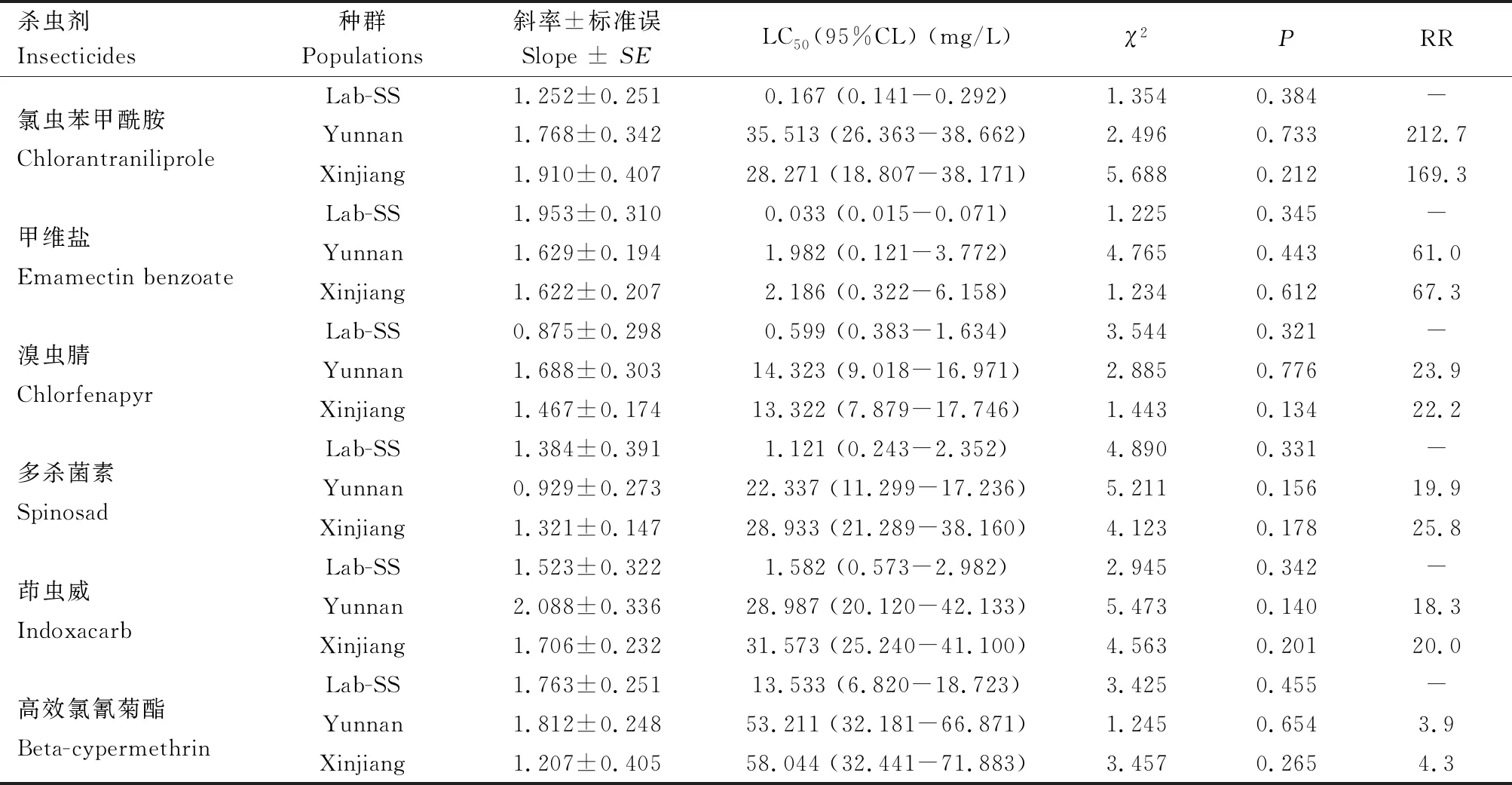
表1 不同番茄潜叶蛾种群对6种杀虫剂的敏感性
2.2 增效剂对氯虫苯甲酰胺的增效作用
表2结果表明,PBO在敏感种群中对氯虫苯甲酰胺的增效比为2.04倍,在新疆抗性种群中对氯虫苯甲酰胺的增效比为3.39倍,抗敏增效比为1.66,相对增效系数为70.23;TPP在敏感种群中对氯虫苯甲酰胺的增效比为1.25倍,在新疆抗性种群中对氯虫苯甲酰胺的增效比为1.36倍,抗敏增效比为1.09,相对增效系数为26.62;DEM在敏感种群中对氯虫苯甲酰胺的增效比为1.64,在新疆抗性种群中对氯虫苯甲酰胺的增效比为1.97,抗敏增效比为1.20,相对增效系数为49.10。增效剂PBO, TPP和DEM均对氯虫苯甲酰胺无明显增效作用。在番茄潜叶蛾幼虫体内的3种代谢酶活性受抑制时,氯虫苯甲酰胺对番茄潜叶蛾毒力没有显著变化,其结果表明番茄潜叶蛾体内代谢解毒酶不是番茄潜叶蛾对氯虫苯甲酰胺产生抗性的主导因素。
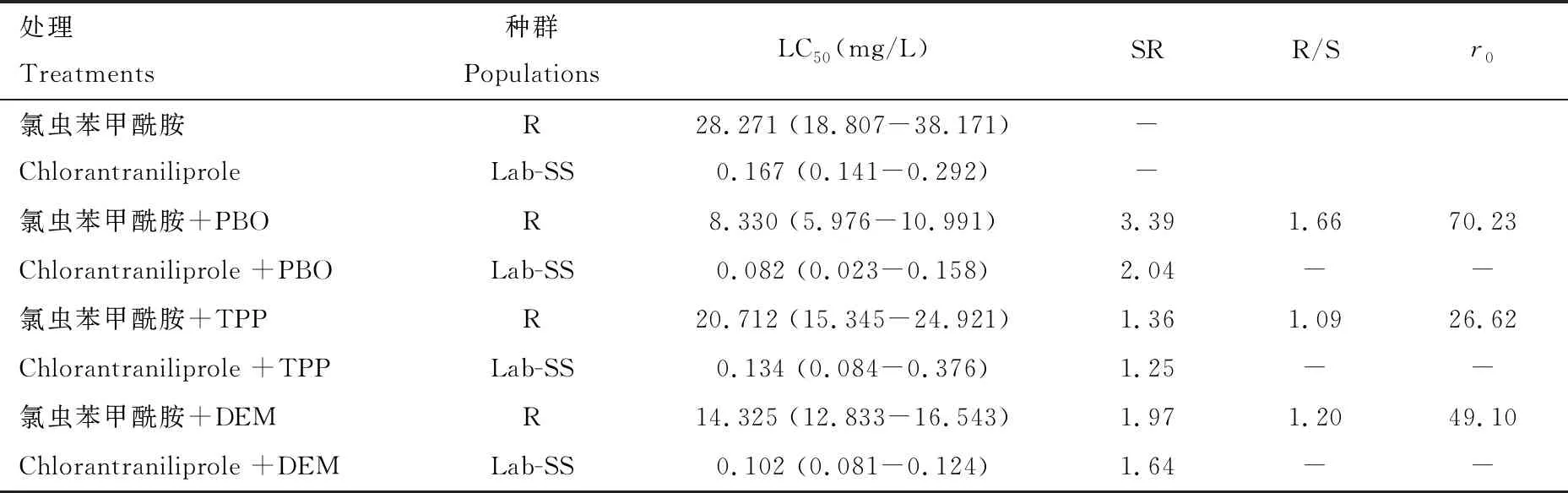
表2 3种增效剂在氯虫苯甲酰胺对番茄潜叶蛾室内敏感种群和田间抗性种群2龄幼虫毒力中的增效作用
2.3 番茄潜叶蛾敏感种群和抗性种群体内解毒酶活力比较
酶活性分析结果(表3)表明,番茄潜叶蛾敏感种群和抗性种群的CYP450活性分别为3.54和3.71 ng/mL,抗敏活性比为1.05,两者差异不显著(t=-1.670,df=4,P=0.170);敏感种群和抗性种群的GST活性分别为138.08和151.09 mIU/L,抗敏活性比为1.09,两者差异不显著(t=-1.257,df=4,P=0.277);敏感种群和抗性种群的CarE活性分别为33.27和35.01 mIU/L,抗敏活性比为1.05,两者差异不显著(t=-0.394,df=4,P=0.714)。以上结果表明3种解毒代谢酶在番茄潜叶蛾对氯虫苯甲酰胺抗性中均没有发挥作用。
3 讨论
药剂敏感性测定结果显示,新疆和云南两个番茄潜叶蛾田间种群对6种药剂的敏感性相似,均为对甲维盐的敏感性最高,对溴虫腈的次之,对高效氯氰菊酯的敏感性最低(表1)。因此,甲维盐和溴虫腈可作为推荐药剂用于番茄潜叶蛾的田间防治,而高效氯氰菊酯不推荐用于该虫的防治。多杀菌素、氯虫苯甲酰胺和茚虫威对两个田间种群的LC50多在20~30 mg/L之间,与室内敏感种群相比,新疆和云南种群氯虫苯甲酰胺抗性倍数已达169和213倍,达到了高水平抗性(>100倍),新疆和云南种群多杀菌素和茚虫威抗性倍数均达到了中等抗性水平(20倍左右)(表1),因此,田间防治过程中也应限制使用。另外,不同作用机理的药剂间交替轮换使用也是抗性治理的重要方法。
拟除虫菊酯类药剂早在20世纪70年代开始用于南美洲的番茄潜叶蛾(Liettietal., 2005),番茄潜叶蛾随后逐渐对拟菊虫酯类药剂产生了抗性(Guedesetal., 1994; Salazar and Araya, 2001)。目前,番茄潜叶蛾对拟除虫菊酯类药剂的抗性已在南美洲的阿根廷(Liettietal., 2005)、智利(Salazar and Araya, 2001)和巴西(Siqueiraetal., 2000a; Silvaetal., 2015),欧洲的西班牙、意大利和葡萄牙(Haddietal., 2012),中东的伊朗(Zibaeeetal., 2018)以及非洲的尼日利亚(Balaetal., 2019)等国家出现。我国两地番茄潜叶蛾拟除虫菊酯类药剂抗性种群的普遍存在可能是由于入侵地大量使用该药剂有关,更有可能是入侵种群本身就是抗性种群(Guedes and Siqueira, 2012)。本研究结果显示,高效氯氰菊酯对新入侵我国的番茄潜叶蛾两个种群的LC50均非常高(>50 mg/L),对室内饲养的相对敏感种群的LC50也较高,为13.533 mg/L(表1),证明入侵我国的番茄潜叶蛾种群本身对拟除虫菊酯类药剂具有较高的抗性。
本研究中的室内种群仅在室内饲养1年,为相对敏感种群,对不同药剂的敏感性分布会存在差异。例如,其对溴虫腈的毒力方程斜率b值较低,对溴虫腈敏感性分布不均匀,但对其他5种药剂的敏感性分布相对较均匀。因此,进一步筛选对溴虫腈敏感性分布均匀的室内敏感种群,用于制定番茄潜叶蛾对溴虫腈的敏感基线,将有助于番茄潜叶蛾溴虫腈抗性研究。与室内敏感种群相比,新疆和云南两个田间种群的氯虫苯甲酰胺抗性倍数最高,分别为169和213倍,达到了高水平抗性。一方面,该结果可能与室内种群对氯虫苯甲酰胺抗性水平迅速衰退有关,另一方面可能与田间双酰胺类药剂的不合理应用有关。由于双酰胺类杀虫剂对鳞翅目害虫的防效极佳,被广泛用于小菜蛾、甜菜夜蛾和番茄潜叶蛾等鳞翅目害虫的防治(刘宴弟等, 2020; Richardsonetal., 2020)。在南美洲、欧洲以及新入侵的国家,番茄潜叶蛾的化学防治过度依赖于双酰胺类杀虫剂(Desneuxetal., 2010; Roditakisetal., 2018),导致该类药剂虽是最近才开始用于番茄潜叶蛾防治的一类新型药剂,但在巴西、欧洲各国和以色列已有番茄潜叶蛾对双酰胺类药剂抗性的报道 (Camposetal., 2015a; Roditakisetal., 2015, 2017, 2018; Silvaetal., 2016a, 2019; Grantetal., 2019)。
双酰胺类杀虫剂的抗性机理主要包括代谢抗性和靶标抗性(Richardsonetal., 2020)。本研究增效剂对杀虫剂毒力的增效试验结果(表2)表明,增效剂PBO, TPP和DEM均对氯虫苯甲酰胺无明显增效作用。同时,室内敏感种群和田间抗性种群之间细胞色素P450酶、谷胱甘肽S-转移酶和羧酸酯酶3种解毒酶活力没有显著差异(表3)。以上结果表明,番茄潜叶蛾氯虫苯甲酰胺抗性与解毒酶的代谢无关。该结果与前期研究结果一致,巴西学者通过增效剂试验证明番茄潜叶蛾氯虫苯甲酰胺抗性与酯酶、谷胱甘肽S-转移酶和细胞色素P450酶无关(Silvaetal., 2019)。已有研究证明,番茄潜叶蛾对氯虫苯甲酰胺的抗性与小菜蛾相似,是由鱼尼丁受体(ryanodine receptor)点突变引起的,突变位点G4946E/V和I4790 M/T与意大利种群的抗性有关,突变位点G4946E/V与希腊种群的抗性有关(Roditakisetal., 2017)。进一步研究中国新入侵种群的鱼尼丁受体突变情况及突变频率将有利于明确中国种群对氯虫苯甲酰胺的抗性机理。
综上所述,本研究结果对番茄潜叶蛾的田间防治和抗性治理具有指导意义。同时,进一步明确入侵我国番茄潜叶蛾种群的抗性机理、综合应用多种防治方法仍是该害虫综合治理的关键。

