基于磷酸溶液的阿司匹林肠溶片HPLC法含量测定
李安桂,班良红,李安萍
(1.贵阳职业技术学院,550000;2.贵州省清镇市巢凤社区服务中心,551400;3.贵州省清镇市第三中学,551400)
0 引言
阿司匹林肠溶片是阿司匹林(乙酰水杨酸)的肠溶制剂,其主要成分为2-(乙酰氧基)苯甲酸,又称为阿司匹林、乙酰水杨酸,因其具有解热、镇痛、抗炎、抗风湿及抗血小板聚集等作用,早期作为较广、较普通的解热镇痛和抗风湿药物。阿司匹林肠溶片是现市售药品中比较常见、常用的制剂,其药用机理主要是对血小板的聚集有一定的抑制作用,因此,该药可用于解热、疼痛及类风湿性关节炎,同时可降低急性心肌梗死疑似患者及稳定性和不稳定性心绞痛患者的发病风险,并对心肌梗死复发、大手术后深静脉血栓和肺栓塞等都有一定的预防功效,但过量服用乙酰水杨酸,轻者会出现头痛头晕、耳鸣耳聋、恶心呕吐等,重者可能出现血尿、抽搐、幻觉、重症神经紊乱、呼吸困难等症状。因此,阿司匹林肠溶片中乙酰水杨酸的含量不但影响疗效,还会影响到阿司匹林肠溶片的安全性。根据《中国药典》2020年版规定,阿司匹林肠溶片中乙酰水杨酸含量,应为其标示含量的93.0%~107.0%,现有阿司匹林肠溶片中乙酰水杨酸含量测定方法,执行《中国药典》2020年版二部[3]的标准,以1%的冰醋酸-甲醇溶液为溶剂,以十八烷基键合硅胶为填充剂,以乙腈-四氢呋喃-冰醋酸-水(20∶5∶5∶70)为流动相,在紫外检测器276 nm波长处测定,此方法虽结果比较稳定,但流动相相对较复杂,且流动相微小的变化,对含量测定的结果影响较大。因此,本文将以十八烷基键合硅胶为填充剂,以50%的乙醇溶液超声提取,以0.1%磷酸溶液-乙腈(1∶1)为流动相,保持其他色谱条件不变的情况下,对市售的四家药品生产企业中20个批次的阿司匹林肠溶片中乙酰水杨酸的含量进行测定,对基于磷酸溶液的阿司匹林肠溶片HPLC法含量测定进行深入研究分析。
1 仪器、药品及试剂
高效液相色谱仪(日本岛津LC-20A),电子分析天平(FA1004B,上海精密仪器仪表有限公司),超声仪(EVA-DC-1200S、湖南东威华达清洗设备有限公司)色谱乙醇(天津市康科德科技有限公司),色谱甲醇(上海恒奇仪器仪表有限公司),乙酰水杨酸对照品(中国药品生物制品检定所提供—含量测定用)、乙腈(南京化学试剂股份有限公司)。阿司匹林肠溶片(现有市售随机抽取样品)。
2 实验方法
2.1 色谱条件
色谱柱:C18柱Ø4·6 mm×250 mm,5 μm(迪马公司);柱温箱温度为30 ℃;紫外检测器检查波长为276 nm;流动相为0.1%磷酸-乙腈(1:1);流速为1 mL/min;理论板数根据《中国药典》2020年版不低于3000分离度符合要求。
2.2 线性关系试验
用电子分析天平,精密称取乙酰水杨酸对照品0.1000 g,加50%色谱乙醇溶液10 mL,用超声仪超声提取30 min,溶解后转移至100 mL容量瓶中,用纯净水稀释到规定刻度,即得乙酰水杨酸标准贮备液(浓度为1 mg/mL),另分别精密量取上述贮备液0.50 mL、1.00 mL、1.50 mL、2.00 mL、2.50 mL、3.00 mL、3.50 mL、4.00 mL、4.50 mL、5.00 mL至50 mL容量瓶中,用纯净水稀释至刻度,以2.1的色谱条件,进样体积为10 μL,结果如表一、图一:

表1 线性关系实验对照品溶液配制表

图1 乙酰水杨酸对照品标准曲线
以上实验结果表明,在上述色谱条件下,以上对照品色谱峰面积线性关系良好。回归方程:Y=11834x+4321.3,R2=0.9999。
2.3 回收试验
用电子分析天平,精密称取乙酰水杨酸对照品0.1000 g,加50%色谱乙醇溶液10 mL,用超声仪超声提取30 min,溶解后转移至100 mL容量瓶中,用纯净水稀释到规定刻度,即得乙酰水杨酸标准贮备液(浓度为1 mg/mL),再精密量取5 mL标准贮备液至100 mL容量瓶中,加纯净水稀释至规定刻度,即得每1mL中含有乙酰水杨酸50 μg的对照品溶液,取10 μL注入液相色谱仪;另称取已知含量的阿司匹林肠溶片细粉适量(约相当于乙酰水杨酸20 mg),用50%的色谱乙醇溶液,超声溶解30 min,然后将溶液转移至 100 mL量瓶中,接着在各瓶分别加入上述对照品溶液1.00 mL、1.50 mL、2.00 mL混匀,加纯净水稀释至规定刻度,摇匀,滤过,取续滤液10 μL注入液相色谱仪中,同法测定,测定结果按外标法计算,加1.00 mL对照品试验回收率为99.56%、加1.50 mL对照品试验回收率为98.79%、加2.00 mL对照品试验回收率为102.31%通过计算,得到RSD值分别为0.94%、0.20%、0.89%,平均回收率为100.22%。加标回收实验表明,运用本法测定阿司匹林肠溶片中的乙酰水杨酸含量时,加标回收实验能满足含量测定要求。
2.4 重复性试验
对照品溶液:用电子分析天平,精密称取乙酰水杨酸对照品0.1000 g,加50%色谱乙醇溶液10 mL,用超声仪超声提取30 min,溶解后转移至100 mL容量瓶中,用纯净水稀释到规定刻度,即得乙酰水杨酸对照品贮备液(浓度为1 mg/mL)。
供试品溶液:取阿司匹林肠溶片供试品适量,经合适的前处理方法处理后,精密称取细粉6份,每份0.1000 g(含乙酰水杨酸相当于100 mg),加50%色谱乙醇溶液10 mL,用超声仪超声提取30 min,溶解后转移至100 mL容量瓶中,用纯净水稀释到刻度,另精密量取5 mL至100 mL容量瓶中,加纯净水稀释至刻度,即得阿司匹林肠溶片供试品溶液,进行含量测定。
按照标准曲线法,精密吸取上述对照品贮备液0.00 mL、1.00 mL、2.00 mL、3.00 mL、4.00 mL、5.00 mL于6支经过校对合格后的100 mL的容量瓶中,加纯净水稀释至刻度,分别取10 μL注入液相色谱仪中,以所得的色谱峰峰面积为y、对照品浓度为x,做标准曲线,得到曲线方程y=1183.4x+431.87、R2=0.9999。
按照标准曲线含量测定方法、依次测定6个供试品含量,得到测定结果如表二。
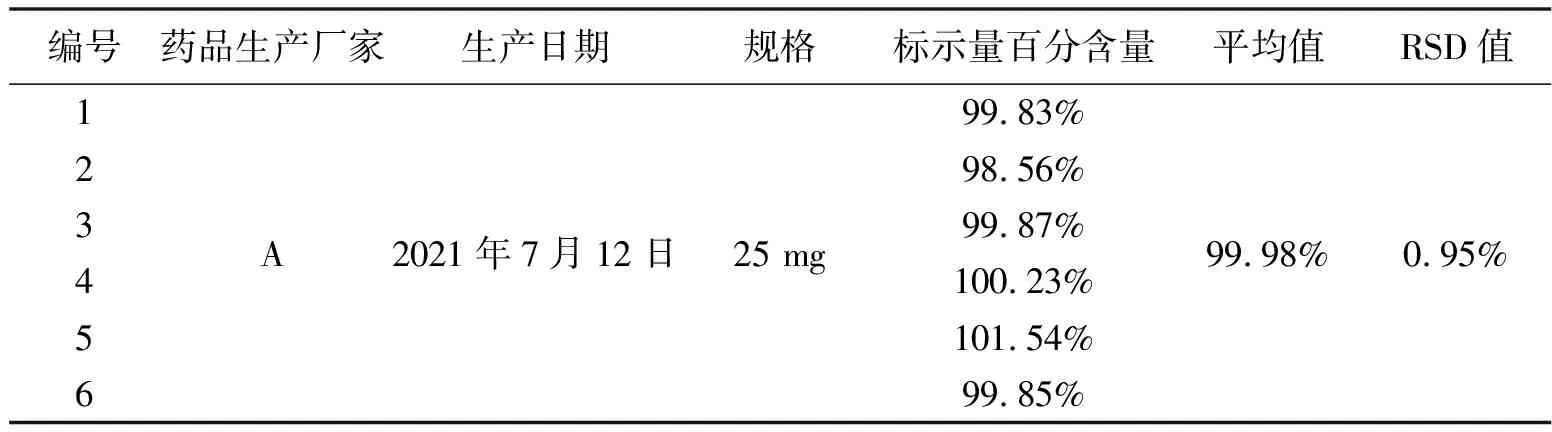
表2 阿司匹林肠溶片重复性试验表
实验结果表明,按标准曲线法测定的6个供试品中,以阿司匹林肠溶片标示量百分含量结果显示,6次测定结果标示量百分含量的平均值为为99.98%,RSD值为0.95%,且理论踏板数均大于5000,符合《中国药典》2020年版理论塔板数不低于3000的要求。
2.5 最低检出限及稳定性实验
精密量取乙酰水杨酸对照品0.1000 g,以50%乙醇溶液超声溶解30 min后,转移至100 mL容量瓶中,加水稀释到刻度作为对照品储备液,再精密量取1 mL至 100 mL容量瓶中,加水稀释至刻度作为对照品(浓度为20 μg/mL),取1 mL至50 mL容量瓶中,加水稀释至刻度,取10 μL注入高效液相色谱仪,得到最低检出浓度为0.2 μg/mL,将上述样品放置过夜后再次测定,测定结果没有明显变化,最低检出限及稳定性实验结果表明,上述实验方法能满足阿司匹林肠溶片含量测定的最低检出浓度及稳定性实验要求。
2.6 阿司匹林肠溶片含量测定
参照《中国药典》2020年版对阿司匹林肠溶片含量测定的规定,本文采用高效液相色谱法测定,以DiamonsiL C18(4.6 mm×250 mm,5 μm)为色谱柱;以0.1%磷酸水溶液-乙腈(1∶1)作为流动相;流动相流速为1mL·min-1,柱温控制在30 ℃,在276 nm波长处测定。
标准曲线:精密量取乙酰水杨酸对照品0.1000 g,以50%乙醇溶液超声溶解30 min后,转移至100 mL容量瓶中,加水稀释到刻度作为对照品贮备液,按照标准曲线法,分别精密量取上述对照品贮备液0.00 mL、1.00 mL、2.00 mL、3.00 mL、4.00 mL、5.00 mL于6支经过校对合格后的100 mL的容量瓶中,加纯净水稀释至刻度,分别取10μL注入液相色谱仪中,记录色谱图,按照标准曲线法绘制标准曲线。
供试品:取阿司匹林肠溶片10片,精密称定,研细,将精密称取适量(约相当于乙酰水杨酸100 mg)置100 mL量瓶中,加水适量,振摇使其溶解并稀释至刻度,摇匀,滤过,取续滤液作为供试品溶液,同法测定,记录色谱图,以峰面积计算,即得。结果见图一、表二:

图2 部分阿司匹林肠溶片对照品及供试品色谱图
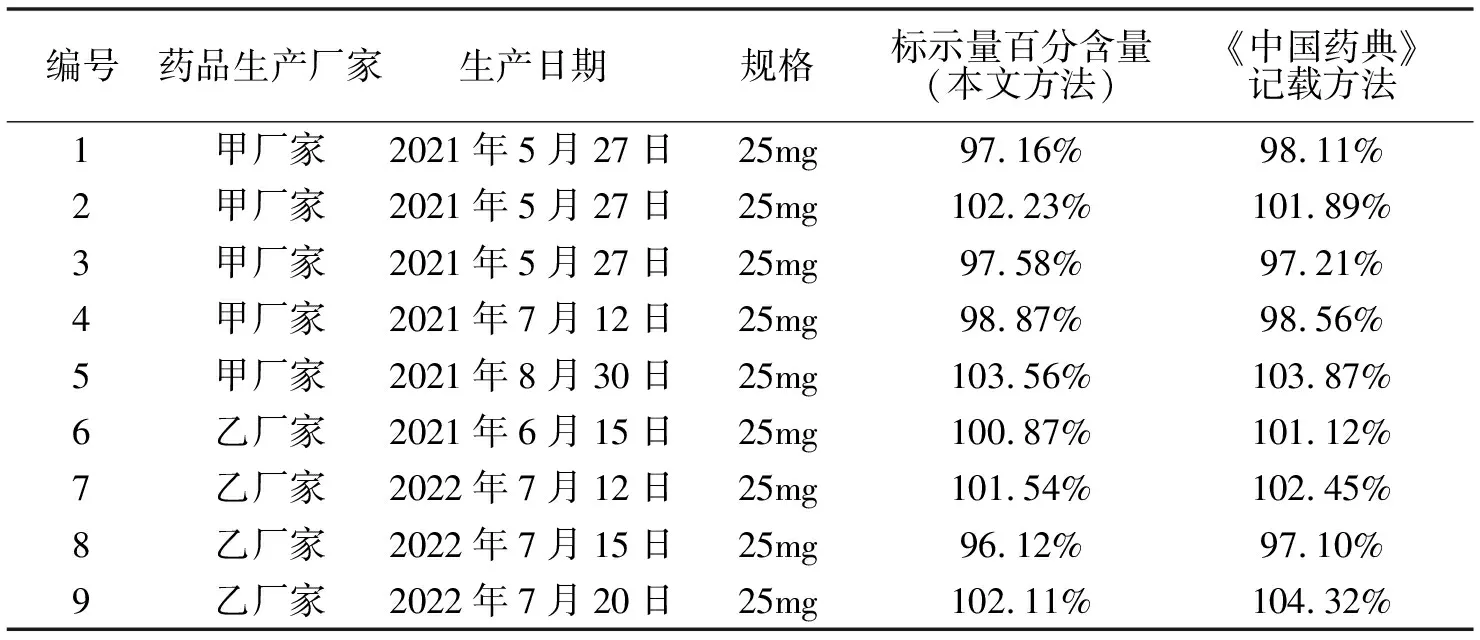
表2 阿司匹林肠溶片含量测定
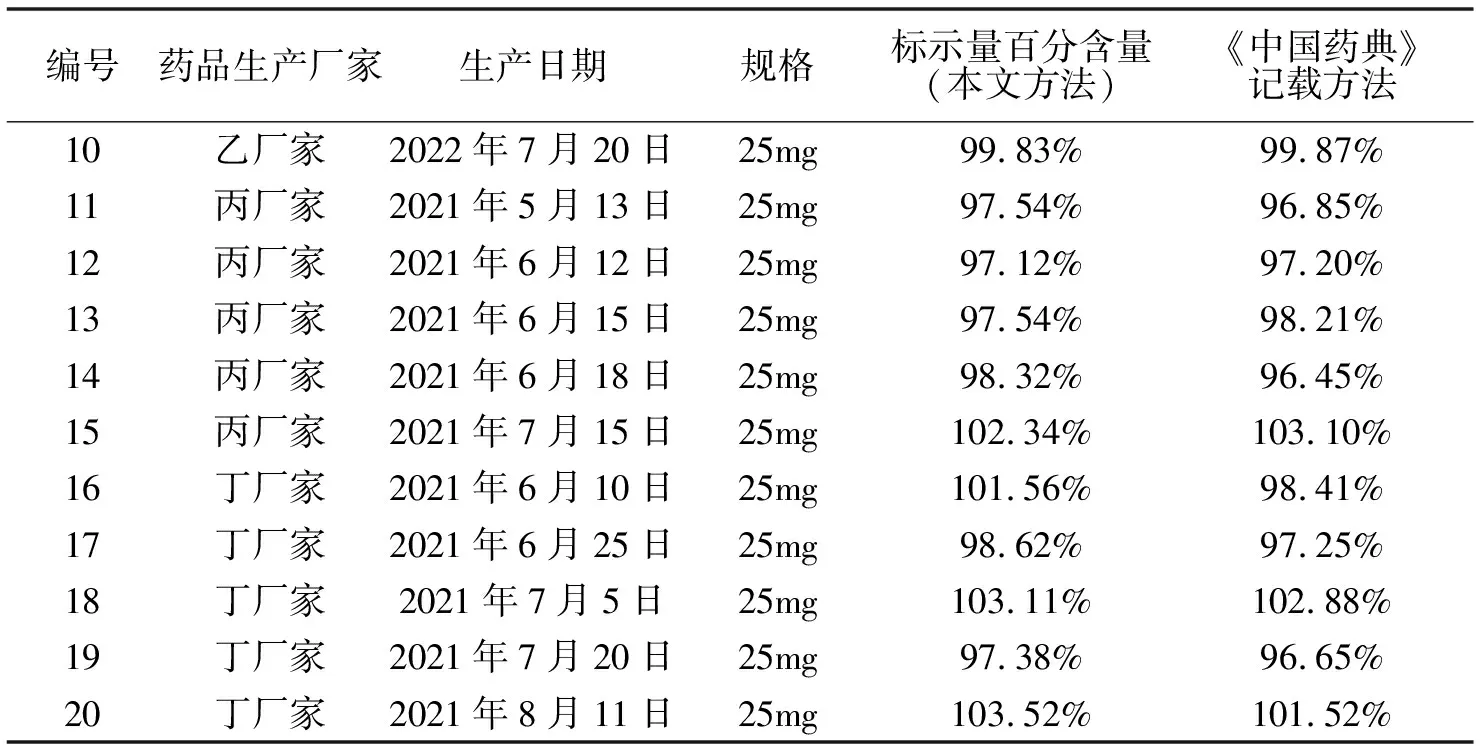
续表2 阿司匹林肠溶片含量测定
本次实验以四家药厂共20个批次的阿司匹林肠溶片为实验对象,从含量测定结果可以看出,以0.1%磷酸溶液-乙腈(1∶1)为流动相测定阿司匹林肠溶片中乙酰水杨酸的含量,以本文所述方法测定,其结果标示量百分含量平均值为99.85%,RSD值为1.02%,按照《中国药典》2020年版规定的方法测定,实验结果标示量百分含量平均值为99.65%,RSD值为1.00%。
3 讨论
3.1 检测波长的选择
参考《中国药典》2020年版记载的阿司匹林肠溶片含量测定的方法,在不改变其他色谱条件的情况下、将药典记载的流动相改为0.1%磷酸溶液-乙腈(1∶1)。实验表明:采用上述流动相测定阿司匹林肠溶片中乙酰水杨酸含量,乙酰水杨酸与基线、溶剂、杂质的色谱峰分离度良好,能满足含量测定的需求;以10%的甲醇溶液作为溶剂,乙酰水杨酸的最大吸收波长为276 nm,因此,需选择276 nm作为乙酰水杨的测定波长。
3.2 溶剂的选择
阿司匹林肠溶片中的主要成分为乙酰水杨酸,乙酰水杨酸为白色结晶性粉末,无臭,微带酸味,微溶于水,易溶于乙醇、乙醚、氯仿等有机溶剂,也可溶于氢氧化钠、碳酸钠等碱性溶剂,但在碱性溶剂中,溶解的同时可能分解。
酸性条件实验:取适量含量测定项下的溶液2 mL,加入1 moL/L的盐酸溶液1 mL,放置1小时后,用适量的氢氧化钠溶液调节至中性,取10 μL注入液相色谱仪,结果显示,当前阿司匹林肠溶片中乙酰水杨酸的含量有所减少,但总体变化不大。
碱性条件实验:取适量含量测定项下的溶液2 mL,加入1 moL/L的氢氧化钠溶液1 mL,放置1小时后,用适量的盐酸溶液调节至中性,取10 μL注入液相色谱仪,结果显示,当前阿司匹林肠溶片中乙酰水杨酸的含量明显减少;同时,通过紫外分光光度法测定,游离水杨酸含量明显增加。
综合分析,从以上试验可见,本品在酸性条件下较稳定,在碱性条件下极不稳定,易分解,同时产生大量的游离水杨酸,综合考虑,乙酰水杨酸易溶于乙醇,乙醇的中性或极弱酸性不会导致乙酰水杨酸的分解。考虑到溶剂可能会对色谱分析结果的影响,本文采用50%的乙醇溶液作为溶剂。
4 结论
上述实验在将《中国药典》2020年版记载的阿司匹林肠溶片含量测定方法中,原有溶剂1%的冰醋酸-甲醇溶液改为50%的乙醇溶液、流动相乙腈-四氢呋喃-冰醋酸-水(20∶5∶5∶70)改为0.1%磷酸溶液-乙腈(1∶1),经过色谱系统回收实验、重复性实验、最低检出限实验、稳定性实验及标准曲线实验证实,本文所述高效液相色谱药品含量测定方法,符合药品含量测定的需求,
本文用标示百分含量法和《中国药典》2020版记载的阿司匹林肠溶片含量测定法对阿司匹林肠溶片乙酰水杨酸的含量进行测定并比较测定结果,主要选择了四个药品生产厂家的20批次的样品,分别采用国家药品标准WS-10001-(HD-0614)-2002及《中国药典》2020年版二部阿司匹林肠溶片含量测定的方法,以及本文所述方法,对阿司匹林肠溶片的含量进行了测定,测定结果见表二。通过两种方法测量结果的比较可得出,采用本文所述的方法,能够对阿司匹林肠溶片乙酰水杨酸的含量进行准确的定量分析,从表二标示量百分含量的结果可也看出,本文所述方法与《中国药典》2020年版二部所记载的方法对阿司匹林肠溶片含量测定的结果,大部分比较接近,但有两批样品,通过两种方法测定所得标示量百分含量绝对误差较大,这可能是在实验过程中,由样品的前处理过程及实验本身存在的偶然误差所致。综合分析,本文采用的方法,总体能满足阿司匹林肠溶片含量测定的需求。

