基于丝素蛋白材料构建骨组织修复支架的三维多孔结构体系的研究进展
邵云菲,王卉,朱怡然,王树春,姜雨淋,胡建臣,王晶,张克勤
(1苏州大学纺织与服装工程学院,现代丝绸国家工程实验室(苏州),纺织行业丝绸功能材料与技术重点实验室,江苏苏州 215123;2西安交通大学机械工程学院,陕西 西安 710049)
骨骼是一种保护内部器官、提供身体支撑的特殊组织,尽管其具有一定的自我修复与再生能力,但因先天性缺陷、退行性疾病、创伤性损伤或手术切除肿瘤等原因造成的严重骨缺损并不能自行愈合,如果要实现其功能恢复和完全愈合,仍然需要临床干预[1-2]。在临床上,目前治疗严重骨缺损的标准治疗方法通常是使用生物惰性金属装置进行骨固定,或自体骨移植和异体骨移植。然而,金属骨固定装置往往需要后续手术切除,而自体骨移植来源有限且会导致与供体部位愈合相关的额外发病,异体骨移植还会存在疾病传播和产生免疫排斥的风险等,这些与骨移植相关的风险在老年人中尤其严重[3-4]。近年来,骨组织工程技术的发展为促进骨缺损部位修复再生提供了一条新的研究策略,而组织工程支架材料在骨组织工程研究中发挥着十分重要的作用,在骨组织再生过程中模拟细胞外基质,为细胞提供合适的生长环境和机械支撑[5-7]。
骨组织工程支架材料临床需求是巨大的,而成功的骨组织工程材料设计需要理解骨骼的组成和结构,适当选择具有良好生物相容性的生物材料,并通过灵活多变的制造技术在多尺度上控制骨修复材料的结构形式。多层级的多孔结构是骨组织系统的特征,也是骨组织系统实现其功能的基础。向自然学习,模仿此种结构的材料设计与合成已成为制备高性能骨组织修复材料的一种有效策略[8-10]。骨修复材料的多孔结构可促进新血管和血管周围神经纤维的浸润,以及细胞在整个结构中的生长。虽然这些多孔结构降低了支架的整体力学性能,但细胞、神经和血管进入支架内并继续驻留,对于使骨缺损部位再生和功能的恢复十分必要。而在骨组织工程原材料的选择上由多种因素决定,包括天然组织成分的启发,预期的制造和实现方法[11]。目前,对于可作为骨组织工程应用的最常见的候选材料主要包括金属材料、生物陶瓷材料和聚合物材料。金属材料具有较高的力学性能,常用于修补承重的骨组织部位,但大多数不可降解,并且会面临腐蚀产物释放引起不良的生物反应。生物陶瓷材料特别是磷酸钙生物材料因其与天然骨中的无机成分相似,成为目前的研究热点,但其脆性大、抗疲劳强度低。聚合物材料中包含人工合成聚合物和天然聚合物:合成聚合物提供了更多的化学修饰和分子改变的可能性,但通常缺乏特定的生物功能性;而天然聚合物通常具有良好的生物相容性、生物降解性等特点,受到了越来越多的关注[12-14]。其中丝素蛋白(silk fibroin,SF)作为一种可工业化生产的天然聚合物材料,已被广泛用于骨组织工程领域[15-16]。研究者们致力于发展多种制造技术将SF材料重建为三维(3D)多孔支架材料,如常见的冷冻干燥法和粒子沥滤法。近年来新兴发展起来的3D打印技术对支架微观结构具备优越的可控性,这为制造具有复杂的几何和表面特征的类骨结构材料提供了新的机会[17-18]。值得注意的是,制备技术对支架材料多孔结构的控制,可以进而影响支架材料的降解性质、机械以及生物性能[19]。
本文首先概述了自然骨组织的结构特征;其次,总结了SF材料重要的基本特性;随后,介绍了SF基多孔骨组织支架的典型制备技术冷冻干燥法和粒子沥滤法,以及新兴的3D打印技术和复合制造系统,并探讨了各种制造技术对SF支架多孔结构的可控性;最后,讨论了在构建具有仿生多层级多孔结构特征的骨组织再生材料中所面临的挑战,并对该领域的发展趋势进行了展望。
1 自然骨组织的结构特征
骨组织的多层次结构及其在胚胎发育和骨修复过程中的自然形成过程为骨组织工程材料的设计和制造提供了灵感[20-21]。骨是一种由矿物质和骨组织构成的活性组织。骨骼由典型的细胞类型组成(包括骨原细胞、成骨细胞、骨细胞以及破骨细胞等)[21],并被细胞外基质(ECM)包围。尽管骨组织的性质随所处部位不同而有所差异,并且各种组成物质的比例也随骨骼的不同部位有一定的变化,但一般而言,骨组织中含有约60%~70%的以羟基磷灰石(HA)为主的无机矿物,约10%~20%的以胶原蛋白为主的有机物质,剩余包含一些多糖、蛋白质、水和钾、钠、镁元素等[22]。从结构上看人体骨组织具有从宏观大尺寸到纳米小尺寸的多级复杂层级结构,其结构如图1所示[23]。在宏观结构上,骨包括骨质、骨膜和骨髓等部分。骨质由外层的皮质骨和内部的松质骨组成,是一种不均匀的多孔结构,其密度从外到内逐渐减小[24]。皮质骨高度致密并提供骨的主要力学性能,占骨量的80%,孔隙率低,为5%~10%,其中有哈弗斯管在纵向上承载着丰富的血管和神经,哈弗斯管中的血管通过横向通道中的血管相互连接,这些通道被称为沃尔克曼管[25]。而松质骨是由相互连接的骨小梁排列而成,厚度约为200 μm,松质骨仅占人体骨骼重量的20%,但其孔隙率却达到50%~90%,比表面积几乎是皮质骨的20倍[26-28]。在微观结构上,胶原分子有序排列形成直径约80~120 nm的胶原纤维,其上有特定的结合点用作骨矿物晶体的成核位点,在这些位点上骨磷灰石晶体定向生长,通常以板状或针状形式出现[2,20]。骨组织所具有的特殊的组分和层级多孔结构使其在减轻重量的同时也能够保持坚硬,并且在人体中承担着重要的生物功能[29]。
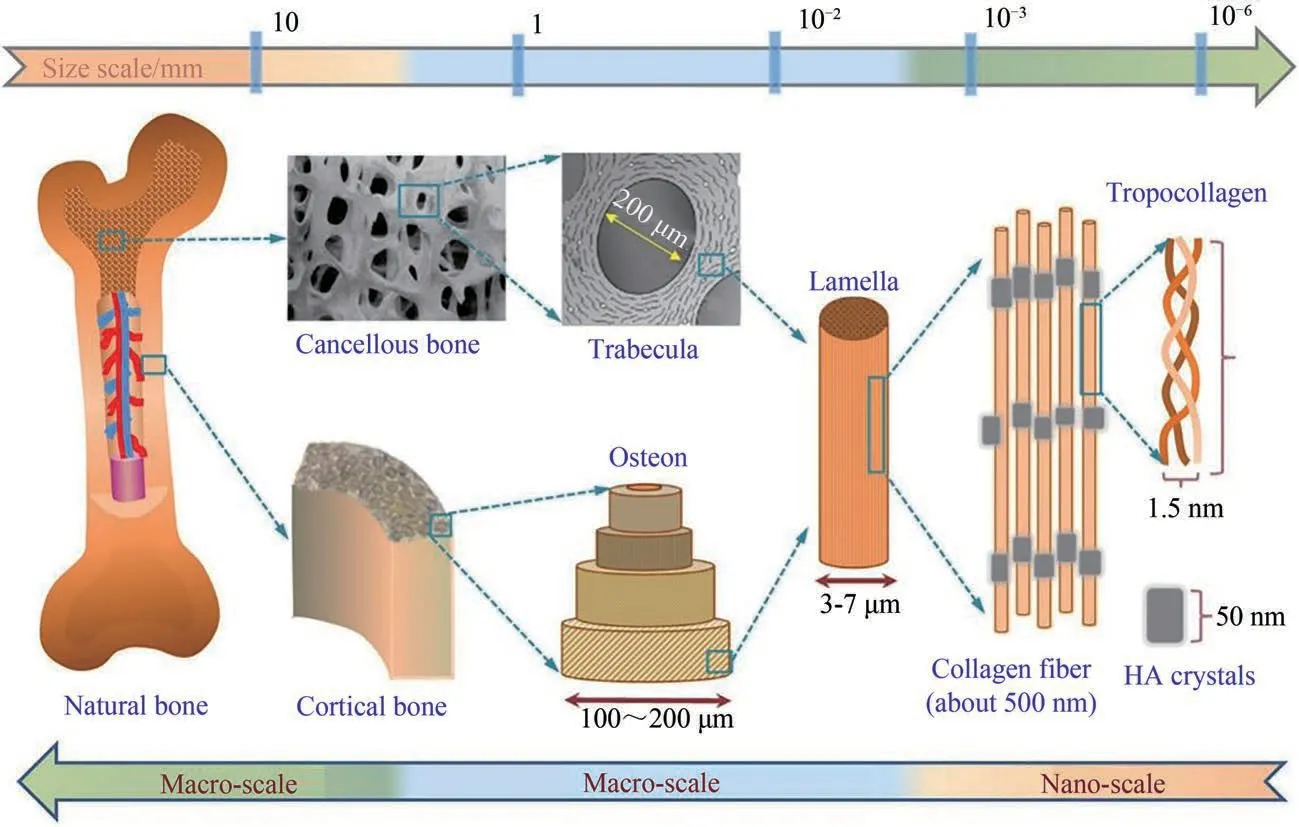
图1 天然骨组织的多尺度结构[23]Fig.1 Schematic diagrams for the multi-scale structure of native bone tissue[23]
对于目标骨组织生物学和结构的深入理解是设计和制造理想骨组织修复材料的前提条件,骨组织缺损的修复会受到缺陷部位相关因素和患者相关因素的影响[30]。如果骨缺损修复发生在承重部位时,如脊柱和长骨,需要新骨尽快生长,以固定修补缺损部位而减轻病人的疼痛,同时还需表现出一定的承重能力。此时,修复支架材料的多孔结构是影响新骨长入形成稳定骨整合的重要因素,同时高孔隙率和高机械强度这两个相互冲突的要求也需要考虑合并在一个材料体系中。因此,设计调控支架的孔径、孔隙率、孔分布等结构特征,以实现在多尺度上对材料性能的卓越控制,是骨组织工程的一个研究重点和难点[25]。相比之下,在颅骨缺陷修复中一般不承重,但是颅面骨缺损通常形状复杂,骨修复过程不仅必须起到完全填补缺陷空间的作用,还会影响患者面部外观,从而影响病人的日常和职业生活。因此在制造方法的选择上,也需要考虑是否能够精确控制材料的结构特征。
2 SF的结构与基本性能
2.1 SF的结构
天然丝纤维是一种由节肢动物(蚕、蜘蛛等)分泌纺成的高分子有机物。家蚕易于养殖,可被用做批量化生产蚕丝纤维。蚕丝主要由两根SF纤维及其外包裹的丝胶蛋白组成(图2),其他包括少量的色素、蜡和矿物质[31]。当丝胶与SF结合时,会引起人体的免疫炎症反应,因此,在将SF应用于骨组织支架制备时,需要先去除丝胶[6]。SF富含18种氨基酸,一级结构包括由二硫键连接的疏水重链(391.6 kDa)和亲水轻链(27.7 kDa),以及以非共价键连接的P25蛋白[16,32],二级结构主要包含无规卷曲、α-螺旋、β-转角和β-折叠。SF基本结构主要由非结晶区和结晶区组成,结晶区主要包括silkⅠ和silkⅡ。其中,silkⅠ是存在于蚕腺中的亚稳态液体,由α-螺旋和无规卷曲堆叠而成,silkⅡ具有反向平行的β-折叠结构,更加稳定,使SF在大部分情况下不溶,并且具有优异的机械强度[33]。

图2 SF的分层结构和化学结构[31]Fig.2 Schematic illustration of hierarchical and chemical structure of SF[31]
2.2 SF的基本性能
生物相容性是骨组织工程应用材料的关键先决条件,由于SF独特的化学组成和结构,使其展现出优异的生物相容性。早在公元150年,SF就已作为缝合材料应用于生物医学领域[34]。近年来,SF材料因其良好的生物相容性、可调的生物降解性、非免疫原性,以及丰富的原料供应,在组织工程领域越来越受到人们的关注,SF也在1993年被美国食品药品管理局(FDA)认证为一种可用于临床的生物材料[35]。特别的是,SF材料易于加工,通过常规的溶解方案可获得再生SF的水溶液,此时的SF在热力学上是不稳定的,以一种亚稳定状态形式存在。这种非晶结构的SF可通过物理和化学方法进行调控,从而促使SF中的β-折叠结构含量增加,使其逐渐转变为热力学上稳定的silkⅡ结构[36-37]。而这种结构上的可调控性和快速转变能力,使得SF材料作为组织工程材料应用时,可根据实际需要对材料的呈现形态、力学性能、生物降解性能等进行灵活的调控。Sartika等[38]制备了纯SF支架及接种人脂肪间充质干细胞(hASCs)的SF支架,并进行了生物相容性、体外成骨分化及大鼠颅骨缺损修复的评估,研究结果证明了SF具有优异的生物相容性并可以显著促进hASCs的成骨分化,同时实现有效的骨再生。另一方面,SF不仅本身对组织机体没有毒性,同时它的降解产物也不会引起不良反应[39-40]。对于骨组织工程支架,其降解速率应当匹配骨再生的速率,SF受控的降解性展现出重要的优势[41]。有研究表明,水衍生SF支架可以在1年内完全降解[42]。此外,骨组织工程支架要求一定的机械强度,在植入时可以为缺损部位和新生组织提供机械支撑和稳定性。SF纤维具有优异的力学性能,脱胶的SF具有10~17 GPa的拉伸弹性模量、300~740 MPa的拉伸强度以及4%~26%的断裂应变。然而,溶解过程常常会导致SF分子间氢键的断裂,使SF支架无法达到天然蚕丝的强度。但已有研究表明,可以通过调节SF溶液浓度和蛋白质晶体结构,以及调控多孔结构特征,或引导HA与其复合的手段,增强SF支架的力学性能[43-45]。SF因其优良的生物相容性、可调控的生物降解性、易加工性以及来源丰富等优点,使其在组织工程领域受到越来越多的关注[46-47]。特别是,已有研究表明SF可以诱导HA纳米晶体的成核,并优先沿着HA晶体的(002)晶面择优生长,预示着SF可能在羟基磷灰石(HA)纳米晶体的矿化过程中起到重要的作用。因此,SF通常与HA结合形成支架用于骨组织工程,为骨组织修复提供相关的成骨环境,诱导新骨的生成[8,48-49]。
3 SF基3D骨组织修复支架的制备技术及其对多孔结构的调控
在组织工程材料设计中,材料的制备技术是一个必须考虑的关键问题,制备技术可以决定生物材料的形态结构、降解性质、力学性能以及生物性能。根据组织工程材料预期的应用场景,材料可以被制造成微/纳米颗粒、纤维、涂层、薄膜和3D结构等多种形式[50]。在骨组织工程中受到广泛关注的SF基3D多孔支架可以通过传统的冷冻干燥法、粒子沥滤法来制备,也可以通过新兴发展起来的3D打印技术进行制备,还可以结合多种制造技术以实现在多种长度尺度上对组织工程材料结构的精确控制[51]。
3.1 冷冻干燥法
冷冻干燥法是一种制备3D多孔支架的常用方法,使用该方法制备SF基多孔支架时,首先将SF材料溶解形成均相溶液,然后通过冷冻使SF溶液发生相分离,形成SF富集相和溶剂富集相,再在高度真空的环境下,通过冰晶升华的原理冷冻干燥去除冻结了的浆料中的溶剂,冰晶原来占据的空间即形成多孔的结构[52-53]。该方法分为溶液配制、低温冷冻和真空干燥3个步骤。通过改变SF的浓度、二级结构、混合溶液成分、相分离时降温速度和温度等可以控制冰晶生长行为(包括生长速度和方向等),从而有效控制最终支架的多孔结构。例如通过控制冷冻温度可有效调控多孔结构的孔径变化,而通过控制冷冻的方向,可控制3D多孔支架呈现随机(各向同性)、线性(各向异性)等不同的网络结构[45,54]。在使用冷冻干燥法制备SF多孔支架时,可在冷冻前的SF溶液中灵活地添加其他功能材料,如纳米钙磷盐(CaP)陶瓷材料或其他聚合物材料,以获得性能更加优异的SF基复合多孔支架[55-56]。该方法制备过程简单,不需要复杂加工手段,也不使用有毒物质,是一种对环境友好的绿色制备方法。然而,由于冰晶的生长具有随机性,因此该方法对多孔结构的控制也是有限的,获得的多孔结构通常是随机分布的,对孔的形状、尺寸、孔隙率和连通性等参数无法进行精确控制。
Mandal等[57]通过冷冻干燥法制备SF多孔支架,研究了SF溶液浓度和冷冻温度对支架多孔结构的影响。研究结果表明,随着SF浓度的增加,支架孔径和孔隙率都会随之减小。而随着冷冻温度的降低,支架孔径减小而孔隙率增加,最高孔隙率可达到96%±4.1%。SF的浓度和冷冻温度会影响冰晶生长行为,实现对多孔结构的控制,从而进一步影响细胞的生长行为。结果显示较大的孔径、较高的孔隙率和良好的内部连通性可促进细胞的增殖,以及向支架内部的长入。Wang等[58]通过引入钙离子(Ca2+)调控蛋白质相分离过程,从而调控冰晶的生长和分布,最终获得具有多级多孔结构的SF支架(Ca/SFS),如图3所示。研究结果表明,与传统冷冻干燥获得的单一多孔结构支架(SFS)相比,Ca/SFS支架中大孔孔壁上微小孔隙的存在可有效促进人骨髓基质干细胞的黏附、增殖和成骨分化。Bicho等[59]通过设置3种不同的冷冻方式,从而对3D支架的多孔结构进行控制。将SF与掺杂的β-磷酸三钙(β-TCP)混合均匀后,第1种采用直接冷冻方式,冰晶随机生长,最终获得各向同性(随机)的多孔结构;第2种采用底部冷冻方式,诱导冰晶垂直生长,最终获得线性的多孔结构;第3种采用上下绝热横向冷冻的方式,控制冰晶径向生长,最终获得径向的多孔结构。同时,研究结果还表明,通过对多孔结构的控制可有效影响最终3D支架材料的力学性能。

图3 Ca2+诱导多级多孔结构Ca/SFS支架形成过程[58](Ca/SFS支架的SEM照片及其表面生长细胞的增殖和成骨分化情况)Fig.3 Schematic diagram of the formation process of Ca2+induced multi-level porous structure Ca/SFS scaffolds,SEM micrographs of Ca/SFS scaffolds and proliferation and osteogenic differentiation of growing cells on surface[58]
3.2 粒子沥滤法
粒子沥滤法是一种广泛应用于骨组织工程多孔支架的制备方法,在制备SF基多孔支架时,通常先将SF溶液与一定直径范围的致孔颗粒均匀混合、固化,再利用致孔剂与SF不同的溶解性,浸泡去除致孔剂颗粒,在致孔剂原来的位置则形成孔隙,从而产生SF多孔支架[60-61]。常用的致孔剂有盐颗粒、石蜡颗粒和糖颗粒等,致孔剂的大小、形状和相对位置可以决定多孔支架中的孔径、孔隙率、有序性、连通性等结构特征。粒子沥滤法操作相对简单,但是由于SF溶液填充致孔剂模板空隙时容易填充不完整,并且致孔剂去除过程易残留,从而影响支架多孔结构的完整性和再现性[62-63]。
Correia等[54]使用水和六氟异丙醇(HFIP)作溶剂分别制备SF的溶液作为原料,然后采用不同粒径的氯化钠(NaCl)颗粒作为致孔剂制备了具有不同多孔结构的SF支架。由于致孔剂尺寸所引起的结构控制,以及致孔剂NaCl颗粒在溶剂中的溶解性对多孔结构的影响,研究者可以对SF支架的孔径、孔隙率和孔隙的几何形状进行一定的控制。而力学性能研究结果表明,HFIP衍生的SF支架比水性的SF支架具有更高的力学强度。通过人类脂肪来源干细胞对多孔结构的响应结果可以看出,通过支架多孔结构的控制可以影响细胞的生长行为,研究结果表明孔径为400~600 μm的多孔HFIP衍生的SF支架(HFIP-400)显示出最佳的骨组织形成结果。该研究强调了粒子沥滤法对支架多孔结构的控制作用以及多孔结构调控对骨组织工程支架设计的重要性。Zeng等[64]使用不溶解于水的石蜡微球作为致孔剂,得到了与石蜡直径一致的多孔SF支架,并且孔隙率高达92.38%±5.12%。通过细胞实验证明该支架有利于髓核细胞的生长、浸润和ECM分泌,具有良好的生物相容性。Park等[65]通过粒子沥滤法制备SF/HA复合支架,研究了不同种类的致孔剂(盐和蔗糖)对支架多孔结构的影响,结果表明盐颗粒制备的支架孔径较蔗糖颗粒制备的支架孔径更大一些,但蔗糖颗粒制备的支架具有更好的孔互连性,这为细胞的迁移和增殖提供了充分的机会。实验结果表明使用蔗糖颗粒制备的SF/HA复合支架可促进骨钙沉积并能有效促进大鼠颅骨缺损处新骨的再生。
传统的冷冻干燥法和粒子沥滤法通常依赖于随机过程,这些过程通常会导致支架在尺寸、结构和连通性方面形成不受控制的孔隙结构,从而极大限制了其在组织再生中的使用[66-67]。相比之下,基于紧密堆积的单分散微球晶格组成的模板所制造的反蛋白石支架,其孔隙结构、孔径、孔隙率和互连性都得到了前所未有的控制[68-70]。该方法主要包括微球模板制造、浆料填充和模板去除3个步骤,如图4所示。Sommer等[71]基于聚己内酯(PCL)单分散微球组装的高度有序紧密堆积晶格模板,通过SF溶液浇铸微球模板后去除微球模板,最终获得具有反蛋白石有序多孔结构的SF支架。研究结果表明,与传统非均匀多孔支架相比,由于微球的单分散性,所得反蛋白石支架具有较为规则的孔形状、均匀的孔径和孔隙、有序的空间排列以及相互连接的窗口,并且在不同批次的样品中具有较好的再现性。这种高度有序的多孔结构可有效促进人骨髓间充质干细胞(hMSC)的生长和成骨分化,在骨组织修复过程中具有积极的影响。

图4 反蛋白石法制备SF支架的示意图及支架结构、孔径分布,盐颗粒(黑色柱)和反蛋白石(灰色柱)支架培养6周后测量的钙含量[68,71]Fig.4 Schematic diagram of SF scaffold prepared by inverse opal method,scaffold structure and pore size distribution,calcium content measured after 6 weeks in culture for salt-leached(black columns)and inverse opal(gray columns)scaffolds[68,71]
3.3 生物3D打印法
如上所述,冷冻干燥法和粒子沥滤法这些传统技术仍广泛应用于多孔材料的制备上,但这些技术有众所周知的局限性,如较差的可扩展性和可控性,在对多层级多孔结构特征的精确控制上十分困难。近年来发展起来的3D打印技术是一种新型的快速成型制造技术,可通过计算机辅助技术精确快速地制造任意复杂形状的3D结构体[72-74]。3D打印技术的独特优势使其可实现在体外构建具有特殊复杂3D仿生结构的组织工程支架材料。3D打印技术可有效定义3D支架材料的孔径、孔隙率、孔隙的空间排列、连通性等结构特征,这使得使用3D打印技术制备的支架相比于使用其他制造方法制备的支架具有更好的孔隙互连性和更高的机械强度,这些材料在骨组织工程中具有令人兴奋的临床应用潜力。同时,3D打印技术对多孔结构的精确控制,可使系统变化的生物材料结构成为一种有价值的初始筛选工具,可以确定最合适的孔径范围/形态,从而对组织相关结果进行更详细的研究。用于SF基骨组织工程多孔材料的3D打印技术的主要形式有挤出式3D打印和光固化3D打印[75-77]。
在挤出式3D打印中,材料通过气动压力或机械柱塞通过喷嘴挤压,形成细丝,并按照每一层指定的不同模式沉积生物墨水,从而实现结构的精确成型[图5(a)][78]。该技术的优点是能够输送的细胞和材料选择性范围较广,但是打印分辨率较低,通常需要打印墨水材料具有剪切变稀的流变性能,并且经过挤压后材料可固化成形,以保证打印结构体的完整性。挤出式3D打印技术的一个局限是无法使用柔软或低黏度的材料制造结构,这些材料在挤压后通常不能保持其形状。而单纯的SF材料体系一般具有较低的浓度和黏度,因此需要通过各种物理化学手段改善和优化其流变性能[81-82]。目前通常将SF与其他高黏度生物材料复合以获得具有良好流变性能的SF基生物墨水,实现SF的挤出式3D打印制造[83-84]。Zheng等[79]将SF与聚乙二醇(PEG)复合获得可用于挤出式3D打印的生物墨水,PEG与SF混合会诱导SF的β-折叠结构形成,从而通过此物理交联产生凝胶化和水不溶性。通过控制3D打印参数,可获得一系列具有高分辨率、高形状保真度和均匀凝胶基质的多孔结构,如图5(a)所示。当hMSC细胞在3D打印前与SF溶液预混合可实现细胞负载构建体的共同打印,细胞在所打印3D结构体中可存活至少12周,表现出优异的生物相容性。研究结果表明,SF/PEG生物墨水凝胶可借助3D打印技术设计和构建3D多孔结构,为细胞生长和生物功能的实现提供合适的支架环境。
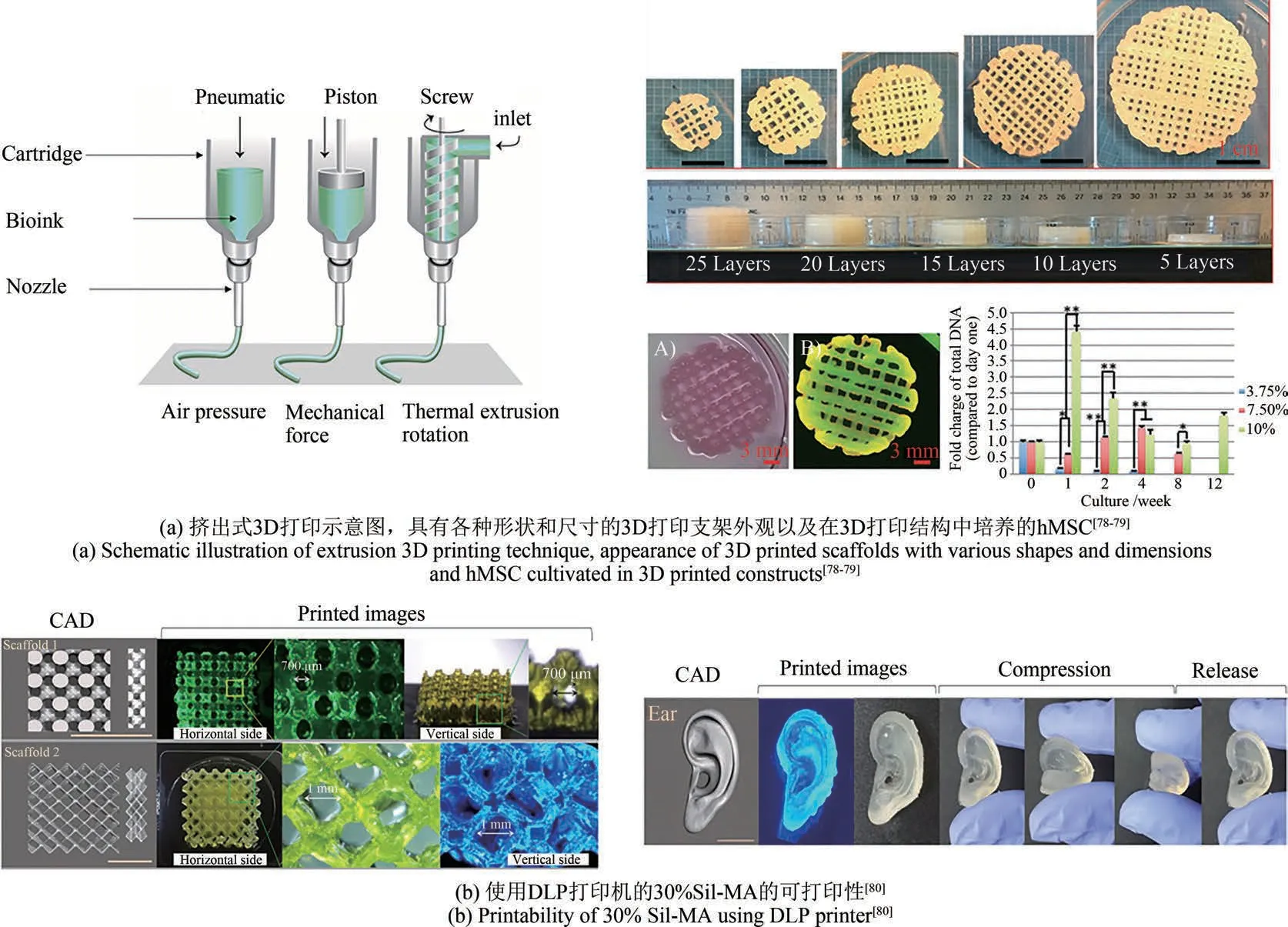
图5 基于3D打印法可控构建SF支架的3D多孔结构Fig.5 Controllable construction of 3D porous structures of SF scaffolds based on 3D print
光固化3D打印技术是一种通过光激发、分层固化的3D打印技术,采用透明、低黏度的液态光敏聚合物,通过投射到材料上的光模式选择性地在特定位置上进行逐层固化[85-86]。与挤出式3D打印技术相比,光固化3D打印技术提供了更高的分辨率,可实现复杂结构精细控制打印。Kim等[80]在SF溶液的制造过程中使用甲基丙烯酸缩水甘油酯(GMA)制备了基于SF的生物墨水(Sil-MA),并用于光固化3D生物打印。为了证明Sil-MA优异的可打印性,模拟了各种复杂的类组织结构,打印了具有高度互连多孔的网状支架,证明其在组织工程领域的应用前景[图5(b)]。此外,Sil-MA墨水具有良好的力学性能,打印的具有螺旋褶皱的耳廓结构体具有良好的机械弹性。将小鼠胚胎成纤维细胞与墨水混合后打印,打印后培养14 d,封装在Sil-MA水凝胶内的细胞表现出良好的细胞活力,证明其具有良好的生物相容性。
3.4 复合制造技术
骨组织的形成是在多尺度下进行的,而最终形成的骨组织的功能和特性很大程度上归功于其层次结构。在不同长度尺度上对生物材料结构特征的高度控制通常不能通过单一的制造方法实现。因此,骨组织工程系统的设计者需要开发新的制造策略,结合多种合成和制造技术,从而实现对骨组织工程材料多层级结构的精确控制[87-90]。
Yan等[91]通过粒子沥滤和冷冻干燥相结合的方法,构建了更符合天然骨特性的多级多孔结构的SF/CaP复合支架。实验结果证明粒子沥滤法中的NaCl颗粒产生了约为500 µm的相互连接的大孔,而冷冻干燥过程构筑了存在于大孔小梁中的20~100 µm之间的微孔,细胞毒性评估结果表明该支架无细胞毒性。李东等[92]通过低温3D打印联合冷冻干燥技术制备了胶原蛋白/SF/HA复合支架,支架显示出大孔(502.78 μm±21.47 μm)/微孔(62.48 μm±22.07 μm)共存的3D多孔径立体结构,细胞培养实验结果表明支架细胞相容性良好,可以有效促进前成骨细胞MC3T3-E1的增殖和分化。Sommer等[93]为了构建与天然骨结构类似的层次结构SF支架,通过结合3D打印法和粒子沥滤法,控制制备了宏观-介观-纳米三层分级结构的SF支架,如图6所示。具体来说,先将牺牲有机微粒(乳胶纳米颗粒包覆的PCL或蜡颗粒)添加到SF和魔芋胶水复合凝胶中,然后将复合凝胶通过3D打印构建宏观支架结构,再去除纳米和微米微球模板从而形成多级多孔结构。该支架多层级多孔结构特征可由3D打印的间距以及牺牲颗粒的大小和特征精确控制,这种模板组装与3D打印相结合的加工技术大大增强了在多个尺度上对SF支架结构特征的调控能力,获得具有毫米-微米-纳米多层级多孔结构的支架,其在骨组织工程支架领域具有广泛的应用前景。Karamat-Ullah等[94]通过溶胶-凝胶和自组装的协同组合开发了一种含硅(Si)的SF凝胶墨水,之后使用3D打印和冷冻干燥联合方法制备了层次化的孔隙结构,即3D打印形成的宏观孔隙(500 μm~1 mm)、冷冻干燥形成的微孔隙(18~20 μm)以及溶胶-凝胶和自组装形成的介孔(20 nm)。此外,通过打印前和打印后将巯基端抗菌肽和细胞黏附肽序列(SH-CM-RGD)通过共价连接到Si-SF杂化凝胶中,实现抗菌功能。结果表明该3D支架具有良好的力学性能、抗菌活性,具有低细胞毒性,并且能够促进成骨细胞的生长和增殖。

图6 基于复合制造技术可控构建SF支架的3D多孔结构[93]Fig.6 Controllable construction of 3D porous structures of SF scaffolds based on composite manufacturing technology[93]
4 挑战与展望
SF作为一种生物相容性良好、易加工成型、力学性能优异的天然聚合物,通过不同的制造方法构建的SF基3D多孔支架在骨组织工程领域受到了极大的关注,特别是对于支架多孔结构的调控是目前的研究热点,各种制备方法对多孔结构的调控总结于表1。尽管已发展了多种制备技术用于构筑和调控SF基的多孔结构,但是目前大部分的SF基支架材料的结构与真实骨组织还存在不小的差异,仿生多级结构的精确构筑仍是难点。同时,我们发现众多研究都表明多孔结构的调控可有效影响细胞的生物学行为,而材料的多孔结构特性与其力学性能、降解性能都是相互联系的。例如,尽管在许多骨缺损修复应用中需要支架的机械稳定性,但适当的降解能力以及诱导细胞和组织加速生长的能力则需要多孔支架具有高孔隙率和内部连通性,这势必会降低材料整体的力学性能。要将这种相互冲突的要求合并到一个材料体系中,迫切需要结合多种制造技术,开发新的制备策略。例如在设计组织工程材料上需要构筑仿生的多层级梯度结构,而这些都会给材料的设计和制造带来前所未有的难度。如前所述,3D打印技术的出现和迅速发展,为制造复杂的仿生结构特征提供了前所未有的机会。特别是3D打印技术与其他制造技术的结合,为实现在多尺度上对材料结构的精确定义提供了潜在的解决方案。此外,骨组织再生是一个动态的过程,涉及细胞和周围基质之间的双向作用。生物材料的设计可以适应细胞的局部变化,并且可以根据局部生物信号的刺激改变支架材料的特性,从而促进了这种动态的相互作用。而这就要求对于多孔结构的设计不是固定不变的,需要考虑在动态响应过程中的结构变化,这对支架材料的结构设计和制造无疑会带来巨大的挑战。相信在骨组织工程技术快速发展的今天,随着对骨组织生物学和结构的理解深入,以及材料合成和加工技术的进步,势必为骨组织工程设计更加复杂的材料系统提供新的机遇。

表1 不同制备方法对SF基三维骨组织修复支架的孔结构调控Tab.1 Pore structure regulation of SF-based 3D bone tissue repair scaffolds by different preparation methods
近年来,合成生物学作为一门由基因组工程、酶工程、代谢工程和生物信息学等多种技术交叉发展形成的新兴综合学科,为创造高性能新型生物材料提供了有力的工具[95-96]。研究者们将合成生物学和材料科学的工程原理相互融合,借助基因合成和编辑技术对自然界的活体系统进行定制化的设计与改造,将工程改造的生命体作为细胞工厂,从而智能地构建功能定制的生物材料[97]。其中,首要任务则是选择适合的天然宿主,天然宿主的正确选择会直接影响合成生物技术对其最终的改造,达到事半功倍的效果。不同于当前常见的大肠杆菌这类模式生物作为材料合成的宿主,随着材料合成生物学的基因操作工具的发展,未来天然宿主的选择可以向家蚕这类非模式生物倾斜以实现高附加值材料的生产,从而为设计和改造SF材料的功能性提供了可借鉴的研究策略[97]。面对基于丝素蛋白材料构建骨组织修复支架研究中,良好的力学性能与高孔隙率和内部连通性这种相互冲突的要求,基于合成生物技术构建绿色高效的生物制造系统有望解决这一难题。例如蜘蛛丝表现出卓越非凡的力学性能,已有研究表明,蜘蛛丝巨大的韧性和弹性主要是由于扩增丝蛋白(MaSp)的存在[98]。MaSp蛋白具有高度重复的序列,无法通过使用细菌或酵母来获得,而家蚕具有生产高度重复蛋白质的能力。因此可以借用基因编辑技术操纵家蚕基因组,实现蛛丝蛋白在家蚕细胞中的表达,最终获得具有增强力学性能的SF材料[98-100]。合成生物学的发展为创建具有定制形态和功能的新型SF材料提供了可能性,对解决SF材料应用于骨组织工程领域所存在的问题和挑战具有重大而深远的意义。

