生物合成高性能蛋白及材料应用
李敬敬,马超,王帆,张洪杰,,刘凯,
(1中国科学院长春应用化学研究所,吉林 长春 130022;2清华大学化学系,北京 100084)
生物结构蛋白如丝素蛋白、弹性蛋白、胶原蛋白等是一类自然进化产生的天然高分子材料,具有良好的力学性能、生物相容性和可降解性。同时,由于其特征性的模块化序列而具备精确的结构和功能的可调控性,这是许多合成高分子材料所缺乏的特性[1-2]。此外,高性能结构蛋白的多级组装特性使得它们可以组装成更高层次的材料体系,包括纤维、胶束、纳米载体、相分离微结构、框架体系和生物活体材料等[3-7]。高性能结构蛋白材料在可穿戴织物、生物医学和军事科技领域展现出广阔的应用前景。例如,蛛丝蛋白纤维由于具有低密度、高延展性、高韧性等优势,能够吸收巨大的能量,是制造防弹装备的优异材料。基于蚕丝蛋白的纤维材料和生物支架已被FDA批准用于临床[8]。胶原蛋白具有良好的亲水性和生物相容性,已被成功应用制备人工肌腱、血管、牙科或软组织植入物等[9]。胶原水凝胶还可以用做细胞培养的三维基质,是角膜移植、神经、软骨、皮肤和其他身体器官再生的良好材料。此外,利用丝素蛋白和类弹性蛋白等的自组装结构开发新型的纳米载体系统[10-11],能够用于小分子、核酸和蛋白药物的体内递送和可控释放。超分子肽组装物可以通过共价或非共价相互作用整合到功能性化疗或光敏药物中,有利于构建用于联合免疫治疗的多功能纳米药物传递载体[12]。
随着基因工程技术和蛋白工程技术的发展,利用结构蛋白功能域模块化和嵌段共聚物策略,使得合成具有可定制性能的人工蛋白材料体系成为可能。例如,研究人员通过对天然肌联蛋白的功能模块GB1和节肢弹性蛋白的保守重复基序进行重组,成功开发了能够模拟天然肌肽分子结构的人工弹性蛋白[13]。南京大学曹毅教授等[14]通过将类弹性蛋白和光响应蛋白融合设计出一种光可切换系绳,利用光响应蛋白在单体和二聚体状态之间的切换来可逆调节类弹性蛋白链段的长度,提供了一种通过光调节机械转导进而调控细胞分化行为的方法。吉林大学刘俊秋教授课题组[15]基于SP1环状蛋白自组装开发了体外人工捕光系统,用于模拟天然光合细菌的能量传递过程。同时通过开发多样性的生物合成系统如细菌、酵母和转基因植物等[16-18],能够实现人工蛋白在异源系统的表达,这为高性能人工蛋白及其材料体系的性能优化和宏量制备奠定了基础。
尽管高性能生物结构蛋白在新材料设计中有广阔的前景,但在蛋白的高效生物合成、多尺度体外组装和理性功能设计等方面仍存在较多瓶颈问题。在生物合成方面,高性能蛋白的超高分子量以及高度重复的序列特征降低了其在人工合成系统中的稳定性。另外由于密码子偏好性差异和翻译后修饰等因素,导致天然结构蛋白与人工合成系统(尤其是广泛使用的原核微生物合成系统)的适配性较低。在高性能蛋白多尺度组装方面,目前常用的蛋白装配成型手段无法避免对蛋白结构产生破坏,难以实现蛋白折叠状态下的有序组装。在蛋白理性功能设计方面,目前对于高性能结构蛋白的氨基酸序列、折叠结构和功能特性三者之间的关系还需要深入了解。
随着多组学测序技术的发展,近年来高性能生物结构蛋白的序列库得到极大拓展,不同结构蛋白功能序列的组合拓展了蛋白材料的可编程性。此外,蛋白结构预测和分子设计工具的发展为从头创造具有独特功能特性的新型蛋白分子提供了技术基础。分子间相互作用的直接量化对于激发关键设计参数实现蛋白仿生材料优化设计具有重要意义[19]。通过对人工蛋白生物合成系统的基因工程改造,有望在人工合成系统中实现高性能蛋白的规模化批量生产,同时实现蛋白结构的定制化修饰以服务于后续的蛋白组装材料的性能。
本文对生物结构蛋白包括类弹性蛋白、丝素蛋白、贻贝足丝蛋白和肌联蛋白等作为高性能蛋白材料的构建模板在蛋白分子设计、生物合成、材料组装和应用中取得的代表性进展做出了总结,并且对具有发展潜力的新型蛋白分子和技术平台进行了介绍,为实现高性能蛋白材料高效合成和功能理性设计提供可借鉴的思路。
1 人工结构蛋白的设计与合成
结构蛋白分子是创建多尺度组装的蛋白生物材料的基本模块。通过蛋白质工程和基因编辑工具对蛋白分子进行理性设计和优化,从而提升蛋白材料的功能,已经成为高性能蛋白材料合成发展的新趋势。开发具有功能优势的蛋白分子即蛋白材料基本单元的主要方法包括:①通过转录组和蛋白质组学分析从自然界的功能序列中寻找有意义的新序列;②通过基因工程方法改造现有蛋白功能序列,包括特殊位点突变或功能基序重组等,从而达到特定的目的。此外,研究者们通过基因工程改造大肠杆菌、酵母菌和谷氨酸棒杆菌等构建蛋白表达的高效底盘细胞,以实现人工结构蛋白的高效生物合成。
1.1 结构蛋白功能序列解析
确定高性能生物结构蛋白如丝素蛋白、肌联蛋白以及一些黏附蛋白(包括贻贝蛋白、藤壶蛋白)等的氨基酸序列面临多重挑战,一方面缺少对应的生物基因组信息,另一方面天然蛋白往往较难溶解且序列重复度较高,因此增加了蛋白质测序的难度。南洋理工大学Miserez团队[20]将蛋白质组学工具与转录组数据库相结合,完成了海螺卵囊、贻贝足丝和鱿鱼环齿等结构中的多种蛋白的序列鉴定和结构功能分析,这些信息可以进一步与合成生物学技术相结合,以更好地对蛋白材料进行仿生工程生物制造。Arakawa课题组[21]对蓑衣虫Eumeta variegata的基因组序列解析发现了具有独特重复基序的丝蛋白基因,它既包括蛛丝蛋白典型的多聚丙氨酸序列[(A)n],同时含有蚕丝蛋白甘氨酸-丙氨酸交替的重复序列[(GA)n]。蓑衣虫丝的拉伸断裂强度可达2.0 GPa,韧性可达364 MJ/m3,超过已报道的绝大多数蛛丝纤维[22],进一步的研究发现上述混合基序特征与蓑衣虫丝优异的力学性能密切相关[23]。
近年来,比较基因组学分析也被用于蛋白仿生材料研究中,对多个物种基因组或功能基因区域的比较分析有助于发现新的功能基因或与蛋白性能相关的标志因素。如Arakawa团队[24]在进一步的工作中鉴定出另外2个种属的蓑衣虫丝蛋白基因,通过与Eumeta variegata的丝蛋白基因序列对比分析,揭示蓑衣虫丝蛋白基因高度重复区域具有保守的功能基序排布,同时比较分析发现Canephora pungelerii丝蛋白中(GA)n和(GAGAGS)n基序的数目显著低于其他两个属,结合Canephora pungelerii蛋白纤维明显高于其他种属的力学性能,证明功能基序的重复度以及不同功能基序间的平衡对蛋白纤维性能有着重要影响。研究者采用类似的多组学方法对4种不同的络新妇亚科(Nephilinae)蜘蛛的牵引丝蛋白成分和序列进行分析[25],除常规的蛛丝蛋白外还鉴定出一类低分子量蛋白SpiCE,拉伸测试表明含有SpiCE的复合蛛丝蛋白薄膜的拉伸强度增加了2倍,但复合蛛丝纤维却显示出断裂伸长率增加以及拉伸强度降低,根据这些力学性能的变化,研究者推测SpiCE蛋白可能与蛛丝蛋白MaSp的无定形结构域之间存在相互作用,从而影响蛛丝蛋白组装体系的力学性能,SpiCE有望成为修饰和调整蛛丝蛋白材料力学性能的有利分子工具。
1.2 结构蛋白功能模块修饰和重组
生物结构蛋白的氨基酸序列与其结构和性能密切相关,因此,通过位点特异性突变、序列插入/融合、多聚化等方式,有可能从天然功能基序中衍生出新的功能序列。非天然氨基酸对生物结构蛋白特殊功能的形成及结构组装具有重要作用。以类弹性蛋白为例,其交联组装可以通过引入外部交联剂诱导赖氨酸、半胱氨酸或酪氨酸之间形成共价键来实现,但交联剂的细胞毒性可能会限制蛋白组装体在生物医学领域的应用。耶鲁大学Isaacs等[26]通过改造大肠杆菌基因组将终止密码子“UAG”转换为编码新型非天然氨基酸的密码子,并开发了对非天然氨基酸具有高效特异性的氨酰tRNA合成酶,这项工作将基因组重构的大肠杆菌转变为新型蛋白的合成工厂,为新型蛋白分子和聚合物的生物制造奠定了基础。杜克大学Chilkoti团队[27]利用上述非天然氨基酸定点修饰技术,在蛋白编码序列中定点插入特殊密码子“UAG”,成功将具有光交联反应活性的非天然氨基酸即对叠氮苯丙氨酸(pAzF)引入到类弹性蛋白主链中,制备出具有光热响应的水凝胶纳米颗粒。非天然氨基酸位点特异性整合的准确率达到95%,可以通过调节其在主肽链的插入密度定向调控纳米颗粒的尺寸。海洋贻贝的水下黏附特性主要来源于贻贝足丝蛋白中特殊的3,4-二羟苯丙氨酸即多巴结构。Yang等[28]构建了酪氨酸Tyr营养缺陷型的大肠杆菌工程菌株,在3,4-二羟苯丙氨酸添加的基本培养基中诱导蛋白表达,通过内源性酪氨酰-tRNA合成酶(TyrRS)可以实现胞内特异性掺入非天然氨基酸。利用该策略获得的重组贻贝黏附蛋白中多巴掺入效率>90%,因此重组黏附蛋白表现出优异的表面黏附性能,水下黏附性能甚至可以媲美天然蛋白。该体内修饰合成策略的掺入效率远超体外反应,有望进一步拓展到其他翻译后修饰残基如4-羟基精氨酸和O-磷酸丝氨酸等。
利用单一或多生物来源的功能基序的重组进行高性能蛋白设计近年来也获得了长足的发展。Buehler和Kaplan教授团队[29]利用介观耗散粒子动力学(dissipative particle dynamics,DPD)模拟对重组蛛丝蛋白进行模块化设计并揭示形成蛋白组装体的关键设计参数。DPD模拟表明,蛛丝蛋白β-sheets折叠/无定形模块的比例和二者的聚合度即蛋白分子量是控制蛋白组装和性能的两个重要因素,这为在分子水平上捕获蛋白组装结构和特征从而实现蛋白分子理性设计提供了方案。在人工蛛丝蛋白纤维研究中,蛛丝蛋白核心结构域的重复单元,包括β-sheets折叠模块和无定形模块,通常是研究者的主要关注点。然而,Scheibel团队[30]在核心结构域重复单元基础上引入天然蛛丝蛋白末端结构域,探索并证实了蛛丝蛋白末端结构域尤其是羧基端结构域对蛋白分子自组装及纤维性能的重要影响。
蛋白分子的折叠结构是决定蛋白组装体内部超分子相互作用以及组装体性能的关键因素。蛋白分子的折叠结构比它们的序列和功能更加保守,将具有特定折叠结构的、不同生物功能的基序进行重组,融合蛋白或可超越天然蛋白范畴兼具多种优势。钟超等[31]设计了基于大肠杆菌生物膜主要成分(CsgA蛋白)和贻贝足丝蛋白Mfps融合的杂化蛋白分子,该杂化蛋白分子能够进行多级自组装形成超级纳米纤维结构,分子动态模拟分析表明CsgA自组装形成淀粉样蛋白纤维核心结构域,而贻贝足丝蛋白暴露在纤维表面。组装结构的水下黏合性能可以达到20.9 mJ/m2,远超单独的贻贝足丝蛋白和大肠杆菌生物膜蛋白。在进一步的工作中,该团队[32]将哺乳动物细胞DNA结合蛋白TDP43的低复杂结构域LC与贻贝黏附蛋白Mfp5融合制备重组蛋白TLC-M,TLC-M融合蛋白在低温下通过LC结构域的液-液相分离性质形成蛋白浓度很高的凝结体,该液态凝结体很容易吸附在基底表面,并且层层吸附,最后TLC-M液态凝结体能进一步脱水组装成致密的淀粉样蛋白纤维涂层,表现出很强的水下黏附性能,这为构建液-固相转变和自组装驱动的可控功能蛋白材料提供了新方向。
在本课题组前期工作中,通过不同生物来源的结构蛋白模块重组,突破了传统丝素蛋白的范畴[33],开发出具有高力学性能的重组结构蛋白[图1(a)]。基于对自然界多种具有优异力学性能的结构蛋白功能基序的筛选,本团队[34]将鱿鱼环齿蛋白SRT高度折叠的晶体结构域(PAATAVSHTTHHAP)与超电荷类弹性蛋白[VPGVG(VPGKG)n]进行重组,两者可分别形成β-sheets折叠和无规卷曲结构,从而实现重组蛋白分子中力学刚性和延展性的结合。另一方面,重组蛋白嵌合体中超电荷类弹性蛋白模块具有高度亲水性,能够有效帮助重组蛋白正确折叠并维持构象稳定,更容易在表达宿主中实现高效生产。该工作突破了丝素蛋白范畴,实现了高力学性能的重组结构蛋白的开发,相应的蛋白设计和生物合成策略可以拓展到其他非丝素蛋白中[图1(a)、(b)]。

图1 基于多生物融合的人工结构蛋白的设计(a)、模块重组(b)与生物合成(c)Fig.1 Schematic diagram of design(a),recombination(b)and biosynthesis(c)of the man-made structural proteins
圣路易斯华盛顿大学Li等[35]通过引入淀粉样蛋白序列设计合成了新型重组蛛丝蛋白,他们将3种不同的淀粉样多肽序列分别与蛛丝蛋白中富含甘氨酸的柔性结构域(GGX)n进行重组,合成了具有不同分子量的蛋白聚合体。含有淀粉样多肽FGAILSS的重组序列的128聚体制备的纤维拉伸强度达到0.98 GPa,平均韧性为161 MJ/m3,该性能超过了大多数重组蛋白纤维以及一些天然蛛丝纤维。这项工作巧妙利用了淀粉样多肽倾向于形成β-纳米晶的特点,该策略或可应用于其他含有β-折叠结构域的蛋白序列中。
借助蛋白3D结构解析、计算模拟以及机器学习等技术,蛋白分子的从头设计已经成为可能[36],且具有合理的成功率。例如,蛋白质设计领域的巨擘David Baker团队[37-42]利用Rosetta方法设计了蛋白纳米笼、蛋白晶格、荧光蛋白类似物、人工酶和白介素类似物等。该团队[43]首次描述了从头设计单体蛋白自组装为螺旋状蛋白丝,将有助于更好地了解天然蛋白动态、多尺度组装的结构和力学,为创造全新的、多尺度组装的功能蛋白材料提供了可能性。最近AlphaFold在蛋白结构高精度预测方面的成功[44-45],也将直接促进蛋白反向折叠问题的突破和蛋白分子设计的发展,预计在不久的将来,将会催生出一系列基于深度学习的蛋白设计新方法。
1.3 结构蛋白微生物合成系统优化
研究发现高性能生物结构蛋白往往具有特殊氨基酸或序列高度重复的特点,一些蛋白如蛛丝蛋白、蓑衣虫丝蛋白、肌联蛋白和弹性蛋白等分子量较高,可以达到100~500 kDa,这无疑增加了高性能蛋白在异源系统中合成的难度。因此,为了满足高性能材料制备对于蛋白结构和功能的需求,研究者们通过开发适配的表达元件、表达系统来提升高性能蛋白在异源合成系统中的表达量,降低后续纯化难度。在本课题组的前期工作中,我们通过对酵母表达系统的分泌元件进行优化,成功实现了超正电荷重组类弹性蛋白的分泌表达(图1)。此外,通过发酵工艺优化,实现了该蛋白在原核表达系统的宏量制备(图1),产量可达200~500 mg/L[46]。
针对蛛丝蛋白序列甘氨酸含量高的特点,Xia等[47]对大肠杆菌表达宿主的代谢途径进行了改造,通过tRNAGly基因和glyA基因的协同高效表达,提升大肠杆菌宿主中甘氨酸的供给以及甘氨酰-tRNA的含量,以满足蛛丝蛋白翻译过程需求。作者构建了不同聚合度的重组蛛丝蛋白,经代谢工程改造的大肠杆菌宿主中各蛋白的表达量提升了10~35倍,成功合成了分子量接近天然蛛丝蛋白的重组蛋白(284.9 kDa),利用此高分子量蛋白制备的纤维,其综合力学性能可以媲美天然蛛丝,纤维杨氏模量甚至达到了天然蛛丝的2倍。
生物结构蛋白的分泌表达不仅可以规避蛋白胞内降解问题,同时可以提升纯化回收得率,对于蛋白材料的绿色可持续合成具有重要意义。上海交通大学钱志刚团队[48]首次建立了以谷氨酸棒杆菌(Corynebacterium glutamicum)为宿主的蛛丝蛋白高效分泌生产平台。研究发现重组蛛丝蛋白可以在特定信号肽的引导下经Sec分泌途径转运到胞外,进一步通过在转录、翻译和分泌过程进行多水平的宿主代谢工程改造以及高密度发酵,实现了重组蛛丝蛋白在胞外培养基中的高丰度富集。通过简单的酸沉淀和硫酸铵沉淀即可获得高纯度蛋白,纯化得率远超色谱纯化方法,达到2.2 g/L。此外,分泌表达的重组蛛丝蛋白具有超越天然蛋白的水溶性,可以在水相缓冲条件下制备高浓度纺丝原液,这对于实现生物仿生纺丝具有重要意义。
随着基因组编辑工具CRISPR/Cas敲低技术(CRISPRi)在细菌高通量功能筛选中的应用,可以一次性研究细菌中数千个基因和特定表型的关系[49-50]。相较于传统的利用单基因缺失或过表达来鉴定菌株表型的方法,该技术提供了一种精确、高通量定位菌株代谢调控网络的有力工具,在蛋白高效表达系统的构建与筛选中具有重要应用价值。此外,噬菌体辅助的连续进化(phageassisted continuous evolution,PACE)技术可以在人工合成系统定向进化蛋白分子。该技术通过将目标蛋白的所需活性与携带该蛋白相应基因的传染性噬菌体的适应性联系起来,具有更高期望活性的蛋白对其载体噬菌体具有更大的感染性,因此可以更有效地繁殖,从而富集有利的突变,实现蛋白分子特定功能的定向进化[51-56],如哈佛大学Liu课题组[52]开发了可溶性表达噬菌体辅助连续进化技术(soluble expression phage-assisted continuous evolution,SE-PACE),可以快速进化出大肠杆菌中可溶性表达增强的单链抗体蛋白。未来有望通过开发新的筛选工具,扩大特征谱,在噬菌体细胞工厂中实现蛋白特定结构或功能的自动化选择。
2 人工结构蛋白组装与性能优化
2.1 动态共价相互作用介导的人工结构蛋白组装
虽然蛋白材料尤其是纤维材料的力学性能通常与蛋白分子量呈正相关,但是在异源宿主中合成高分子量蛋白仍然是一个较大的挑战,并且随着蛋白分子量的增加,其异源合成效率明显降低[47]。因此,蛋白“共价”相互作用被引入人工合成系统用来发展高分子量甚至超高分子量的结构蛋白[57]。中科院苏州纳米技术与纳米仿生研究所的王强斌研究员等[58]通过在烟草花叶病毒衣壳蛋白中引入点突变,包括在横向或轴向上选取特定氨基酸突变为半胱氨酸,连接相邻亚基构成二聚体,通过该策略成功在蛋白中引入二硫键共价作用网络,制备了超长、超稳定的组装纳米结构。该工作对蛋白质自组装调控及其应用拓展具有很好的启发作用。圣路易斯华盛顿大学Zhang研究团队[59]通过内含肽自剪接实现了两个重组蛛丝蛋白的共价连接,制备了分子量达到556 kDa的超高分子量重组蛛丝蛋白。利用该重组蛋白制备的纤维拉伸强度、模量、延展性和韧性均达到天然蛛丝水平。内含肽剪接需要的两段序列IntN和IntC完全由天然氨基酸组成,可以作为一种普适性的连接工具插入到任意结构蛋白的编码序列中。在Zhang团队[60]进一步的工作中,将IntN和IntC同时连接到“单体”肌联蛋白4Ig的两个末端得到重组蛋白IntN-4Ig-IntC,重组蛋白可以在大肠杆菌系统中实现高稳定性、高通量的合成,更重要的是,在内含肽剪接作用下重组蛋白能够在细胞内进行多轮聚合反应形成超高分子量的肌连蛋白聚合体,平均分子量可到2.4 MDa。超高分子量蛋白聚合体包含更多的重复单元,有利于增加蛋白分子链间和链内的相互作用。
本团队前期工作中,通过发展双通道微流控纺丝技术,成功利用蛋白游离氨基和戊二醛,形成动态亚胺键诱导蛋白有序组装结构[图2(a)],在水相条件下实现了交联诱导的蛋白原位组装。该策略具有很好的普适性,已成功应用于牛血清白蛋白[64]、重组类弹性蛋白、重组鱿鱼环齿蛋白[34]和重组节肢弹性蛋白[61]等。我们通过递归同源重组等方式实现了不同聚合度的重组蛋白的构建,实验表明蛋白纤维的力学性能与蛋白分子的聚合度呈正相关[图2(a)]。进一步通过在重组蛋白末端引入半胱氨酸残基,利用二硫键增强蛋白分子末端交联可以进一步提升纤维性能[34]。重组鱿鱼环齿蛋白36聚体-Cys蛋白纤维的断裂强度高达650 MPa,韧性达到120 MJ/m3,优于许多高分子量(>250 kDa)的人工蛛丝蛋白[34]。
通过共价相互作用介导蛋白与其他有机/无机分子复合也是实现人工蛋白功能拓展的重要技术手段。杜克大学Chilkoti团队[65]报道了在E.coli表达系统中直接合成烷基链修饰的重组类弹性蛋白,在人工合成系统中进行类弹性蛋白底物与酵母来源的N-肉豆蔻酰基转移酶(NMT)的共表达。后者催化酰胺键的形成将C14烷基链修饰到蛋白底物的N′端,脂质化多肽能够通过温度调控实现分级自组装,利用蛋白组装体内部的脂质核结构可以负载疏水小分子药物,并且能够有效提升药物分子的体内半衰期[66]。
本文作者团队[62]开发了高性能人工蛋白复合策略,利用共价键诱导多重分子交联网络以提升蛋白组装体系的力学性能。首先,我们通过基因工程的手段设计基本重复单元为VPGKG的重组类弹性蛋白Kn(n代表赖氨酸数量),重组类弹性蛋白与带有负电的纳米纤维素(CNF)之间通过静电相互作用交联后,进一步利用戊二醛或EDC/NHS对复合纤维进行共价交联。通过共价交联后,重组蛋白-纳米纤维素复合纤维的整体力学性能得到明显的提升[图2(b)]。在另一项工作中,利用人工蛋白游离氨基与与海藻酸盐羧基之间所形成的共价酰胺键和静电相互作用以及Ca2+与海藻酸盐的配位作用构建了多重超分子网络,实现了高力学性能的人工蛋白-海藻酸钠复合纤维的制备[图2(c)][63]。纤维内部超分子交联网络有效限制了分子滑动,对提高复合纤维的力学性能起着至关重要的作用。与传统多糖或复合纤维相比,生物合成蛋白诱导的多重交联网络复合纤维具有优异的力学性能,复合纤维的最高断裂强度可达768 MPa,杨氏模量可达24 GPa,韧性可达69 MJ/m3。该方法为制造高性能复合蛋白材料提供了技术参考。

图2 动态共价相互作用介导的人工结构蛋白组装Fig.2 Dynamic covalent interactions-mediated assembly of the recombinant structural proteins
拓扑作为长度和序列这两个参数之外的一个新维度,也被加入到蛋白的人工组装工程中。拓扑参数将蛋白分子从线性的、一维多肽链转化为多链、多维的可设计元素。通过引入共价的蛋白-蛋白相互作用可以实现拓扑结构蛋白组装体的合成。比如,利用“肽-蛋白对”SpyTag/SpyCather可以重组并形成异肽键的性质[67],研究者开发出大量的具有支链结构或网状结构的蛋白分子并发展为相应的响应型或功能增强型蛋白材料[68-69]。国家纳米科学中心王浩研究员团队[70]通过发展“活体自组装”技术,在细胞内成功构建了不同拓扑结构的蛋白材料。作者提出了全新的细胞内原位聚合和组装策略,设计的多肽单体通过自由扩散的方式进入细胞,并在胞内谷氨酰胺转移酶的催化下发生共价聚合,通过设计不同氨基酸序列的多肽聚合单体,实现了在胞内聚合过程中对蛋白组装体的分子量、温敏性质以及组装后的拓扑结构进行调控。作者进一步评价了不同拓扑结构蛋白组装体的生物功能,该工作为研究蛋白组装体结构和功能的关系提供了有效手段,为功能化蛋白材料设计提供了参考。
2.2 非共价相互作用介导的人工结构蛋白组装
蛛丝蛋白β-sheets折叠结构内部丰富的氢键作用等对于促进蛋白分子自组装和稳定组装结构具有重要作用。Scheibel团队[71]报道了两种重组蛛丝蛋白NTD-eADF3-CTD和NTD-eADF4-CTD共表达的大肠杆菌表达系统。通过蛛丝蛋白CTD结构域的半胱氨酸残基氧化形成二硫键,两个共表达蛋白可以在菌体内组装为同源二聚体或异源二聚体。研究发现eADF3同源二聚体或eADF3/eADF4异源二聚体能够进一步组装形成纳米原纤维结构[图3(a)],有助于达到更高的机械强度。值得注意的是,异源二聚体纤维的综合力学性能优于同源二聚体,拉伸强度可以达到834 MPa,超过了绝大多数的重组蛛丝纤维甚至是传统化学纤维。该发现提示可以通过人工合成系统控制蛋白组合及其含量,进而影响蛋白的装配特性并激发蛋白组装体新的有利性质。

图3 非共价相互作用介导的人工结构蛋白组装(a)蛋白末端结构域及折叠结构内部作用诱导的蛋白有序自组装[71];(b)人工蛋白与长链DNA分子的复合组装[61];(c~d)超电荷重组类弹性蛋白与表面活性剂分子的复合组装[72-73]Fig.3 Non-covalent interactions-mediated assembly of the recombinant structural proteins(a)Protein self-assembly induced by both C-terminal domain and internal actions among secondary structural elements[71];(b)Composite assembly of recombinant structural proteins and DNA molecules[61];(c~d)Composite assembly of supercharged recombinant structural proteins and surfactant molecules[72-73]
将多肽或蛋白模块与其他生物/非生物组分通过非共价相互作用进行结合,制备复合组装超分子体系是实现功能集成的有效策略。中国科学院化学研究所李峻柏教授团队[74]通过阳离子二肽与多金属氧酸盐(POMs)间的静电相互作用共组装形成杂化超分子结构。上海交通大学周永丰教授团队[75]通过藻蓝蛋白与四臂卟啉星形聚合物的静电自组装,制备了类胶束杂化天然人工捕光纳米系统。复旦大学陈国颂教授团队[76]通过蛋白和多糖分子间的相互作用以及π-π堆积作用,成功利用大豆凝集素蛋白四聚体制备了精确组装的蛋白微管结构,具有增强免疫反应的能力。本团队[61]前期工作中,通过长链鲑鱼精DNA(2000 bp)与不同聚合度的重组节肢弹性蛋白(RS蛋白)的静电相互作用构建RS-DNA复合纤维,RS蛋白和DNA以赖氨酸与磷酸盐比例为1∶1或2∶1的比例混合在水溶液中,形成“液-液”相分离的凝聚复合物,进一步通过复合物拉伸可制备复合纤维[图3(b)]。由于RS蛋白与DNA骨架之间的静电络合作用,当纤维被拉伸时,RS蛋白的弹性区域沿着坚硬的DNA骨架滑行,因此该复合纤维具有极强的延展性和韧性,其中RS24-DNA纤维的韧性高达250 MJ/m3,超过许多聚合物纤维,甚至可媲美天然蛛丝纤维。
此外,本文作者团队利用超负电荷类弹性蛋白与阳离子型表面活性剂的静电络合成功开发机械响应型蛋白液晶材料,实现了剪切力诱导的蛋白流体无序-有序的相转变,通过蛋白液晶双折射纹理读出机械感应的图案可以用于记录指纹信息[77]。进一步的研究发现,超负电荷类弹性蛋白与长烷基链阳离子型表面活性剂复合可形成长程有序的层状结构,并以此发展了新型的蛋白液晶材料[78]。进一步通过调节重组类弹性蛋白的电荷密度,能够有效调节所负载的表面活性剂分子的结合量和超分子作用力(静电力,疏水相互作用,范德华力,氢键等),可用于制备蛋白液晶凝胶纤维[79]。研究发现电荷密度加倍后凝胶纤维的机械强度、杨氏模量和韧性显著提升。该研究通过改造人工蛋白氨基酸序列改变材料的力学性能,为发展具有可编程特性的机械生物材料提供了一种简便方法。
类似地,超正电荷蛋白与阴离子表面活性剂之间的超分子相互作用也可用于拓展蛋白组装体系的性能。本团队马超、孙静等[72-73]利用超正电荷重组类弹性蛋白和带有苯磺酸、多巴或偶氮苯结构的阴离子表面活性剂的静电络合制备了具有超强界面黏附性能的蛋白材料,体系中的多种超分子相互作用尤其是阳离子-π、π-π和金属配位相互作用,对蛋白组装体的强黏附行为作出了重要贡献[图3(c)、(d)]。孙静等[80]进一步开发了一种新型的蛋白-表面活性剂复合蛋白纤维,通过金属离子配位作用能够显著提升纤维的力学性能,更重要的是,稀土离子配位赋予纤维稳定的荧光性能,该研究为人工蛋白材料的合成、力学性能调控以及与无机材料的功能整合提供了新策略。
此外,在本课题组前期工作中,成功发展了人工结构蛋白与聚乙二醇羧酸盐、硫酸软骨素等复合的蛋白纳米组装体系。我们利用设计合成的超正电荷类弹性蛋白与聚乙二醇羧酸盐的静电复合成功制备出蛋白聚集体纳米颗粒,蛋白纳米颗粒的形成源于聚乙二醇羧酸盐屏蔽重组类弹性蛋白电荷后后者发生“亲水态”-“疏水态”相转变[81]。利用此类蛋白聚集体纳米颗粒,成功发展近红外荧光蛋白纳米探针和多种长效药物载体[81-85],其中近红外荧光蛋白纳米探针可以通过尾静脉注射直接实现实体瘤和转移瘤的成像监测,突破了荧光蛋白依靠基因转染才能发挥作用的瓶颈;长效药物载体可将蛋白药物IL1-Ra的体内半衰期提升约5倍,生物利用度提升约7倍,显著提升对类风湿性关节炎和痛风等骨关节疾病的治疗效果,给药周期可延长14倍[82,85]。
3 高性能蛋白纤维及黏合剂材料应用
合成生物学为创造具有定制形态和功能的蛋白材料提供了可能性。高性能蛋白应用的核心问题在于如何利用蛋白分子构筑更高级次的复杂结构,使人工蛋白分子组装成为功能性的宏观体系。中国科学院过程工程研究所闫学海教授等[86]、盐城工学院邵荣教授等[87]对通过蛋白自组装、酶催化等手段制备肽基水凝胶的工作进行了详细综述。在此,我们将对通过蛋白的多级有序组装制备具有高力学性能或高黏附性能的纤维与黏合剂材料的代表性研究进行总结(表1)。目前,已有的人工高性能蛋白组装方法有着一些难以规避的缺点,包括组装过程蛋白二级结构破坏导致对超分子作用网络的损害、偏重于蛋白β-折叠结构而忽略了α-螺旋、无规卷曲、β-转角等二级结构对力学功能的贡献、难以实现不同二级结构的动态调控等。因此,如何对组装过程进行控制,实现精细动态调控和多尺度组装,仍然是高性能蛋白材料体系整体性能提升及应用面临的一个重要挑战。
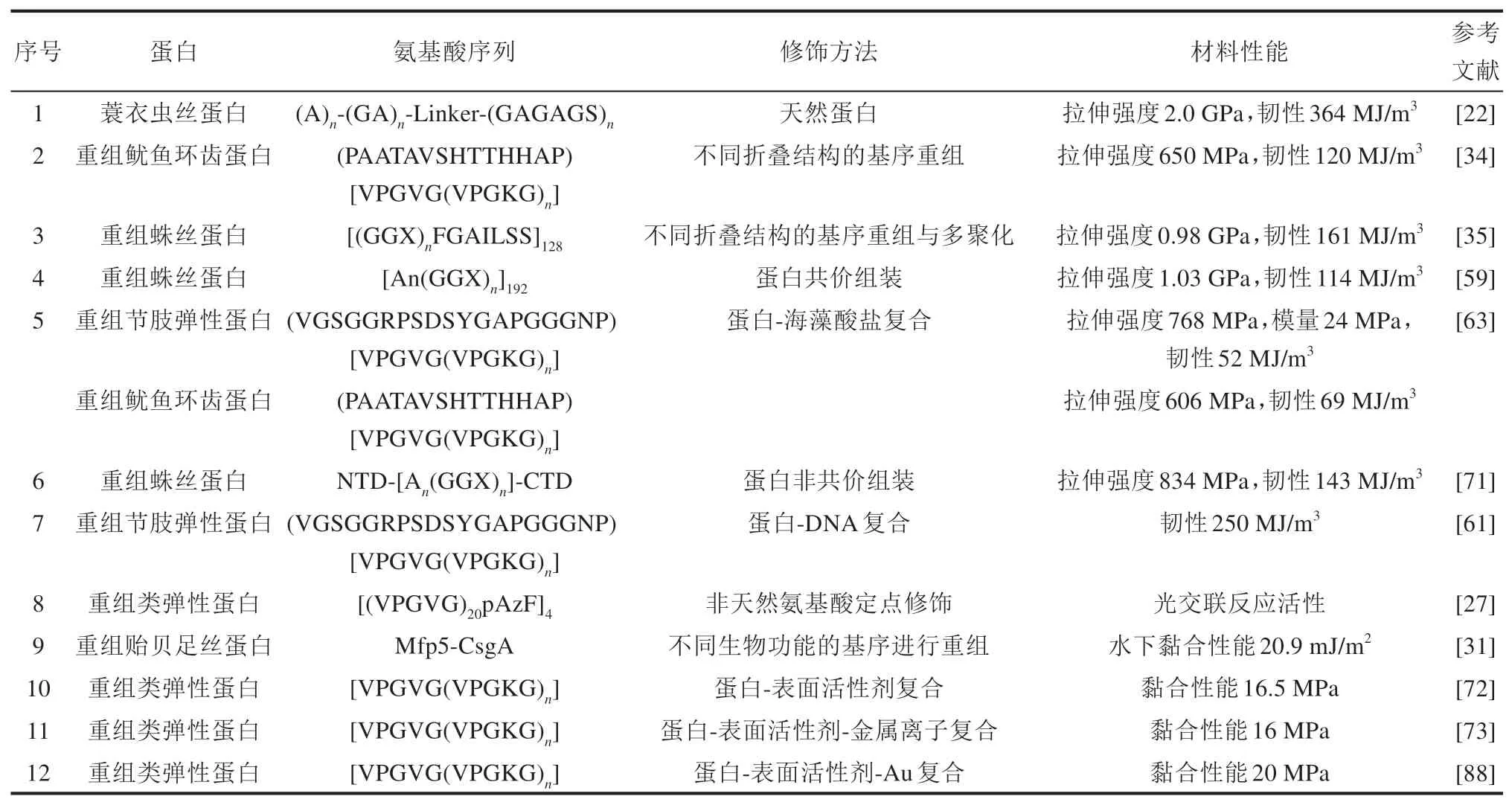
表1 高性能蛋白纤维和黏合剂材料性能汇总Tab.1 Properties of high-performance protein fibers and adhesives
3.1 高性能蛋白纤维材料开发及应用
丝蛋白纤维如蛛丝、蚕丝具有低密度、高强度、高延展性和生物相容性等特点,在过去数十年间,丝素蛋白一直是开发蛋白纤维材料的首选[87,89-90]。人工丝蛋白纤维已被成功应用于纺织、军工和生物医学材料等领域[91-92]。近年来,组学测序技术的发展拓展了高性能生物结构蛋白的序列信息[93],为利用新型结构蛋白制备高性能、多功能的纤维材料提供了支持。Gaddes等[94]利用鱿鱼环齿蛋白SRT温度响应的相转变和自组装特性,通过SRT涂层修饰制备了具有自修复能力的纤维及织物。南洋理工大学Fu等[95]利用盲鳗黏液蛋白制备人工纤维材料,盲鳗黏液蛋白的两个亚基EsTkα和EsTkγ可以组装为中间丝结构,外力拉伸能够诱导中间丝延展并生成β-sheets链段,因此盲鳗黏液蛋白人工纤维具有良好的延展性,同时通过蛋白赖氨酸残基之间的共价交联能够显著提升纤维材料的拉伸模量。
微流控技术能够对纺丝条件如离子强度、pH以及剪切力等进行梯度控制,这为在纺丝过程中实现蛋白分子结构动态精细调控,诱导蛋白多级结构形成,减少蛋白分子间缺陷,进而实现蛋白分子从“分子-纳米-宏观”跨尺度协同组装提供了可能[96]。本团队[97]进一步将该纺丝策略应用于胶原蛋白和各类卵白,发展了高强度、可生物降解的纤维缝合线材料,并成功应用于动物模型中皮肤和器官伤口的稳定缝合[图4(a)]。

图4 高性能蛋白纤维材料在生物体内的应用Fig.4 Applications of high-performance protein fibers in vivo
此外,结构蛋白分子与其他有机/无机分子的复合或杂化也是蛋白纤维性能优化的重要途径。Mohammadi等[98]报道了利用三嵌段的重组蛛丝蛋白和纳米纤维素制备高强高韧的复合蛋白纤维。三嵌段蛋白末端的纤维素结合结构域(CBM)可以通过芳香残基介导的疏水相互作用结合长链纳米纤维素,三嵌段蛋白中间的蛛丝蛋白结构域具有较强的分子间相互作用,因此能够自组装成凝聚体从而增强纳米纤维素长链间的桥接,此外凝聚体的低黏度和表面张力也促进了蛋白分子对纳米纤维素的渗透与黏附,复合蛋白纤维材料与原纤维相比力学性能得到明显提升。
在我们团队[99]的工作中,利用非共价/动态共价相互作用构建复合蛋白纤维,不仅能够提升纤维的机械强度和韧性,同时实现纤维材料的组织顺应性,拓展了高性能蛋白纤维的应用领域。通过开发超电荷重组类弹性蛋白并利用蛋白与带相反电荷的表面活性剂分子的超分子组装诱导二者的向列型排布,成功制备有机胶蛋白纤维,利用有机胶蛋白纤维各向异性的力学特性及其生物相容性,实现了骨髓间充质干细胞在纤维上的原位增殖和细胞分化[图4(b)]。该项研究首次证明了蛋白各向异性组装结构在细胞力学生物学中应用的可行性。利用超正电荷类弹性蛋白和偶氮苯基表面活性剂之间的静电相互作用制备了蛋白纤维,并进一步通过表面活性剂分子偶氮部分的光异构化实现了光诱导纤维材料内阳离子-π相互作用增强,可逆地触发了蛋白纤维的抗拉强度、刚度和韧性的调制。该研究为开发刺激响应的机械生物材料提供了新策略[100]。前述我们利用重组节肢弹性蛋白和湿法纺丝技术通过戊二醛与蛋白嵌合体赖氨酸残基形成动态亚胺键网络制备了高拉伸强度的蛋白纤维及纤维补片,该纤维材料成功应用于大鼠腹腔疝气手术创口的修复,表现出优异的抗粘连和促进修复的效果[61][图4(c)]。
本文作者团队[62]还利用重组类弹性蛋白-纳米纤维素复合纤维(拉伸强度及韧性分别为551.2 MPa和40.6 MJ/m3)制备抗冲击网并探究其抗冲击性能。实验发现复合纤维抗冲击网能够承受3.0 g的钢球从20 cm高处坠下引起的重力势能,作为对照的纳米纤维素抗冲击网在高度为15 cm时即被击穿。另外,当质量为13.9 g的钢球从15 cm的高处坠下,复合纤维抗冲击网能够保护其下方的盖玻片完整[图5(a)]。复合纤维抗冲击网可以承受比纳米纤维素抗冲击网高1.4倍的重力势能,在抗冲击材料领域具备良好的应用前景。
我们的前期工作中,在超电荷类弹性蛋白与鱿鱼环齿蛋白嵌合体的基础上[34],进一步通过调控嵌合体折叠域与非折叠域的比例实现了对蛋白组装体系结构及性能的编程调控,实现蛋白材料的形貌与力学性能的可控调节,制备出具有优异柔韧性和断裂强度的宏观蛋白组装体[46],进一步将信息编码多肽整合到蛋白组装体系中,实现了蛋白组装材料在信息存储领域中的新应用[图5(b)]。

图5 高性能蛋白纤维材料在抗冲击(a)[62]和信息存储领域(b)[46]的应用Fig.5 Applications of high-performance protein fibers for impact resistance(a)[62]and information storage(b)[46]
3.2 高性能蛋白黏合材料开发及应用
蛋白分子具有不同功能基团的氨基酸侧链决定了黏附材料的各种内在性质,并使其与不同表面发生特定的相互作用。此外,结构蛋白分子通过特殊的二级或三级结构形成相应的氨基酸侧链的空间排列从而影响蛋白与不同底片的黏附性能[101-102]。英国曼彻斯特大学Roberts等[103]报道了非共价交联牛血清白蛋白和低分子量的重组蜘蛛丝蛋白(NTD-R7-CTD)在玻璃等透明基质上具有较强黏附性能,分别为8.53 MPa和6.28 MPa,其黏附性能主要来源于脱水诱导蛋白二级结构重组,形成β-折叠的超分子结合和密集的氢键作用网络。此外,两类蛋白黏合剂均具有很好的可见透明度和环境稳定性,有望替代传统化学黏合剂用于透明底片黏合。
近年来基于贻贝足丝蛋白的仿生黏合剂受到广泛研究。贻贝足丝蛋白中含有邻苯二酚即多巴结构,多巴羟基可以通过氢键在极性表面进行化学吸附,在氧化或碱性条件下,通过将邻苯二酚羟基氧化为邻苯醌能够有效促进蛋白的交联反应,这对于蛋白黏合剂的内聚力和力学黏附性能至关重要。此外,多巴可以与金属离子发生配位螯合反应,并能与半胱氨酸、赖氨酸、酪氨酸等氨基酸侧链形成阳离子-π、π-π相互作用。因此,该类蛋白分子在干燥和潮湿环境中均展示出良好的力学黏附性能。许多研究通过在重组蛋白或合成多肽中模仿多巴功能化开发具有高通用性和良好生物相容性的蛋白黏合材料[104-106]。
除贻贝外,沙堡蠕虫和藤壶的分泌蛋白也具有良好的黏附性能。与贻贝足丝蛋白的黏附机制不同,沙堡蠕虫蛋白除利用多巴结构外,其黏附作用还依赖于另一类重要的氨基酸,即磷酸丝氨酸,磷酸丝氨酸可以通过二价阳离子(如Ca2+)介导的静电相互作用结合在一起促进蛋白黏合体系的形成[107-109]。藤壶黏附蛋白的黏附性能则被认为与蛋白自组装过程以及蛋白内部或分子间的疏水相互作用相关[110-112]。塔夫斯大学Omenetto团队[113]联合贻贝足丝和藤壶蛋白的黏附机制开发了由丝素蛋白、聚多巴胺和Fe3+组成的复合黏合剂,丝素蛋白用来仿生藤壶黏附蛋白的成键特性和βsheets组装能力,聚多巴胺和Fe3+可以发挥交联和固化的效果,该复合黏合剂的水下黏合强度高达2.4 MPa,甚至超过了大多数商用黏合材料。
本文作者团队的前期工作中,通过重组类弹性蛋白与其他分子复合,从而形成强内聚性交联分子网络,发展了系列多功能的蛋白基黏合材料。通过超正电荷类弹性蛋白与表面活性剂分子的静电络合形成复杂凝聚态胶水SUP-SDBS,SUP-SDBS黏合剂在多种底片(玻璃、金属、PVC或PE)的黏附性能与商用氰基丙烯酸酯胶相当。此外,对于动物模型软组织伤口具有良好的黏合效果,同时表现出积极的促进止血和加速愈合的作用[图6(a)][72]。在上述工作的基础上,进一步开发了类弹性蛋白与多巴表面活性剂或偶氮苯表面活性剂(NDP和NAT)复合的黏合剂体系[73]。在多种超分子相互作用特别是静电力、阳离子-π相互作用和金属配位的作用下,这种蛋白黏合剂在各种基质、软组织和内部器官上表现出超高的黏附性能[图6(b)]。此外,根据类弹性蛋白的可逆相变特性,我们设计了一种基于热响应多肽的可逆温度调控的动态黏合材料[114]。与缝合线和商用化学黏合剂相比,蛋白黏合剂具有可生物降解的性质和超分子结合特性,可能很好地适应基质和组织的动力学,具有快速止血、避免炎症反应和加速愈合的作用,具有广泛的应用前景。我们设计了重组类弹性蛋白-聚乙二醇羧酸盐-硫酸软骨素静电复合组装体系,双静电作用网络显著增强了组织黏附力,同时黏合剂体系的多重非共价作用提供了良好的形态学顺应性,并且能够实现硫酸软骨素的缓释,维持较高的生物活性,因此,该蛋白黏合剂为软骨形成和软骨相关胞外基质的产生提供了理想的生物相容性环境,拓展了在软骨修复中的横向整合作用,实现了对动物模型中骨关节损伤的高效修复[图6(c)][115]。

图6 高性能蛋白黏合材料在生物体内的应用(a~b)超电荷重组类弹性蛋白-表面活性剂分子蛋白黏合剂在止血和伤口黏合中的应用[72-73];(c)重组类弹性蛋白双网络静电复合蛋白黏合体系及软骨修复应用[115];(d)近红外光响应的蛋白纳米黏合体系及肿瘤光热治疗[88]Fig.6 Applications of high-performance protein adhesives in vivo(a~b)Supercharged ELPs-based adhesive and the applications in hemostasis and wound repair[72-73];(c)Fabrication of the engineered protein adhesive as a conjoined network and applications in cartilage repair[115];(d)Fabrication of protein photothermal bioplaster(protein-SDBS-GNRs)and non-invasive skin tumor therapy[88]
在我们团队最近的工作中,进一步利用蛋白分子与有机/无机分子反应的灵活性和多样性,开发了具有动态响应特性的、多功能的人工蛋白黏合材料[88]。我们通过基因工程的手段合成了超正电荷类弹性蛋白并在其两端引入半胱氨酸残基。金纳米棒可以通过与半胱氨酸的巯基形成金硫键从而与蛋白共价络合[88]。利用正电荷类弹性蛋白、金纳米棒和十二烷基苯磺酸钠(SDBS)之间的共价络合以及静电作用制备了近红外光响应的蛋白纳米黏合体系PPTB[图6(d)]。基于液液相分离得到的PPTB展现出了强大的黏附性能,其在铁、铝、玻璃等高能表面均展现出了超强的黏合强度(13.0~20.0 MPa),其性能表现甚至超过了商用的氰基丙烯酸盐黏合剂。研究认为,这一高性能表现可能来源于PPTB与表面的化学相互作用和机械互锁行为。更为重要的是PPTB在离体猪皮上体现出近红外光照增强的黏附性能,相较于不照射的猪皮,经过照射之后的猪皮的黏合强度最高可提高17.5倍。黏合强度的增加源于PPTB在近红外激光照射下产生的光热效应。其产生的热量可以促进水分子的蒸发,从而增强了PPTB体系中的阳离子-π相互作用和氢键作用。同时光热实验表明,PPTB具有优异的光热转换性能,其光热转换效率可达22%。强大的界面黏附力允许PPTB和皮肤表面之间进行高效的热传递,从而在808 nm激光照射下实现小鼠皮肤瘤的完全清除。该项工作为开发蛋白-无机分子复合材料,推进蛋白力学性能和光、电、磁功能融合提供了重要参考。
4 结论与展望
高性能结构蛋白及其组装材料在生物医疗器械、组织工程、生物基包装产品、化妆品等高技术领域显示出越来越重要的研究价值。随着合成生物学技术的发展,对于高性能蛋白材料体系的研究已经突破了单一蛋白的限制,逐步发展了结构蛋白功能模块修饰、重组策略,人工合成系统和多尺度组装方法,高性能蛋白材料体系的功能范围也将不断扩展。此外,通过对蛋白及多尺度组装体系的设计和优化,逐步强化了“蛋白序列-结构组装-材料性能”的理论框架。然而,由于缺乏适配的理论预测模型,蛋白材料的定向设计仍然是一个挑战。未来研究中亟需创建结构蛋白序列库和高通量的材料性能评估方法,进而为深度学习算法提供大数据,反馈指导蛋白材料的理性、定向设计,这也进一步凸显出开发新理论和新的计算工具的紧迫性。此外,高性能结构蛋白生物合成的效率、规模和成本也是制约材料应用的关键因素。结构蛋白分泌表达的人工合成系统对于降低后续纯化成本具有重要意义,我们预计基因组规模的基因编辑优化和定向进化技术或将成为开发高效合成宿主的有力工具。在蛋白材料的应用方面,虽然蛋白分子具有生物相容性和可降解性的固有优势,但其环境耐受性和体内稳定性仍需全面考量,因此,通过与生物/非生物材料的功能集成开发新的蛋白材料形式,突破稳定性维持也将是实现蛋白材料应用的关键步骤。另外,自然界中许多蛋白材料具有自修复和自我再生的功能,如何通过自主设计使蛋白材料向自修复、自感知和自增殖的活体功能材料方向演进是未来合成蛋白材料技术发展方向之一。

