基于加权基因共表达网络分析非动脉炎性前部缺血性视神经病变的关键基因
尚孟秋,廖 良
作者单位:1(100020)中国北京市,北京中医药大学;2(100078)中国北京市,北京中医药大学东方医院眼科
0引言
非动脉炎性前部缺血性视神经病变(nonarteritic anterior ischemic optic neuropathy, NAION)的发病率约为2.3/100000~10.2/100000[1],临床上常以急性视力下降和视野缺损为主要症状。NAION可导致严重视功能损害,但目前临床上尚无特效治疗方法[2],主要通过改善视网膜血液循环以提高患者视功能;且NAION发病机制尚未明确,其分子机制仍待进一步研究。生物信息学通过联系计算机与自然科学,能够解释复杂的生物机体,为研究疾病的生物学过程及分子机制提供新思路。加权基因共表达网络分析(weighted gene coexpression network analysis, WGCNA)是依据基因与基因间的互作关系构建的加权网络[3],在处理大量样本的复杂数据时存在优势,现已应用于癌症、心衰等多种疾病[4]。本研究中使用WGCNA方法筛选出与NAION临床特征高度相关的模块,并对模块内进行通路富集分析与关键基因筛选,并通过关键基因预测相关微小RNA(micro ribonucleic acid,miRNA),从而为阐明NAION的发病机制提供有力支持。
1材料和方法
1.1数据预处理与加权基因共表达网络构建从基因表达数据库GEO(https://www.ncbi.nlm.nih.gov/geo/)下载芯片GSE43671,芯片平台为GPL6294,其中包含18只NAION模型大鼠及18只空白对照组大鼠视网膜组织中的基因表达谱。利用R软件(4.0.3)内的limma包对原始数据标准化数据、基因名称注释、构建表达矩阵等预处理。使用R语言中的WGCNA包对预处理后的基因表达谱进行加权基因共表达分析:(1)应用hclust函数对样本聚类,剔除离群样本;(2)应用pickSoftThreshold函数筛选合适的软阈值以构建无尺度网络,设定拟合指数为R2≥0.85;随后,用blockwiseModules函数通过动态树剪切算法对模块聚类,要求最小簇基因数30个,合并相似模块的阈值为0.25。
1.2特异性模块识别与模块内基因相关性分析对每个模块进行主成分分析(principle component analysis, PCA),将模块特征基因值(module eigengene, ME)即模块的第一主成分[5]与表型性状相关联,与性状相关性R最高且P≤0.05的模块即为组织特异性模块,计算基因显著性(gene significance, GS)和模块成员(module membership, MM),对模块内基因进行筛选,范围设置为MM>0.8且|GS|>0.2。
1.3富集分析使用R语言的clusterProfiler包对特异性模块进行基因本体论分析(GO)和京都基因与基因组百科全书分析(KEGG)富集分析。以P<0.05表示富集的通路有统计学意义。
1.4筛选核心基因与miRNA预测将特异性模块内符合筛选范围的基因导入在线数据库STRING(https://cn.stringdb.org/cgi/network.pl),选择综合分数大于0.9的主要蛋白,构建蛋白互作网络(proteinprotein interaction,PPI),将结果导入Cytoscape软件,使用软件内cytohubba插件,基于最大集团中心性(maximal clique centrality, MCC)[6]筛选排名前10的关键基因。将获得的关键基因导入TargetScan数据库[7]预测靶向miRNA,用Cytoscape绘制miRNA-关键基因网络图。
2结果
2.1加权基因共表达模块构建将高度设定为45,未发现离群样本,纳入所有样本进行分析,见图1A。当拟合指数R2为0.85时,选择合适的软阈值为9,见图1B。使用动态剪切树算法分割模块并构建网络图,见图1C,在GSE43671数据集中共识别出22个模块,见图1D。绘制模块相关性热图,见图2A,根据模块与性状间的相关系数选择特异性模块,22个模块中蓝色模块相关性系数最高(cor=0.79,P<0.01),见图2B。计算蓝色模块内基因的|GS|和MM值并绘制散点图,设置MM>0.8、|GS|>0.2对蓝色模块内的基因进行初步筛选,最终纳入1380个基因进行后续关键基因的筛选。

图1 WGCNA分析NAION相关模块 A:样本聚类;B:选定最佳软阈值;C:基因共表达网络分析,确定共表达数据模块;D:各模块特征与性状间的相关系数,括号中的数字为相应的P值。

图2 WGCNA分析NAION相关模块 A:模块聚类及相关性热图;B:GS与MM的相关性,cor为两者间的绝对相关系数。
2.2富集分析将蓝色模块的全部1 958个基因纳入分析,GO分析共得到富集分析通路130条,包括生物学过程(biological process, BP)93条、细胞组分(cellular component, CC)34条、分子功能(molecular function, MF)3条,排名前10的通路信息见表1;KEGG分析共富集得到通路18条,主要集中在神经信号传递通路、人乳头瘤病毒感染通路、MAPK通路、PI3K/Akt通路等,排名前10的通路见表2,应用R语言GOplot包绘制GO分析可视化图,ggplot2包绘制KEGG可视化图(图3)。

图3 GO及KEGG富集分析图 A:GO富集分析气泡图;B:KEGG富集分析气泡图;C:GO富集分析网络图。

表1 GO富集分析排名前10通路

表2 KEGG富集分析排名前10通路
2.3关键基因筛选及miRNA预测基于Cytoscape软件中的cytohubba插件,关键基因为MCC算法排名前10的基因,分别为Psmb9、Psma7、Map3k14、Psme1、Nfkb1、Rela、Psma5、Relb、Psmb4、Nfkb2,共预测得到6个miRNA靶点,分别为rno-miR-383-5p、rno-miR-9a-5p、rno-miR-155-5p、rno-miR-223-3p、rno-miR-495、rno-miR-325-3p(表3),使用R语言的ggcorrplot包绘制关键基因的相关性图(图4A),表明关键基因间存在正相关关系,使用cytoscape软件绘制miRNA-关键基因网络图(图4B)。
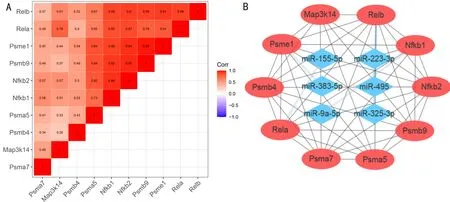
图4 关键基因分析及miRNA预测 A:关键基因相关性热图;B:关键基因-miRNA网络图。
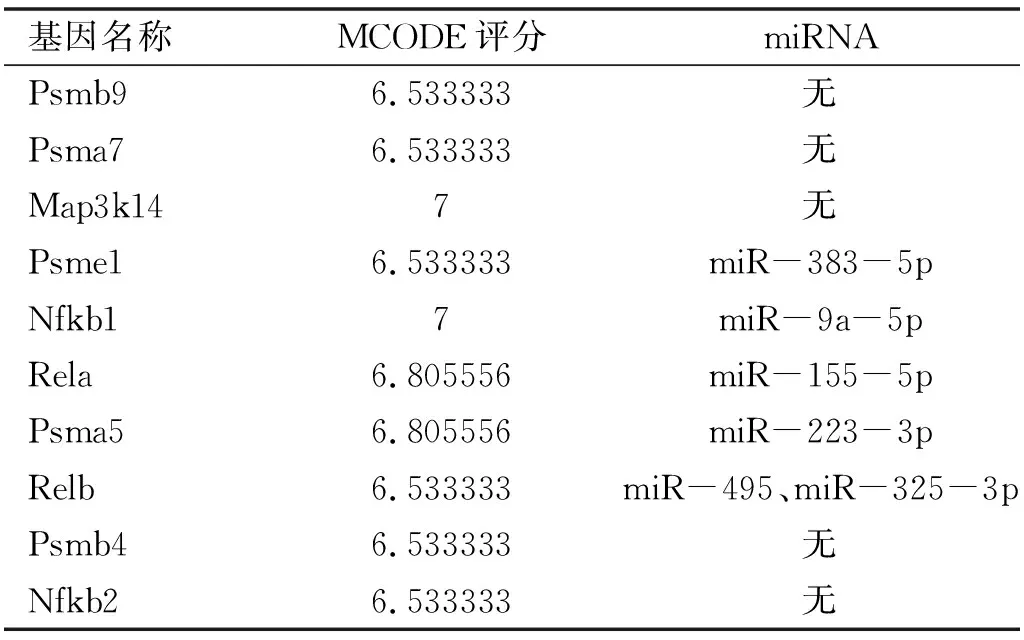
表3 关键基因及miRNA预测
3讨论
目前公认的NAION诱发因素为视盘血供灌注压降低和危险视盘结构[8],现已证实的血管危险因素包括高血压、夜间低血压、糖尿病等,同时可能与高脂血症、贫血、吸烟、服用部分药物等因素有关[9-10]。但目前NAION的病理机制尚未完全明确,且临床上缺乏有效的治疗药物。因此,开展NAION分子机制的研究有助于NAION的治疗。
与传统的转录组差异基因分析方法相比,WGCNA算法能够在基因相互关系的基础上引入加权值,更充分地利用基因信息,从而构建出了更具有生物学意义的共表达网络,更贴近生物体内的真实情况。本研究通过WGCNA方法分析GSE43671数据集,共获得22个模块,其中蓝色模块相关性最为显著,对蓝色模块内基因进行GO与KEGG富集分析,结果显示这些基因主要富集于MAPK通路、PI3K/Akt通路等。PI3K/Akt是经典的抗凋亡、促存活信号通路,也是保护视网膜神经节细胞(RGCs)功能的重要通路。有研究表明PI3K/Akt通路可以通过激活下游mTOR分子,通过调控自噬以保护视神经[11]。Husain等[12]学者研究表明PI3K/Akt通路可抑制RGCs的凋亡,其机制与促进下游NF-κB活化,引起其调控的促凋亡基因的凋亡有关[13]。MAPK信号通路包含ERK、JNK、SAPK以及P38 MAPK共4条途径,在细胞增殖、炎症、凋亡等多种生物过程中发挥重要调节作用。Foxton等[14]学者证明P38 MAPK介导了视网膜神经节细胞轴突远端运输丢失。Produit-Zengaffinen等[15]学者发现将JNK抑制剂注射进入缺血再灌注大鼠的玻璃体腔内,结果显示RGCs凋亡率显著下降。Yang等[16]证明MAPK通路级联反应会打破轴突能量平衡,引起ATP减少以及钙离子积累,最终激活钙蛋白,使轴突破裂。以上实验证明MAPK信号通路对NAION有重要作用。
通过cytohubba插件对特异性模块内的基因进行筛选,得出关键基因,关键基因中Rela、Relb均为NF-κB蛋白的亚基,Nfkb1、Nfkb2则分别调控NF-κB蛋白的亚基P50与P52,NF-κB能够在能量平衡、炎症及凋亡中发挥多向性转录调节作用。Ando等[17]学者在体外实验中证明NF-κB可降低RGCs的凋亡率。
miRNA是一类由21~24个RNA构成的非编码蛋白单链RNA,其功能主要是将沉默的mRNA翻译成蛋白质,以此调节细胞活动,其在调控基因表达、细胞周期、细胞增殖等生物过程中起到重要作用。本文通过Target Scan数据库共预测到6个miRNA,其中部分miRNA在神经细胞的保护作用或其在眼科相关疾病中的作用已得到证实[18]。Wang等[19]学者通过实验证明miR-155-5p可以促进Wistar大鼠的神经修复,其机制可能与cAMP/PKA通路有关;miR-9a-5p的上调可抑制ATG5介导的自噬活动[20],减轻大脑中动脉闭塞导致的神经节细胞损伤;miR-495可以通过Gria2蛋白减轻神经元损伤[21];miR-383可调控PI3K/Akt信号通路的表达,Jiang等[22]发现miR-383上调会上调PRDX3表达,引起高糖诱导的视网膜色素上皮细胞活力下降,导致细胞凋亡和活性氧形成。miR-325-3p在多种疾病的发展进程中起作用,有研究表明上调miR-325-3p可抑制血管内皮细胞焦亡[23],过表达miR-325-3p可通过使MAPK通路失活来减少氧糖剥夺/复氧(OGD/R)诱导的神经元凋亡[24]。
综上所述,本研究将WGCNA方法应用到NAION以研究其基因表达,并筛选获得关键基因,构建miRNA-关键基因网络,为研究NAION的发病机制和治疗方法提供了新见解。但本研究同时也存在样本量少且缺乏基础实验等不足之处,下一步还需进行动物实验和细胞实验加以验证。

