复合酵母菌的接种方式对水蜜桃酒品质的影响
罗 倩,吴祖芳,翁佩芳
(宁波大学 食品与药学学院,浙江 宁波 315832)
水蜜桃(Prunus persica)色泽鲜艳,营养丰富,属呼吸跃变型水果,极易变软腐烂[1],将其加工为水蜜桃酒,在延长货架期的同时,能够最大限度保留其水分载体,是一种较为理想的加工方式.果酒发酵是很复杂的生化过程,易受多种因素影响,如酵母菌种类、原料种类[2]、接种方式等.酵母菌生长代谢过程中产生的一系列风味物质在果酒风味方面起着关键性作用[3].但由于酿酒酵母发酵能力过强,导致生化反应复杂程度下降,酒体口味单一同质化[4].近年来,人们越来越重视非酿酒酵母在酿酒过程中的应用.酵母菌混合发酵可有效降低果酒有机酸及乙醇产量[5],增强酒体香气特征[6],进而改善果酒风味与口感[7].然而混菌发酵中组合比例、接种顺序等均会对结果产生较大影响,如过高比例的非酿酒酵母接种易产生一些不好的次级代谢物[8];共同发酵时,酿酒酵母会对非酿酒酵母产生一定抑制作用,而不同顺序接种能延长非酿酒酵母生长期,从而更大程度保留酒中原果香特征.曾朝珍等[9]研究发现,先接种非酿酒酵母24 h后接种酿酒酵母,能够促进苹果白兰地中香气物质的合成,改善酒体风味和品质.Lee 等[10]以同时接种发酵组为对照发现,在酿酒酵母发酵7 d后,接种非酿酒酵母得到的木瓜酒风味独特,品质优良.
β-葡萄糖苷酶(β-glucosidase)是一种风味酶,能够通过水解糖苷前体释放风味物质,进而丰富果酒风味[11],在食品增香中有广泛应用.研究表明,相比酿酒酵母,非酿酒酵母具有较高的分泌β-葡萄糖苷酶能力[12],且β-葡萄糖苷酶在东方伊萨酵母中有较高的活性[13].香气特征是果酒的重要品质特征之一,果酒发酵过程中产生的挥发性化合物是果酒香气特征的主要贡献者.酿酒酵母主要完成乙醇发酵,非酿酒酵母则是将原料中的前体物质转化为风味物质,并合成多种酶,从而影响果酒色泽和风味等[14].Renault 等[15]研究发现,与酿酒酵母纯种发酵相比,混合发酵能够增多一种特定的乙基酯,从而增强葡萄酒的复杂性和果味.而东方伊萨酵母除了能产生较多高级醇物质以外[16],还具有耐热、耐酸、产酯能力强等特点[17].
本研究选用酿酒酵母PY01 以及东方伊萨酵母Io,按照不同接种方式混合菌种来发酵水蜜桃果酒,同时以2 种菌单独发酵为对照,研究果酒发酵过程中产β-葡萄糖苷酶活性的影响;通过气相色谱-质谱法(GC-MS)测定水蜜桃酒中挥发性风味物质,探究不同接种方式发酵水蜜桃酒香气成分差异,以期为提升水蜜桃酒品质作为理论依据.
1 材料与方法
1.1 材料与试剂
实验用水蜜桃: 购买于浙江省宁波市奉化区种植基地,选取9~10 成熟(外观微黄,略带红色,柔软多汁,桃香浓郁)的水蜜桃[18].
菌种: 酿酒酵母PY01(Saccharomyces cerevisiae,PY01)及东方伊萨酵母Io(Issatchenkio orientalis,Io)均保存于宁波大学食品生物技术实验室.
试剂: YPD 培养基,β-GC 活性检测试剂盒,北京Solarbio 科技有限公司;柠檬酸(食品级),江苏科伦多食品配料有限公司;果胶酶,源叶生物科技有限公司;偏重亚硫酸钾、3,5-二硝基水杨酸、异抗坏血酸钠均为分析纯,国药集团化学试剂有限公司;乙醇检测试剂盒,爱尔兰Megazyme 公司.
1.2 仪器与设备
多功能榨汁机,韩国惠人电子有限公司;Spectramax190 型全波长酶标仪,美国美谷分子仪器Molecular Devices 有限公司;7890B-7000C 气相色谱-质谱(GC-MS)联用仪,美国Agilent 公司;DVB/CAR/PDMS 萃取头(50/30 μm),美国Supelco 公司.
1.3 方法
1.3.1 水蜜桃酒酿造流程
9~10 成熟水蜜桃→清洗去核→破碎打浆→偏重亚硫酸钾、异抗坏血酸钠抑菌护色→果胶酶酶解→过滤→调节pH、含糖量→巴氏灭菌→接种酵母主发酵→后发酵→壳聚糖下胶→澄清过滤→灭菌→陈酿→灌装→成品[19].
PY01和Io的接种比例为1:1,种子液浓度分别为6×105、6×106CFU·mL-1,不同接种方式处理组编号见表1.

表1 2 种酵母菌接种方式及编号
1.3.2 水蜜桃酒部分理化指标、酵母菌发酵效率和活菌数量及β-葡萄糖苷酶的测定
还原糖含量采用DNS 法[20];酒精度采用爱尔兰Megazyme 公司乙醇测定试剂盒测定;pH 采用PHS-3C 型pH 计测定;总酸采用GB/T 12456-2008酸碱滴定法测定[21].酵母菌发酵效率的测定采用CO2失重法,每24 h 测定1 次,以发酵时间为横坐标,CO2释放量为纵坐标,绘制不同接种方式酵母菌发酵效率变化曲线.酵母菌活菌数量测定采用酵母菌平板计数法;β-葡萄糖苷酶活性采用北京Solarbio 科技有限公司β-GC 活性检测试剂盒测定.
1.3.3 水蜜桃果酒挥发性成分测定
前处理: 取5 mL 发酵水蜜桃果酒样品放入20 mL 顶空进样小瓶内,其气相部分(顶空)导入顶空进样装置连接的气相色谱.
GC-MS 分析-顶空进样以及定性定量分析参照杨海宁等[22]的方法.
1.3.4 感官评定
参照GB 15038-2006 和李华敏等[23]的评定方法并稍作修改;由12 位年龄在21~36 岁训练有素的感官品评员(6 名女性和6 名男性)分别从香气(花香、果香、乙醇香)、口感(甜度、酸度)、外观(酒体澄清度、色泽)等方面对水蜜桃酒进行综合评价打分.实验重复3 次,打分为10 分制,即0~3 为低强度,4~6 为中强度,7~10 为高强度.
1.3.5 数据处理
所有实验均重复3 次取平均值.对挥发性风味物质进行主成分分析,采用软件OrignPro 8.5 作图,SPSS 25.0 进行统计方差分析.
2 结果与分析
2.1 总糖、还原糖、乙醇以及pH 的分析
表2 列示了不同接种方式水蜜桃酒发酵结束后的部分理化指标.Io 参与发酵的酒精度含量明显低于PY01 单独发酵组;混菌发酵组中,PI2 酒精度最低,PI1 次之,这与Varela 等[24]报道中采用同时或顺序接种的混合发酵可有效降低乙醇含量的结果一致.同时PI2还原糖含量明显低于其他处理组,说明PI2顺序发酵方式能够在发酵过程中消耗更多的糖.每组间pH 和总酸含量差异不大,均符合2015 版果酒行业标准[25].

表2 5 种发酵酒样的部分理化指标
2.2 接种方式对酵母菌发酵效率的影响
酵母菌发酵过程中的主要产物有CO2,因此检测发酵过程中的CO2失重能够很好地反映其发酵效率.不同接种方式酵母菌发酵效率变化如图1 所示,由图可知,P1 组单独发酵失重最多,I1 组单独发酵失重最少,即PY01 发酵效率高于Io.非酿酒酵母前期生长较快,后期酿酒酵母较强的生存能力和对其他微生物的抑制能力逐渐发挥作用,生长速度加快[26],PI1 的趋势与此一致.PI2 由于Io 的存在前期上升缓慢,48 h 接种PY01 后迅速增长.
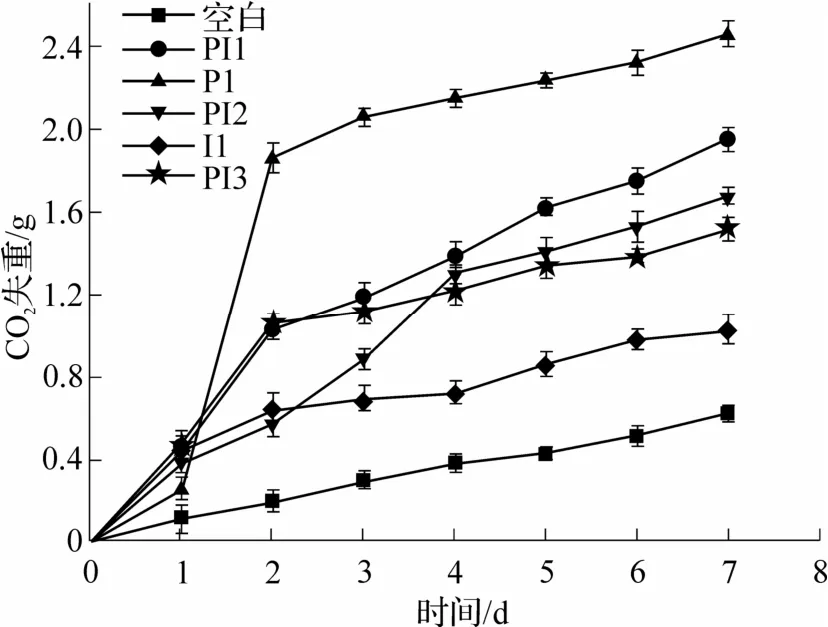
图1 接种方式对酵母菌发酵效率的影响
2.3 接种方式对酵母菌活菌数量的影响
接种方式对酵母菌活菌数影响如图2 所示.发酵初期,2 种菌均能适应发酵环境且迅速生长,单菌发酵中PY01 生长速率高于Io.由图2(a)可以看出,PI1-Io 组在第1 天生长到峰值后开始下降,5 d后平缓上升,这说明其前期生长受到了PY01 的阻碍.可能是受到Io 限制的原因,该组PY01 前期生长弱于PY01 单菌发酵,PY01 于第5 天达到峰值(8.1×107CFU·mL-1),而后逐渐趋于稳定.图2(b)表示2组顺序发酵酵母菌活菌数量变化,初期Io迅速生长到峰值(2.7×107CFU·mL-1),而接种PY01 后,由于受到其阻碍活菌数开始下降,PY01 迅速生长,与PI1 基本一致.PI3 接种Io 后趋势与PI2-Io 组相似.由上可知,酿酒酵母与非酿酒酵母同时存在时,易受其阻碍导致生长缓慢,而先接种非酿酒酵母后48 h 接种酿酒酵母能够有效缓解此现象,对果酒的风味多样性有积极贡献[27].
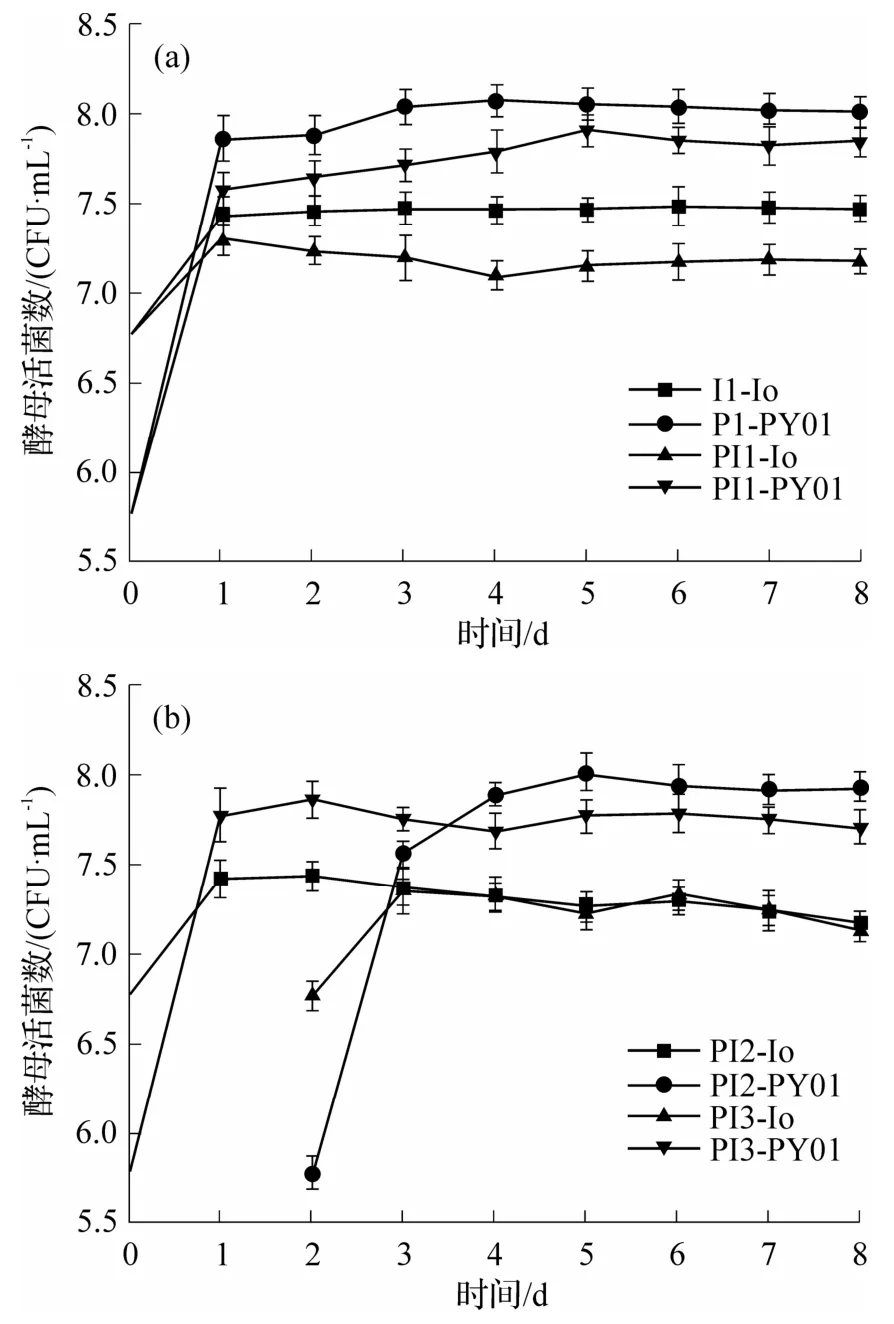
图2 接种方式对酵母菌活菌数量的影响
2.4 β-葡萄糖苷酶活性分析
由图3 可知,在整个发酵过程中,β-葡萄糖苷酶活力先升后降,第1 周几组上升趋势差异小.单菌发酵组酶活力较低,PI2 组β-葡萄糖苷酶活力于第2 周上升至峰值10.34 U·L-1,高于其他处理组,说明混菌发酵能够促进β-葡萄糖苷酶的增长,其中先接种Io 48 h后接种PY01 更有利于β-葡萄糖苷酶的积累.高β-葡萄糖苷酶活性能够有效促进香气化合物的释放[28],混合发酵体系的高糖苷酶活性有利于增加葡萄酒的品种香和香气复杂度.
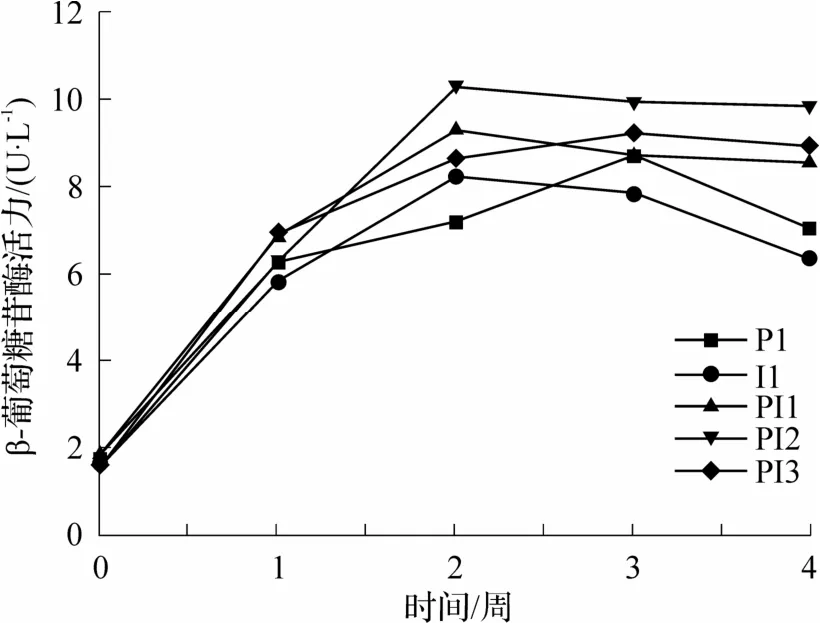
图3 接种方式对水蜜桃酒β-葡萄糖苷酶活力的影响
2.5 接种方式对发酵水蜜桃酒挥发性风味物质产生的影响
果酒中风味物质的组成及其含量显著影响酒的品质,同时也会影响消费者的购买欲[29].采用GC-MS 对不同接种方式发酵水蜜桃酒挥发性风味物质进行测定,结果见表3.通过对不同接种方式发酵水蜜桃酒部分挥发性物质的聚类分析,混菌发酵的3 组风味物质有一定的相似性,但PI2 的物质浓度略高,单菌发酵组风味相似性较低.
由表3 可知,5 种不同接种方式发酵后得到的水蜜桃酒共检出64 种挥发性风味物质,其中酯类42 种、醇类5 种、酸类7 种、醛酮类3 种和其他类7 种,贡献显著的特征香气成分为癸酸乙酯、乙酸乙酯和苯乙醇等.
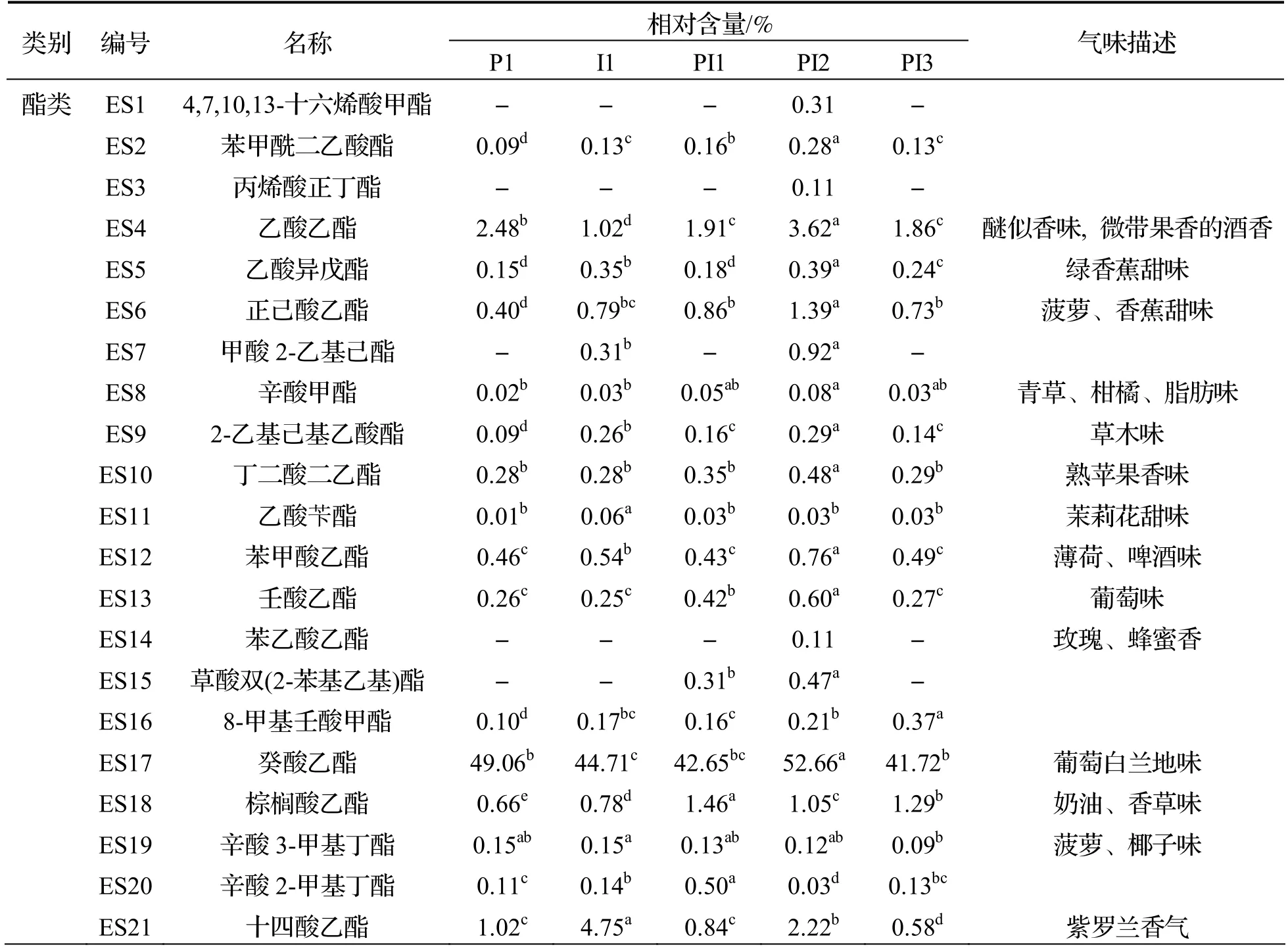
表3 不同接种方式发酵水蜜桃酒部分挥发性风味物质相对含量
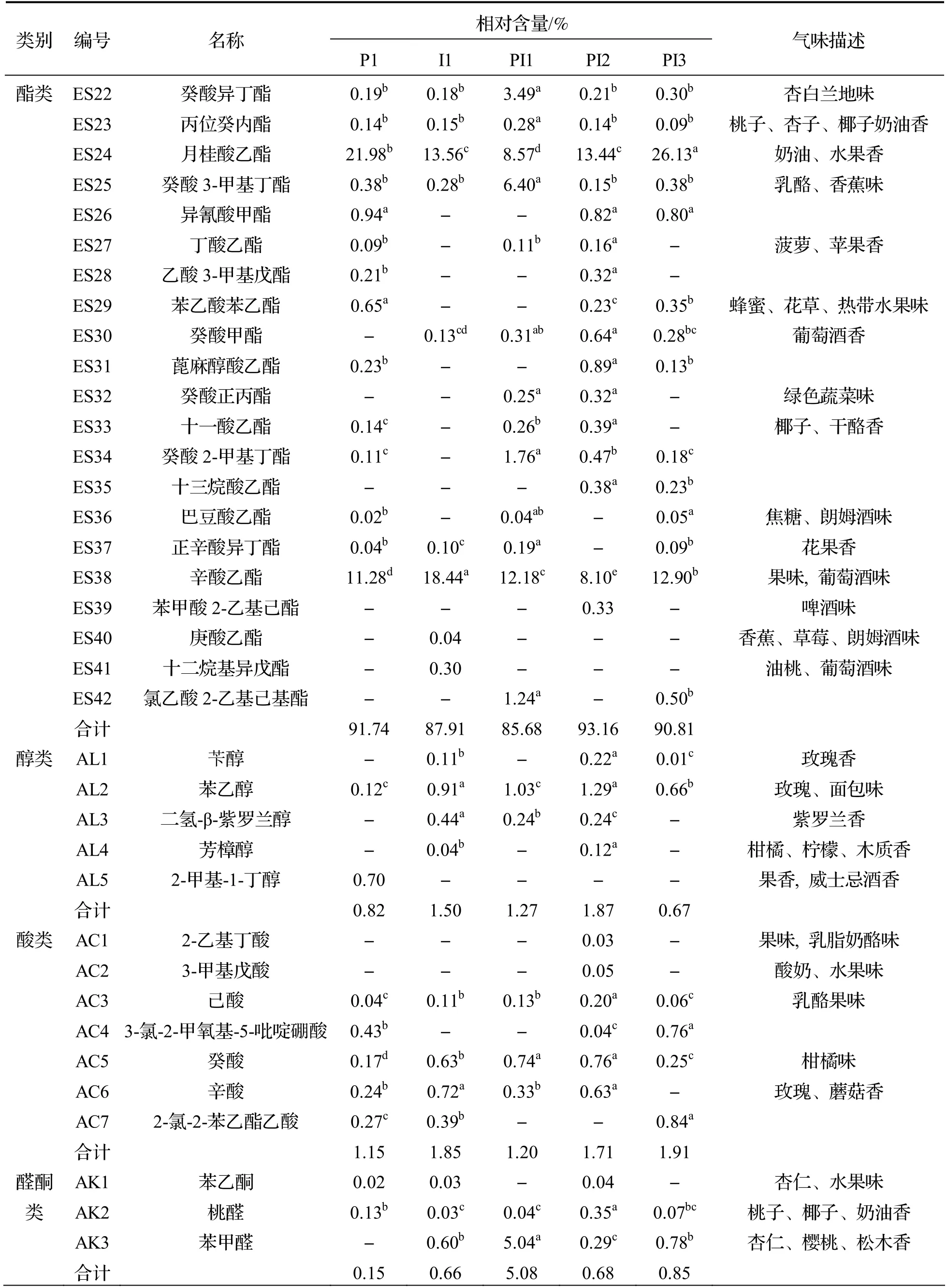
续表
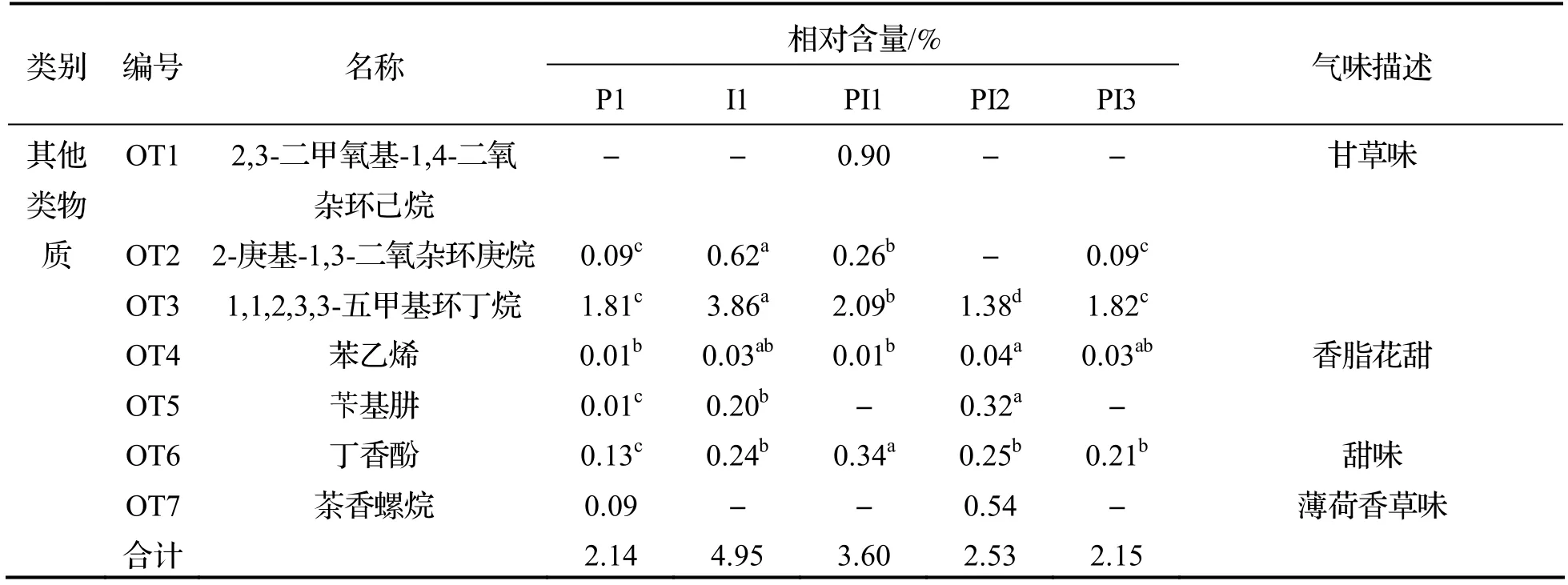
续表
酯类物质由酵母菌在乙醇发酵过程中催化高级醇和脂而形成[30],是水蜜桃酒中种类最多的香气物质,对香气特征起决定性作用.混菌发酵有效增加了酯类物质的种类及含量,PI1 组中酯类物质种类及相对含量较低,PI2 组的酯类物质种类及相对含量最高,达到了93.16%,这主要归因于癸酸乙酯、月桂酸乙酯以及乙酸乙酯的贡献,这与文献报道中采用顺序接种发酵玫瑰葡萄酒增加酒体酯类物质含量的研究结果一致[31].
醇类物质是乙醇发酵期间的副产物,当其在含量较低的情况下,能够有效增加酒体的复杂性,然而含量高时,会对酒体香气有消极影响[32].PI2组苯乙醇的相对含量最高.苯乙醇不仅能够赋予酒体玫瑰花香,还能作为其他易挥发风味物质的溶剂[33],丰富酒体层次.酸类物质能赋予水蜜桃酒果香,各组间酸类及醛酮类物质相对含量差异不大.其中,2-乙基丁酸、3-甲基戊酸为PI2 组所特有,赋予酒体新鲜水果味.醛类物质在微生物作用下易被还原为酸类[34],故含量较少.结果表明,在Io发酵后48 h 接种PY01 顺序发酵能有效增加挥发性风味物质对酒体的积极影响.
2.6 多元统计分析
为了更直观地分析不同接种方式发酵酒体呈香物质的差异性,对各组挥发性风味物质相对含量进行主成分分析[35],得到主成分特征值、贡献率、得分图、载荷图(表4 和图4).由表4 可知,主成分1、2 的贡献率分别为51.1%和32.2%,累积贡献率83.3%,说明前2 个主成分能够有效解释变量信息.

表4 主成分特征值及贡献率
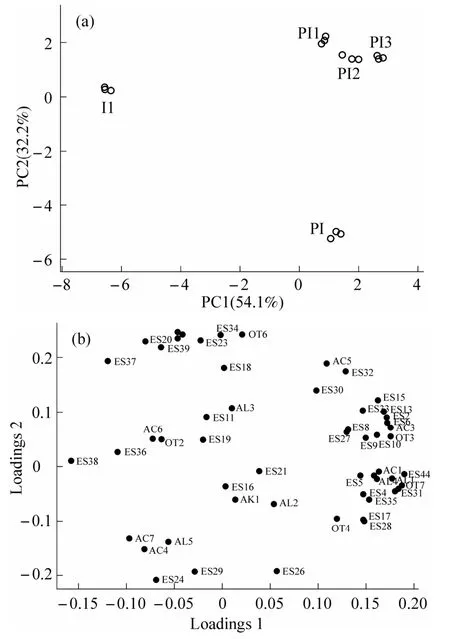
图4 不同接种方式发酵水蜜桃酒PCA 得分(a)和载荷(b)
从图4(a)可以观察到,混菌发酵组位于同一象限,且距离近,说明其风味特征等也较为接近,但其与单菌发酵组距离较远,而且2 组单菌发酵组也位于不同象限,而且2 组单菌发酵组也各自位于不同象限,其风味特征差异较大,这与聚类分析结果一致.P1 在第一成分上得分与PI2 较为接近,可能是因为PI2 前期Io 消耗较快,48 h 后接种的PY01后期起主导作用.
载荷系数的大小反映了初始变量(各挥发性风味物质)与主成分之间的相关性,主成分对该变量的代表性强弱与载荷系数呈正相关[36].从载荷图4(b)可以看出,第一主成分与大部分酯类物质和苯乙醇呈正相关,与辛酸和巴豆酸乙酯等则呈负相关.第二主成分与桃醛和棕榈酸乙酯等正相关,与苯乙醇和苯乙烯等其他类物质负相关.有些挥发性风味物质的数量变化在主成分分析分离中没有主要影响或贡献,因此在载荷图中未观察到.PI2组在第一、第二主成分上得分都较高,说明该组发酵后呈香物质含量较高.综合图4(a)可以说明,接种Io 48 h后接种PY01 能够有效改善水蜜桃酒品质风味单一的问题.
为进一步确定对风味贡献较大的物质,可生成一个变量投影重要性(Variable Important for the Projection,VIP)评分图[37],由此来量化每个变量对分类的贡献,通常VIP 值越大,变量在不同组间差异就越显著.计算得出,VIP>1 的有11 种挥发性风味物质,其中十四酸乙酯、辛酸甲酯、乙酸乙酯、壬酸乙酯的VIP 值都超过了1.4,是区分不同处理组香气特征的主要成分.而且在PI2 组中的这些物质含量都较高,说明该组香气特征比其他处理组突出.
2.7 感官评定结果
从香气、口感、外观对不同接种方式发酵水蜜桃酒进行感官评分(图5).在澄清度色泽方面,几组差异不大.因为混菌发酵能够产生更高含量的酒精,所以混菌发酵组乙醇香和花香都高于单菌组.混菌发酵中,PI2 酯类物质含量较高,故该组果香得分最高,但该组发酵过程中消耗了更多的糖,导致甜度得分较低.Io 发酵主要带来的是果味和酸度,故I1 组酸度高.综合感官分析可知,在整体上PI2组表现最优,即接种非酿酒酵母Io 后48 h 接种酿酒酵母PY01 能够有效丰富酒体的果香、花香,从而增加水蜜桃酒风味的复杂性和协调性.
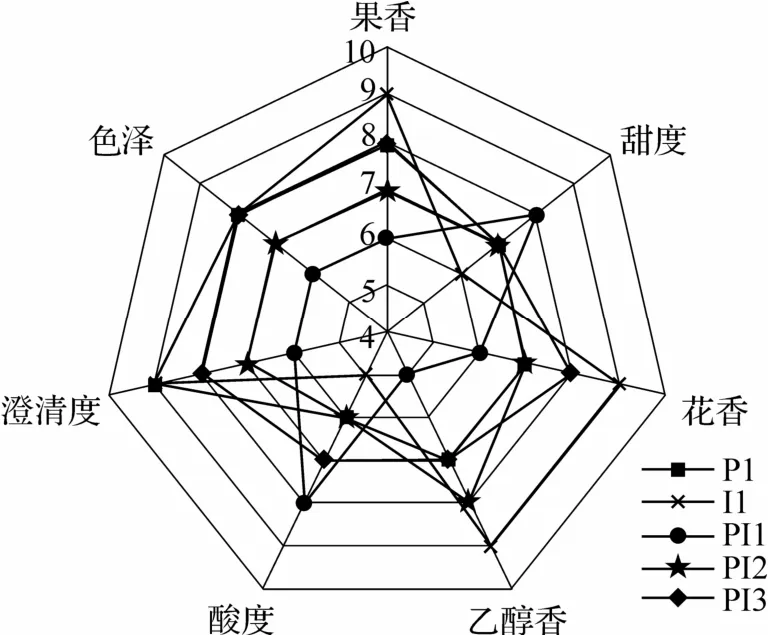
图5 不同接种方式发酵水蜜桃酒感官评分图
3 结论
选用酿酒酵母PY01 结合非酿酒酵母东方伊萨酵母Io 进行混合发酵研究表明,各组间pH 及总酸无太大差别,Io 的参与降低了水蜜桃酒的酒精度,先接种非酿酒酵母48 h 再接种酿酒酵母酒精度和还原糖最低,β-葡萄糖苷酶活性最高.混菌发酵组挥发性风味物质种类高于单菌发酵组,且先接种非酿酒酵母48 h 后接种酿酒酵母组挥发性风味物质种类最多,该组酯类物质种类(37 种)及相对含量(93.16%)也最高.该复合菌接种方式有效增加了水蜜桃酒中的癸酸乙酯、月桂酸乙酯、乙酸乙酯以及苯乙醇等物质相对含量,赋予酒体浓郁的奶油、水果香气、葡萄白兰地香韵,丰富了水蜜桃酒香气层次.主成分和感官分析表明,先接种非酿酒酵母48h 后接种酿酒酵母组香气特点最为明显,综合感官得分最高.综上所述,东方伊萨酵母Io和酿酒酵母PY01 混菌发酵能够产生更多的香气物质,而且优先接种Io 后48 h 接种PY01 发酵组能够更大程度地发挥2 种菌的生长优势,有利于β-葡萄糖苷酶的积累,更大程度上促进水蜜桃酒挥发性风味物质的释放,增加酯类物质对水蜜桃酒香气的积极影响,发酵完成后的酒体香气更为浓郁,有利于提升水蜜桃酒品质.本研究优先接种东方伊萨酵母Io 后48h 接种酿酒酵母PY01 发酵水蜜桃酒取得良好的效果,为提升水蜜桃果酒品质提供了理论依据.

