台湾泥鳅消化道的形态及组织学结构特征
刘 钊 ,刘 洋 ,郭 浪 ,郑学斌 ,冯彬彬 ,王红波 ,石叶忠,竺俊全
(1.宁波大学 教育部应用海洋生物技术重点实验室,浙江 宁波 315832;2.新昌县养殖业技术推广中心,浙江 绍兴 312500;3.宁波市鄞州环亚水产养殖有限公司,浙江 宁波 315100)
消化道是鱼类消化食物、吸收营养的重要部位.鱼类消化道生物学研究主要集中在形态学、组织学及组织化学等方面,研究鱼类消化道生物学有利于探明鱼类摄食及消化吸收的相关生理机制.
目前,淡水鱼类香鱼(Plecoglossus altivelis)[1]、虹鳟(Oncorhynchus mykiss)[2]、光唇鱼(Acrossocheilus fasciatus)[3]、兰州鲇(Silurus lanzhouensis)[4]、马口鱼(Opsariichthys bidens)[5]、花斑裸鲤(Gymnocypris eckloni)[6]等的消化道组织形态学研究已有报道.在淡水鳅科鱼类消化道形态结构及其组织学的研究报道中已见有中华沙鳅(Botia superciliaris)[7]、宽体沙鳅(Sinibotia reevesae)[8]等种类.
台湾泥鳅(Paramisgumus dabryanusssp.)属鲤形目(Cypriniformes)、鳅科(Cobitidae),具有个体大、生长快、抗病力强、养殖产量高、不钻泥易捕捞、雌雄生长差异小、商品鳅规格整齐等优点,而且其肉质细嫩、营养丰富、味道鲜美,因此深受养殖业者及消费者喜爱.已有有关养殖台湾泥鳅的研究主要涉及外部形态[9-10]、人工繁殖[11-12]和生长特性[13]等方面,对其消化道形态结构及组织化学的研究未见详细报道.目前,鱼类消化道的研究主要集中在形态学和组织学方面,对其黏液细胞性质及分布的研究相对较少.鱼类黏液细胞普遍存在于鱼类体表、鳃及消化道内,是一种腺体细胞,对鱼类的免疫及消化系统具有重要的生理作用,将黏液细胞和组织形态结构相结合进行研究更能系统反映鱼类消化道的结构特点.
本研究采用活体解剖、石蜡切片及爱先蓝-糖原(AB-PAS)染色技术研究台湾泥鳅消化道的形态、组织学结构及其黏液细胞的分布,旨在了解台湾泥鳅消化道的结构及功能特点,为探明其消化生理机制积累资料,也为养殖台湾泥鳅提供参考.
1 材料与方法
1.1 实验材料
实验所用台湾泥鳅成鱼30 尾,由宁波市鄞州环亚水产养殖有限公司提供,平均体长(17.01±0.55)cm,平均体质量(33.01±3.74)g.
1.2 实验方法
1.2.1 解剖观察
用毛巾擦干鱼体表面水分,测量其体长及体质量.活体解剖观察其消化系统组成及外部形态特征,测定其体长、体质量、肠长等指标.
1.2.2 组织切片观察
取台湾泥鳅消化道(舌、口咽腔、食道、前肠、中肠、后肠等)部分组织,切成小块或小段,在波恩氏液(Bouin’s)中固定24 h,经酒精梯度脱水、二甲苯透明、石蜡包埋后采用YD-202 型切片机(浙江聚能仪器设备有限公司)连续切片,切片厚度6~8 μm,切片经H·E 染色、中性树胶封片后用DS-Ri2 型尼康显微镜(上海洛歆光电有限公司)观察与摄像.
1.2.3 AB-PAS 染色与黏液细胞观察
采用AB-PAS 染色技术染色,中性树胶封片,统计消化道中黏液细胞种类及分布情况.根据黏液细胞中含有黏多糖种类(中性黏多糖、酸性黏多糖)和含量的不同,将黏液细胞分为I 型黏液细胞(只含中性黏多糖)、II 型黏液细胞(只含酸性黏多糖)、III 型黏液细胞(含大量中性黏多糖及少量酸性黏多糖)、IV 型黏液细胞(含大量酸性黏多糖及少量中性黏多糖).I 型黏液细胞与AB 反应为阴性,与PAS 反应为阳性,染色后呈红色;II 型黏液细胞与AB 反应为阳性,与PAS 反应为阴性,染色后呈蓝色;III 型黏液细胞与AB 及PAS 反应均为阳性,染色后呈紫红色;IV 型黏液细胞与AB 及PAS 反应均为阳性,染色后呈蓝紫色[14].在显微镜下对各组织中的黏液细胞类型及数量进行统计,每张切片随机选取6 个视野(每个视野范围1 000 μm×1 000 μm)进行观察统计,每个组织分别取3 张切片.
1.3 数据处理
采用Photoshop CS5 软件测定消化道各段黏膜皱褶的高度、黏膜下层厚度、环肌层和纵肌层厚度.采用SPSS 25.0 软件统计分析体长、体质量、肠长和黏液细胞数量等,结果用平均值±标准差表示.
2 结果
2.1 消化系统组成及形态特征
台湾泥鳅消化系统由消化道和消化腺组成.消化道由口咽腔(舌)、食道和肠道组成.舌短小、食道粗短且壁厚.肠道无盘曲、直形,可分为前、中、后肠.前肠较粗且中央略膨大;中肠肠径小于前肠;后肠肠径最小,末端以肛门开口于体外.消化腺为肝胰脏,包裹在肠道前端膨大部分;胆囊椭球形,位于肝胰脏之间,与前肠系膜相连(图1).实验测得30 尾台湾泥鳅的肠指数(肠长与体长比)为0.50±0.04.
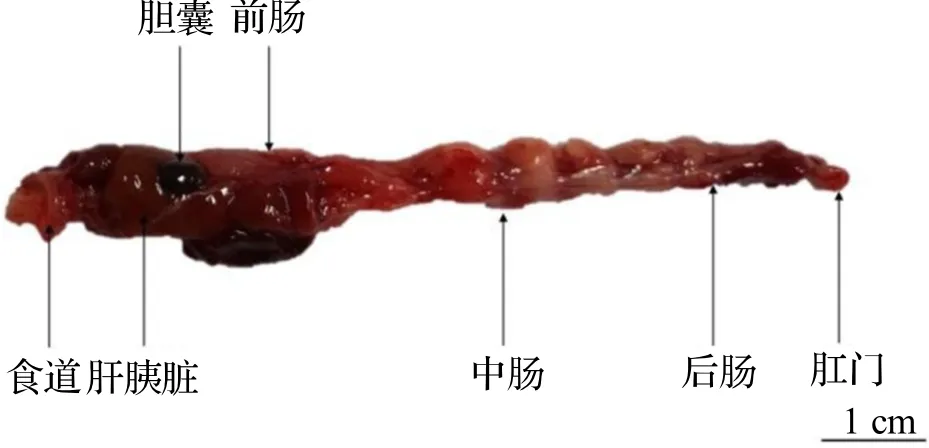
图1 台湾泥鳅消化系统解剖图
2.2 消化道组织学结构特征
2.2.1 口咽腔
口咽腔黏膜层上皮为复层扁平上皮,含较多杯状细胞,味蕾明显可见(图2(a)和(b)),味蕾的味孔开口于黏膜层表面,上皮之下为固有膜,由致密结缔组织构成(图2(c)).固有膜下的黏膜下层为疏松结缔组织(图2(b)和(c)).
2.2.2 食道
食道壁由黏膜层、黏膜下层、肌层以及浆膜构成.黏膜层向腔内突起形成许多纵行皱襞(图2(d)),黏膜层上皮为复层扁平上皮,上皮细胞间散布较多杯状细胞(黏液细胞)(图2(f)).上皮之下为固有膜,由结缔组织构成.固有膜下为黏膜下层,亦为结缔组织(图2(e)).肌层很厚,为横纹肌,包括内环肌和外纵肌,环肌较纵肌发达.最外层为浆膜(图2(e)).
2.2.3 肠道
肠道由黏膜层、黏膜下层、肌层和浆膜构成.黏膜层由上皮层和固有膜构成,黏膜层突起形成许多纵行皱襞,称肠绒毛.前、中、后肠黏膜层上皮均为单层柱状上皮,上皮细胞间均含有杯状细胞.肠道的肌层都由内环肌和外纵肌构成,为平滑肌.肠道最外层为浆膜,由疏松结缔组织和一层间皮构成.
前肠: 黏膜皱襞发达,肠绒毛高且间隔小,占据肠腔的大部分空间,肠绒毛上部有较多分支(图3(a)).黏膜层的柱状上皮细胞间散布较多杯状细胞,上皮细胞游离面纹状缘发达(图3(c)).上皮之下为固有膜,固有膜之下为黏膜下层,两者都由结缔组织构成,含血管(图3(b)和(c)).肌层较厚,内环肌较外纵肌厚.最外层浆膜薄(图3(b)).消化道各部分组织形态学参数测定见表1.
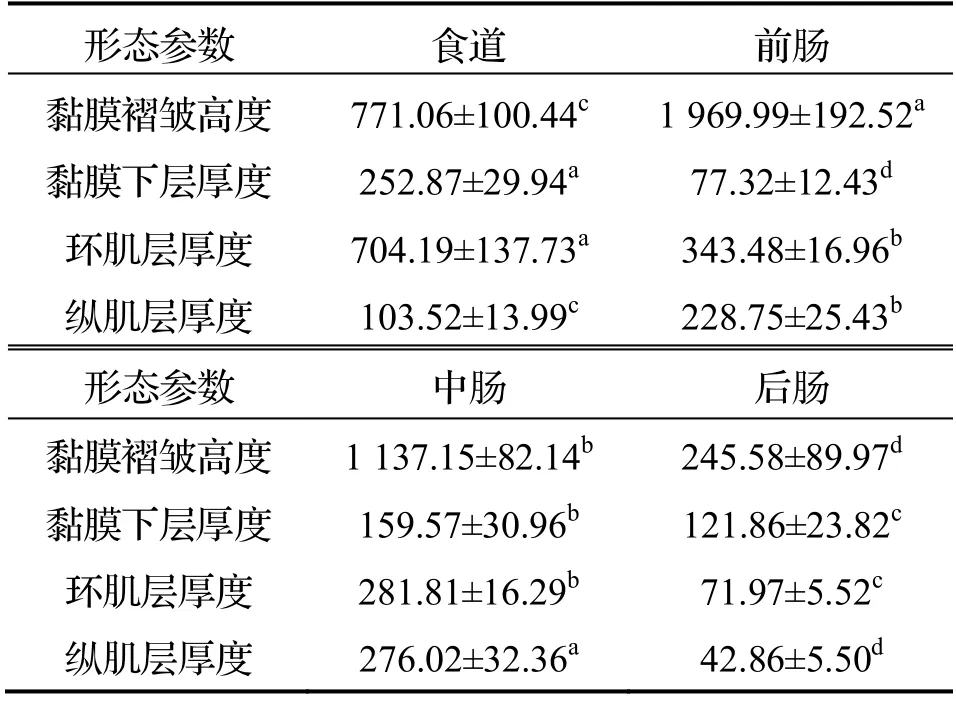
表1 台湾泥鳅消化道组织形态学参数 µm
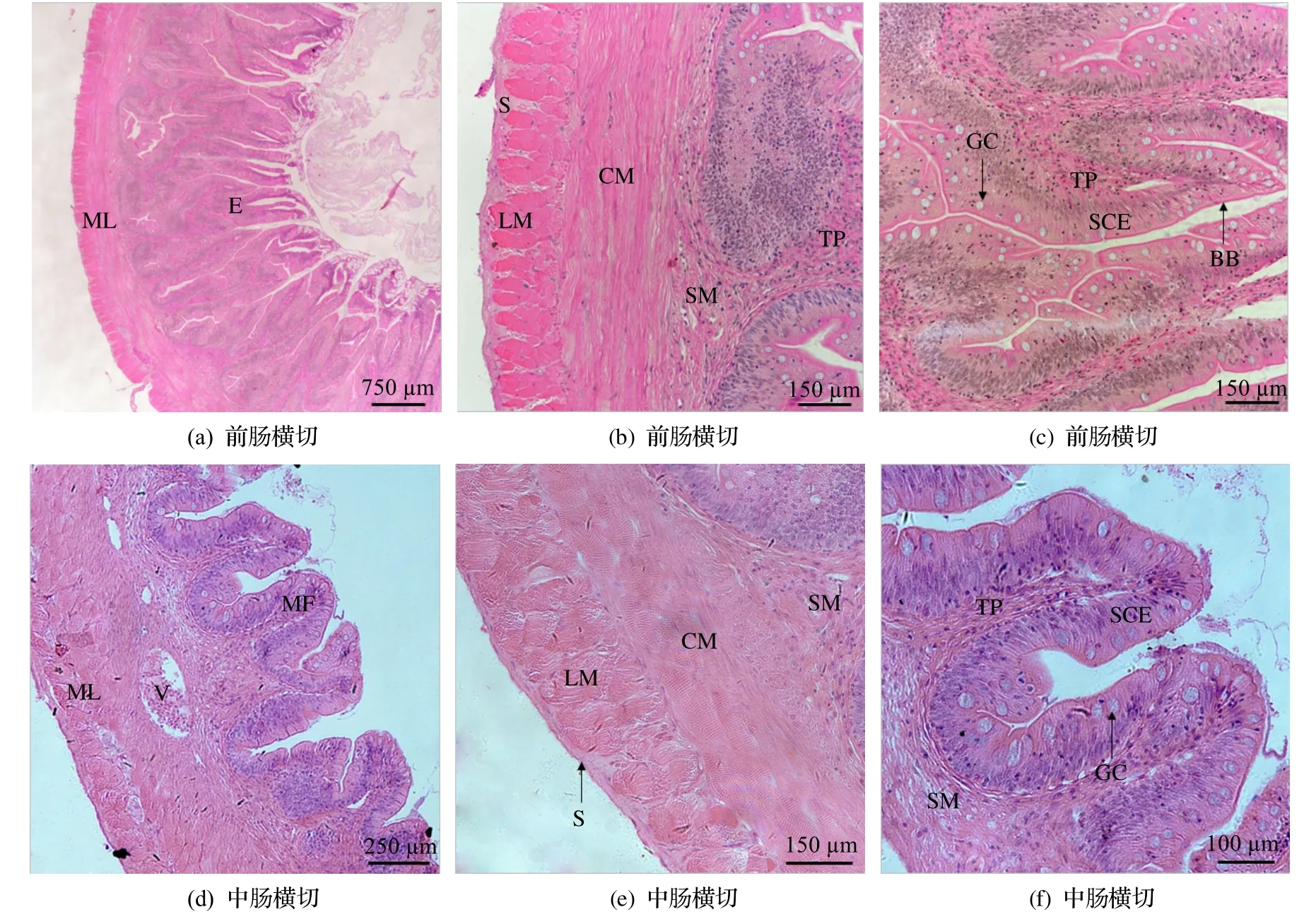
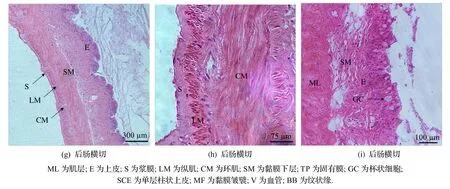
图3 台湾泥鳅肠道组织学结构
中肠: 黏膜皱襞发达程度不及前肠,肠绒毛比前肠低、比后肠高,相邻肠绒毛间隔一定距离(图3(d)).上皮中有较多杯状细胞,纹状缘较发达(图3(e)).固有膜及黏膜下层由结缔组织构成,分布有血管(图3(e)和(f)).肌层较厚,由内环肌和外纵肌构成,且两者厚度接近.浆膜层薄(图3(e)).
后肠: 黏膜皱襞不发达(图3(g)).肠绒毛低矮,但黏膜层上皮中仍有较多杯状细胞(图3(h)).黏膜层上皮之下为固有膜结缔组织,固有膜之下为黏膜下层,由疏松结缔组织构成.肌层厚度明显低于前肠和中肠,由内层环肌与外层纵肌构成,环肌层比纵肌层厚.最外层为一薄层浆膜(图3(h)).
2.3 消化道黏液细胞类型及分布
台湾泥鳅肠道中各种类型黏液细胞分布情况见表2.
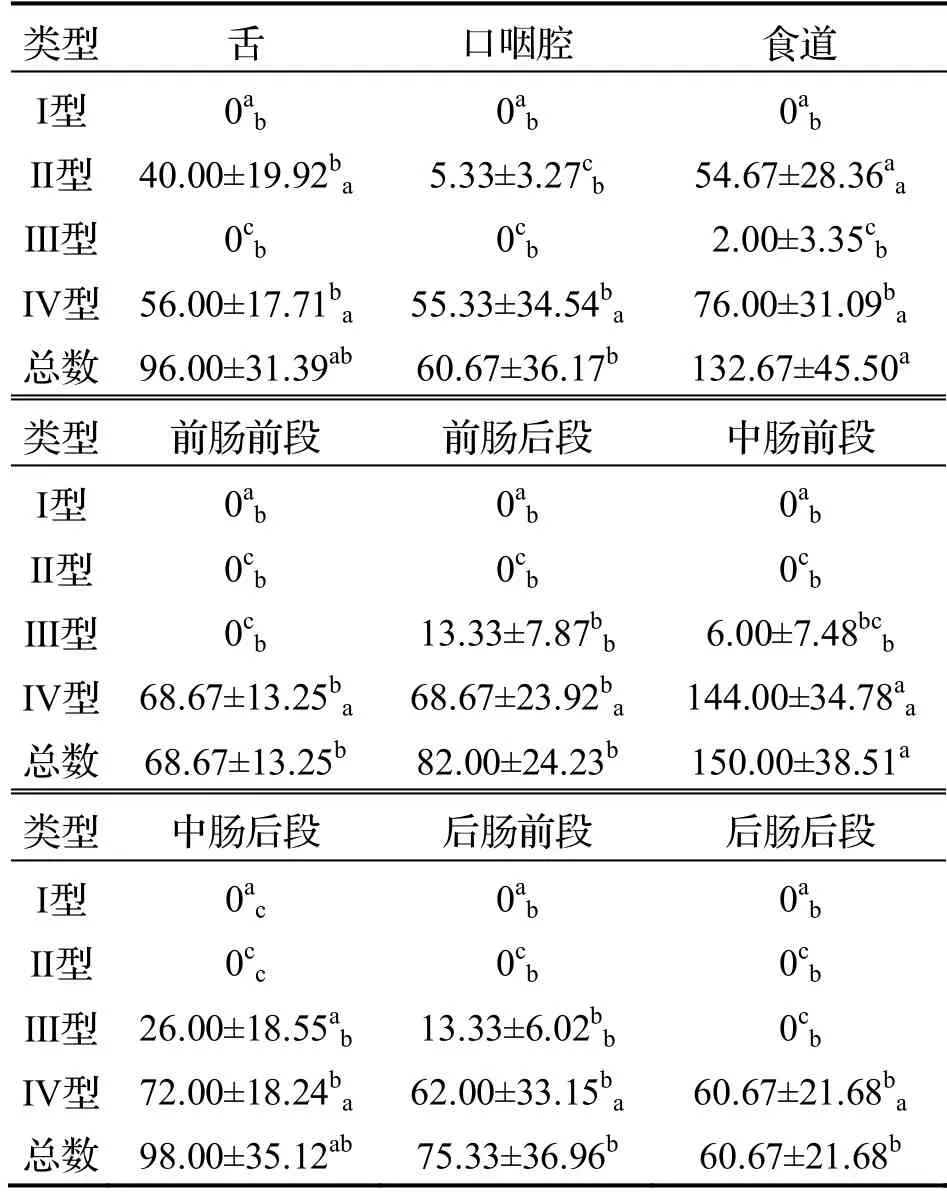
表2 台湾泥鳅消化道黏液细胞类型及分布 个·mm-2
台湾泥鳅消化道分布有II 型、Ⅲ型及IV 型黏液细胞,I型黏液细胞未观察到,其中前肠前段和后肠后段只发现IV 型黏液细胞.舌上黏膜层分布有II 型及IV 型黏液细胞,IV 型黏液细胞的分布密度大于II 型(图4(a)~(c)).口咽腔上皮分布有II 型和IV型黏液细胞,以IV型黏液细胞为主(图4(d)~(f)).食道中黏膜上皮中分布有Ⅱ型、Ⅲ型和IV 型黏液细胞,其中II 型及IV 型黏液细胞的分布密度较高,而Ⅲ型黏液细胞的分布密度较低(图4(g)~(i)).肠道各段黏膜皱襞的上皮层中,前、中、后肠黏膜上皮分布有Ⅲ型及IV 型黏液细胞,以IV 型为主,Ⅲ型分布密度低.前肠前段只见IV 型黏液细胞分布,前肠后段至后肠前段均分布有Ⅲ型和IV 型黏液细胞,而后肠后段未见Ⅲ型黏液细胞分布(图5).
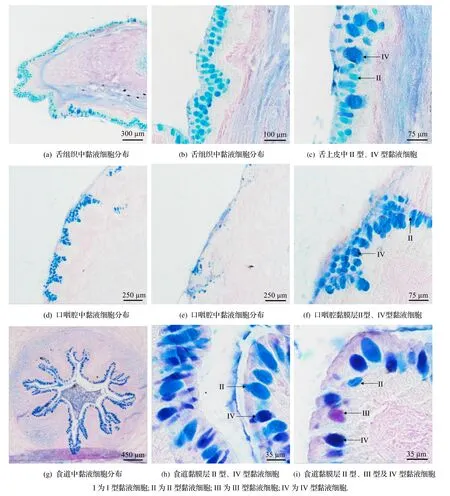
图4 台湾泥鳅舌、口咽腔、食道中各型黏液细胞分布
3 讨论
台湾泥鳅口咽腔黏膜被覆复层扁平上皮,黏膜层含较多黏液细胞及味蕾,舌上皮和口咽腔上皮中分布有Ⅱ型和Ⅳ型黏液细胞,可以分泌较多酸性黏液物质,具有润滑以及避免微生物感染的功能[15].鱼类口腔中的味蕾能感知和分辨不同种食物,而位于咽部的味蕾可以触动鱼类的吞咽活动反射[16],台湾泥鳅口咽腔中的味蕾能起到分辨和选择食物的作用.
台湾泥鳅食道很短,只占消化道长度的极小部分(约1/15),上皮中含有大量Ⅱ型、Ⅳ型黏液细胞和少量Ⅲ型黏液细胞,Ⅱ型和Ⅳ型黏液细胞主要分泌酸性黏液物质,其不仅可润滑通过食道的食物,同时有抗菌及保护黏膜作用[17].食道肌层非常发达,由横纹肌构成,横纹肌的伸缩运动能有效地将食物挤压、碾碎,并推动食物进入肠道,在此过程中杯状细胞分泌黏液起协同作用[18].
孟庆闻等[19]研究认为鳅科鱼类中只有条鳅属(Nemacheilus)具有典型的胃.中华刺鳅(Sinobdella sinensis)有一个呈现“V”字形的胃[20].细鳞泥鳅(Misgurnus mizolepis)的肠道稍长于其体腔长度,且无胃[21].黄飞等[22]观察到匀斑裸胸鳝(Gymnothorax reevesii)消化道黏膜层中具有管状胃腺,故推断其为有胃鱼类.本研究发现,台湾泥鳅的食道之后即为肠道,肠道是一条无盘曲的管道.前肠膨大,食物的容纳量最大,可以起到近似胃的作用,但组织学结果显示,台湾泥鳅消化道各段各层中均未发现胃腺组织,属无胃鱼类.台湾泥鳅虽然无胃,但不影响其正常的消化吸收功能[23].
鱼类的肠道长度是消化道形态学测量的重要指标之一,肠指数是推测鱼类食性的重要参数.通常肉食性鱼类的肠道比杂食性和草食性鱼类的肠道短[24].张杏波等[25]发现,一般草食性鱼类的肠指数大于2,而肉食性鱼类的肠指数小于2/3.而本研究测量得出台湾泥鳅的肠指数为0.50±0.04,与肉食性鱼类的肠指数相似,但实际上台湾泥鳅属杂食性鱼类.经比较发现,台湾泥鳅的肠指数与泥鳅、大鳞副泥鳅等鳅科鱼类相近(肠指数均小于2/3),但却是杂食性为主,说明肠指数低于2/3 的鱼类并非都为肉食性鱼类.在异尾高原鳅、西藏高原鳅等鱼类中,其较低的肠指数与它们肉食性相符;而西昌华吸鳅和峨眉后平鳅的肠指数均大于1,也与它们杂食性相符(表3).
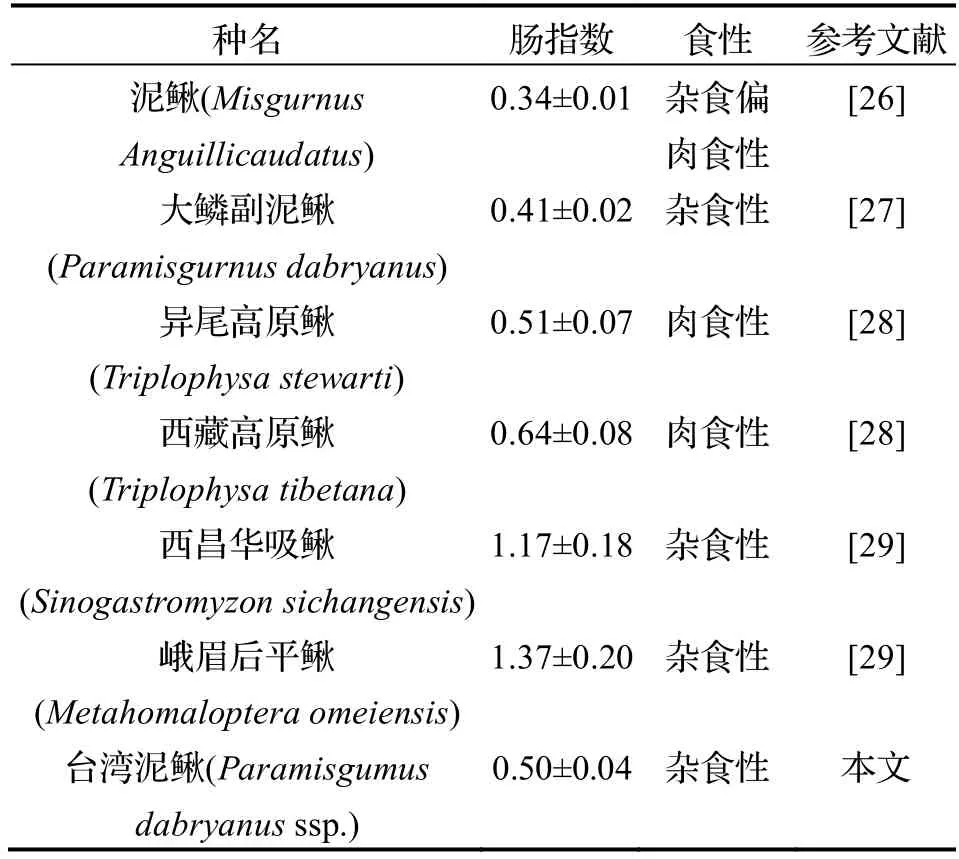
表3 部分鳅科、平鳍鳅科鱼类肠指数与食性的关系
关于无胃鱼类的肠道分段,林浩然[30]认为鱼类食道之后的消化道统称肠道,无需进行分段;陈国华等[31]根据波纹唇鱼(Cheilinus undulates)肠道的回折、鲍氏瓣的位置以及组织学特征,将肠道分为小肠前部、小肠后部和直肠;罗江波等[3]以光唇鱼(Acrossocheilus fasciatus)肠道的第一个和最后一个回折为界,将其划分为前、中、后肠三部分;BoČina等[23]根据雀鳝(Belone belone)肠道黏膜层中黏液细胞类型的不同,将肠道分为前、后两部分.本研究通过组织学观察发现,台湾泥鳅的肠道前段最粗,肠腔内黏膜皱襞最密集、最高;肠道中段比前肠细,黏膜皱襞高度下降、数量变少;肠道后段最细,黏膜皱襞最低矮,大多不形成指状结构.肠道前、中、后三段间的组织学结构差异较大,因此可将台湾泥鳅的肠道分为前肠、中肠和后肠三部分.台湾泥鳅肠道黏膜皱襞高度由前往后明显呈下降趋势,与西昌华吸鳅、峨眉后平鳅[29]、贝氏高原鳅(Triplophysa bleekeri)[32]等类似,而与皇冠沙鳅(Chromobotia macracanthus)[33]等不同.
台湾泥鳅前肠最为膨大,其黏膜皱襞和纹状缘最为发达,并且占据了肠腔的大部分空间,有效扩大了消化吸收面积,表明前肠具有强大的消化吸收功能.前肠前段仅分布有Ⅳ型黏液细胞,前肠后段开始出现Ⅲ型黏液细胞,中肠及后肠前段均分布有Ⅲ型和Ⅳ型2 种黏液细胞,后肠后段Ⅲ型黏液细胞消失.前肠前段黏液细胞与食道类似,能分泌较多的酸性黏液物质,食物经过食道和肠道前端时可被酸性黏液物质软化以便后续消化[34].软化后的食物进入前肠后段,前肠后段、中肠至后肠前段除了含有大量Ⅳ型黏液细胞外还分布有一定数量的Ⅲ型黏液细胞.Ⅲ型黏液细胞是一种中性黏液细胞,其在肠道内可与碱性磷酸酶共存,从而起到消化食物的作用,同时其分泌的中性黏液物质可以在一定程度上中和肠道内其他细胞分泌的酸性物质,以此保护肠道上皮免受损伤.据研究[35],某些鱼类肠道的Ⅲ型黏液细胞对短时间的饥饿胁迫后恢复进食具有较强的敏感性.食物到达后肠后段时,消化吸收作用基本完成,后肠后段仅有的Ⅳ型黏液细胞分泌大量酸性黏液物质,这不仅有助于台湾泥鳅排出未被消化完全的食物残渣和粪便,还能阻止外界环境中细菌等病原微生物从肛门入侵.另有研究报道[36],肠道末端分泌的酸性黏液与泥鳅肠道的辅助性气呼吸作用有关.
4 结语
台湾泥鳅属无胃杂食性鱼类.口咽腔及舌上皮具有较好的耐磨性,在食物的选择和甄别方面发挥重要作用.食道粗短,主要起吞咽食物作用.肠道较短,但在食物的消化吸收方面发挥重要作用.消化道中含有丰富的黏液细胞,有助于润滑食物,发挥抗菌及消化吸收作用.台湾泥鳅消化道各部的形态、组织学结构特点及黏液细胞分布特征与其功能相适应.

