隐丹参酮对肝癌细胞凋亡和内质网应激的影响
王贞丽,王晓雯,付晓菁,张海霞,赵文文,陈雪红
(1 中国人民解放军海军青岛特勤疗养中心质量管理科,山东 青岛 266071;2 青岛市食品药品检验研究院; 3 青岛大学基础医学院医学药理学系; 4 淄博市第一医院)
肝癌是一种常见的恶性肿瘤[1]。目前常用的肝癌化疗药物5-氟尿嘧啶和铂类(顺铂)经过多年临床应用证实存在大量的副作用和不良反应。目前针对肝癌治疗的化学药物和新的靶向药物的研究层出不穷,但化疗药物耐药性和预后不良的弊端仍然存在。近年来,中医药以其疗效显著、副作用小、原料经济方便等特点,受到世界各国的高度关注[2]。因此,寻求疗效优越、不良反应小的中药是肝癌治疗的潜在方向。丹参作为一种中药,广泛应用于动脉粥样硬化、阿尔茨海默病、高脂血症、肝纤维化、慢性肾衰竭和妇科疾病等多种疾病的治疗,无严重副作用[3]。丹参的水溶性成分具有良好活性,随着研究的深入,发现其脂溶性成分也具有抗结直肠癌、前列腺癌和肺癌等肿瘤的作用[4-5]。隐丹参酮(CPT)是丹参的主要脂溶性提取物。有研究表明,CPT对多种类型的癌细胞有直接的细胞毒性作用[6-8]。本研究旨在探讨CPT对肝癌细胞凋亡和目前报道较多的内质网应激的影响。
1 材料与方法
1.1 实验材料
CPT(晨光生物,中国陕西);RPMI 1640(基诺,中国江苏);胎牛血清(Biological Industrie,以色列);乳酸脱氢酶(LDH)细胞毒性检测试剂盒(碧云天,中国上海);内质网应激抗体试剂盒、cleaved caspase3、caspase3(CST,美国);MTT细胞增殖及细胞毒性检测试剂盒、PBS缓冲液、衣霉素(索莱宝,中国北京);Annexin V FITC-PI凋亡试剂盒(BD,美国)。
1.2 实验方法
1.2.1细胞培养 肝癌HepG2细胞(来源于青岛大学基础医学院细胞冻存库)用含体积分数0.10胎牛血清和青霉素/链霉素溶液的RPMI 1640培养液,在37 ℃、含体积分数0.05 CO2的无菌培养箱中培养。
1.2.2MTT法检测细胞活性 将HepG2细胞接种于96孔板中,12 h后加CPT处理,加药浓度分别为0、1、5、10、15和30 μmol/L。CPT处理48 h后,加入MTT溶液,继续培养3 h后加入Formazan溶解液,用酶标仪检测570 nm波长处每孔吸光度。
1.2.3LDH释放法检测细胞毒性 HepG2细胞加CPT处理(其浓度分别为0、1和15 μmol/L),作用48 h后检测LDH释放量,用酶标仪检测490 nm波长处每孔吸光度。
1.2.4细胞划痕实验 将HepG2细胞接种于背面画好横线的6孔板中,培养12 h后用枪头垂直于直线划痕,以PBS清洗,加CPT处理(CPT用无血清培养液稀释,浓度分别为0、1和15 μmol/L)。置于37 ℃、含体积分数0.05 CO2无菌环境中培养,分别于培养0、48 h时取样,拍照。
1.2.5Western blot法检测凋亡和内质网应激相关蛋白表达 收集CPT(0、1和(或)15 μmol/L)作用48 h后的HepG2细胞,提取蛋白。取30 μg蛋白,于摇床上用1 g/L脱脂奶粉室温封闭2 h,分别加入cleaved caspase3、重链结合蛋白(BIP)、蛋白激酶R样内质网激酶(p-PERK)一抗(1∶1 000),4 ℃过夜,以PBST清洗3次,加入二抗(1∶10 000),室温摇床孵育2 h,以PBST清洗,滴加ECL化学发光液在显影仪中进行化学发光成像。
1.2.6流式细胞术检测细胞凋亡 分别用浓度为1、15 μmol/L的CPT处理HepG2细胞48 h,然后用预冷PBS轻洗细胞2次,消化细胞。取1×104个细胞用Binding Buffer重悬后置于1.5 mL EP管中,每管加入5 μL FITC轻轻混匀,避光孵育15~30 min。加入5 μL PI和400 μL Binding Buffer,上机检测调亡细胞。最后使用Flow Jo软件分析细胞凋亡情况。
1.3 统计学分析

2 结 果
2.1 CPT对HepG2细胞生长和迁移的作用
MTT法检测结果显示,CPT对HepG2细胞生长的抑制作用是呈梯度的。与阴性对照组相比,10、15、30 μmol/L CPT组HepG2细胞的生存率明显下降,差异有统计学意义(F=126.40,P<0.001)(图1A)。LDH释放法检测结果显示,15 μmol/L CPT组HepG2细胞的LDH释放量明显升高,与阴性对照组相比,差异具有统计学意义(F=41.10,P<0.001)(图1B)。细胞划痕实验结果显示,细胞划痕48 h后,与阴性对照组相比,15 μmol/L CPT组的闭合率显著降低,差异具有统计学意义(F=96.18,P<0.001)(图1C)。
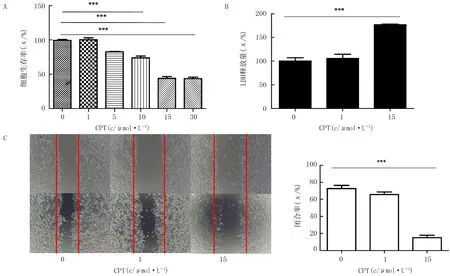
A:CPT处理对细胞生长的影响;B:LDH实验;C:细胞划痕实验(100倍)。***P<0.001。
2.2 CPT对HepG2细胞凋亡的影响
Western blot检测结果显示,与阴性对照组和1 μmol/L CPT组相比,15 μmol/L CPT组cleaved caspase3的表达水平增高,差异具有统计学意义(F=156.90,P<0.001)(图2A)。流式细胞分析术检测结果显示,与阴性对照组相比,15 μmol/L CPT组细胞凋亡率明显升高,差异具有统计学意义(F=1 090.00,P<0.001)(图2B、表1)。

A:CPT处理对HepG2细胞cleaved caspase3表达的影响;B:Annexin V FITC-PI双染后流式细胞分析术。***P<0.001。

表1 CPT对HepG2细胞凋亡的影响
2.3 CPT对HepG2细胞内质网应激的影响
Western blot检测结果显示,与阴性对照组相比,15 μmol/L CPT组细胞中p-PERK和BIP蛋白的表达水平明显降低,差异具有统计学意义(F=57.20、49.92,P<0.001);与1 μmol/L CPT组相比较,15 μmol/L CPT组细胞中BIP蛋白的表达水平明显降低,差异均具有统计学意义(F=49.92,P<0.001)(图3A)。在15 μmol/L CPT作用下,与未经衣霉素预处理组相比,经衣霉素预处理组HepG2细胞中BIP的表达水平明显升高,差异具有统计学意义(F=41.09,P<0.001)(图3B)。

A:CPT处理对内质网应激蛋白表达的影响;B:CPT和衣霉素处理对HepG2细胞中BIP蛋白表达的影响。**P<0.01,***P<0.001。
3 讨 论
研究发现,CPT作为从丹参中提取的脂溶性单体,对肿瘤有很好的疗效[7-9]。本文体外细胞学研究结果表明,CPT可以抑制HepG2细胞的生长,与阴性对照组相比,10、15、30 μmol/L CPT组HepG2细胞的生存率明显下降。15 μmol/L的CPT可以破坏HepG2细胞的细胞膜,引起LDH释放量明显增加。另外,在细胞划痕实验中,相对于阴性对照组,15 μmol/L CPT组HepG2细胞的迁移水平降低,差异具有统计学意义。上述结果证实CPT可以减弱HepG2细胞的生长和迁移能力。
CPT诱导的细胞生长和增殖抑制主要是由于细胞凋亡[10-11]。有研究表明,CPT可以诱导HeLa、DU145和Hep3B细胞凋亡,其机制主要是诱导凋亡蛋白caspase3的活化和抑制抗凋亡蛋白Bcl-xL等的表达[6,12-13]。CPT被普遍认为是一种有效的信号转导和转录激活因子3(STAT3)抑制剂。相关文献报道,CPT可以快速抑制DU145细胞中STAT3 Tyr705的磷酸化,而后与细胞质中的STAT3分子共定位,并通过直接结合到STAT3的SH2域来抑制STAT3二聚体的形成[12]。有文献报道,STAT3可以调节细胞的生长和凋亡[13]。本研究结果表明,CPT可以活化细胞凋亡蛋白caspase3,从而诱导HepG2细胞发生凋亡。
内质网是一种多功能细胞器,可以参与维持细胞稳态和支持细胞存活[14-15]。外界的刺激可以使其内部错误蛋白不断积累,造成内质网应激[16]。当这种积累超过临界阈值时,未折叠蛋白反应(UPR)补救信号转导途径会被激活,该途径主要涉及3个内质网跨膜传感器(IRE1α、PERK和ATF6)介导的通路[17-18]。相关研究表明,肿瘤细胞通过UPR适应低糖环境,促进肿瘤细胞的生存[19-21]。此外,有研究证实,UPR通过抑制炎症和凋亡信号通路进行细胞保护[22-25]。本研究结果表明,CPT可以有效地抑制HepG2细胞中内质网应激的发生。
综上所述,CPT对HepG2细胞的生长和迁移有抑制作用,在促进HepG2细胞凋亡的同时可抑制内质网应激。本研究为CPT作为一种有潜力的抗肝癌药物提供了证据。