TI-RADS、UE、CEUS及FNAC在预测甲状腺乳头状癌颈部淋巴结转移中的意义*
汪彩英,张才智,叶 娟,张 苗,林来红,金 霞
(武汉市江夏区第一人民医院超声影像科,湖北 武汉 430200)
甲状腺癌是最常见的甲状腺恶性肿瘤,约占全身恶性肿瘤的1%,且在女性中更为常见[1]。乳头状癌是甲状腺癌中最常见的亚型,约占甲状腺癌的85%,由于其恶性度较低,只要及时发现,预后往往较好,但其生长较为缓慢,不易被发现[2]。近年来,世界范围内甲状腺乳头状癌(PTC)的发病率呈上升趋势[3]。且有30%~40%的甲状腺乳头状癌患者伴有颈部淋巴结转移,严重影响患者的预后[4],因此,早期评估颈部淋巴结是否转移可作为临床诊疗及预后评估的重要参考依据。常规超声是目前检查甲状腺疾病的首选检查方式,但其在鉴别病灶的良恶性方面特异性不高,易将一些较小的、缺乏典型超声表现的恶性结节与良性结节混淆,造成误诊及漏诊[5]。甲状腺影像报告与数据系统(TI-RADS)是一种统一和规范甲状腺超声诊断和管理的体系。与常规超声相比,超声弹性成像(UE)能够通过检测结节硬度判别其性质,提供更多结节内在的特征信息;超声造影(CEUS)则更能突出显示结节血流灌注情况,有助于淋巴结病变的分类和鉴别诊断[6]。另外,随着超声技术不断发展,新的检测技术层出不穷,当前细针穿刺细胞学检查(FNAC)也逐步得到应用。但目前,国内外对TI-RADS、UE、CEUS、FNAC在预测甲状腺乳头状癌颈部淋巴结转移中的意义这一方面研究较少。本研究通过与术后病理检查结果相比,探讨TI-RADS、UE、CEUS、FNAC在预测甲状腺乳头状癌颈部淋巴结转移中的意义,为甲状腺乳头状癌的临床诊疗及预后评估提供一定的参考。
1 资料与方法
1.1 纳入与排除标准
纳入标准:①甲状腺肿瘤切除术中均进行淋巴结清扫术,并行淋巴结病理检查,确诊为甲状腺乳头状癌;②术前均进行常规超声、超声弹性成像、超声造影、细针穿刺细胞学检查;③临床资料完整者;④甲状腺单发肿瘤;⑤术前均未接受放、化疗及免疫治疗。排除标准:①合并淋巴结核、淋巴结原发疾病或其他部位肿瘤转移至淋巴结者;②合并严重的肝肾功能不全、血液系统疾病或有其他头颈部肿瘤者;③甲状腺继发肿瘤者;④无法自主配合研究者。
1.2 一般资料
选取2017年5月至2019年12月我院接受手术治疗的甲状腺乳头状癌患者153例,根据术后颈部淋巴结是否转移将其分为转移组(n=83)和未转移组(n=70)。所有患者及家属均自愿签署知情同意书。
1.3 主要仪器
采用Philips EPIQ5彩色多普勒超声诊断仪,L12-5探头,频率5~12MHz,配有超声造影软件;Zonare Zone Ultra超声诊断仪,L14-5探头,频率7~12MHz,配有弹性成像软件。
1.4 图像采集
1.4.1 常规超声
常规超声扫查,患者取仰卧位,充分暴露颈部,在颈前区多切面观察并记录原发病灶的相关信息。
1.4.2 UE检查
选取清晰的二维纵切面图像,切换到弹性成像模式后,调整取样框大小,使整个结节及周围正常甲状腺组织都包括在内,探头与皮肤垂直,均匀轻压探头,尽量使病灶处于图像的中央位置,获得稳定满意的图像后冻结,存储静态及动态图像。
1.4.3 CEUS检查
嘱患者平静呼吸,避免吞咽动作,经肘静脉团注2.0mL造影剂,随后快速推入5mL生理盐水冲管。推注同时启动计时器,连续动态观察和记录约2min,每个结节造影检查时仪器预设置参数保持一致,将超声造影动态全过程采集存储于机器硬盘供后处理分析。
1.4.4 超声引导下FNAC
穿刺前需注意停用抗凝药物,以及检查止凝血功能明确无穿刺禁忌。在超声引导下多点多平面负压抽吸,看到组织液后立即拔针,可根据穿刺标本满意度情况进行2~3次穿刺。将抽取物立即全部转移到内含10mL保存液的专用液基保存杯中,并反复抽吸保存液冲洗针管与针头内残留物送病检,并对病理结果进行详细记录。
1.5 观察指标
1.5.1 TI-RADS
根据TI-RADS[7]进行分类并记录数据,主要评分项目为原发病灶的内部结构、回声、形状、边界、点状强回声,得分0~15分,共分为5类。1类(0分):良性,不需要处理。2类(2分):恶性风险<2%,考虑良性,随访。3类(3分):恶性风险<5%,轻度可疑恶性;结节最大径≥2.5cm,建议FNA;结节最大径≥1.5cm,建议第1、3、5年随访。4类(4~6分):恶性风险5%~20%,中度可疑恶性;结节最大径≥1.5cm,建议FNA;结节最大径≥1.0cm,建议第1、2、3、5年随访。5类(≥7分),恶性可能>20%,高度可疑恶性;结节最大径≥1.0cm,建议FNA;结节最大径≥0.5cm,建议每年1次随访至满5年。
1.5.2 UE
根据甲状腺结节内部颜色的组成比例(不同颜色代表相对硬度不同),分为Ⅰ~Ⅴ级[8]:Ⅰ级(2分):整个病灶与周围组织均为绿色;Ⅱ级(4分):病灶以绿色为主,周边呈蓝色,蓝色面积≤50%;Ⅲ级(6分):病灶以蓝色为主,蓝色面积为50%~80%;Ⅳ级(8分):病灶几乎为蓝色,蓝色面积>80%;Ⅴ级(10分):病灶完全为蓝色,且病灶周围部分组织也出现蓝色。
1.5.3 CEUS
回放动态图像,由两名甲状腺造影经验丰富的超声医师独立分析图像,记录造影特征。超声造影特征中包括增强模式:高增强、等增强、低增强、无增强;内部是否均匀:均匀增强、不均匀增强;周边是否有环状增强等指标。
1.5.4 FNAC
将抽取组织推出适量进行涂片,置于95%的酒精中进行固定并送细胞学病理检查。由两名经验丰富的病理科医师协同阅片并做出诊断。可按照甲状腺细胞病理学Bethesda报告系统[9]将其分为6类:Ⅰ类:标本无法诊断或不满意;Ⅱ类:良性病变;Ⅲ类:意义不明确的非典型病变或滤泡性病变;Ⅳ类:滤泡性肿瘤或可疑滤泡性肿瘤;V类:可疑恶性肿瘤;Ⅵ类:恶性肿瘤。Ⅰ、Ⅱ类为细胞学阴性,Ⅲ、Ⅳ、Ⅴ、Ⅵ类为细胞学阳性。FNA-Tg>1.0ng/mL可作为甲状腺乳头状癌转移性淋巴结的阳性标准。
1.6 统计学方法

2 结 果
2.1 一般资料
两组患者的性别、年龄、临床分期相比差异无统计学意义(P>0.05),具有可比性。见表1。
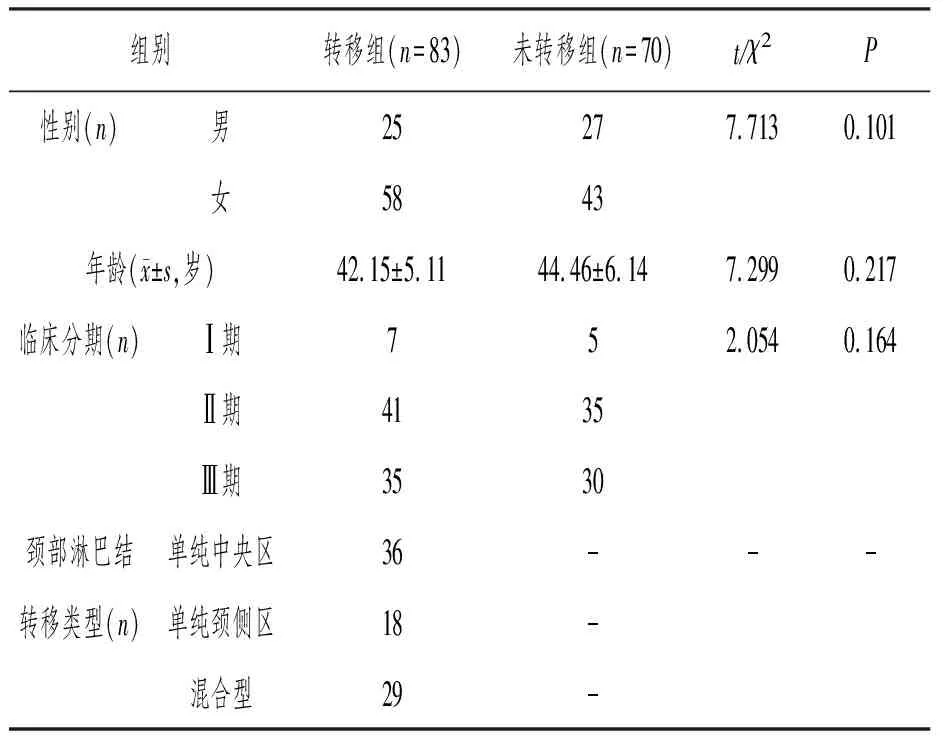
表1 一般资料
2.2 TI-RADS、UE、CEUS、FNAC预测甲状腺乳头状癌颈部淋巴结转移的效能比较
与单独应用TI-RADS、UE、CEUS、FNAC相比,联合应用后预测颈部淋巴结转移的敏感度、特异度和准确率显著升高(P<0.05)。见表2。
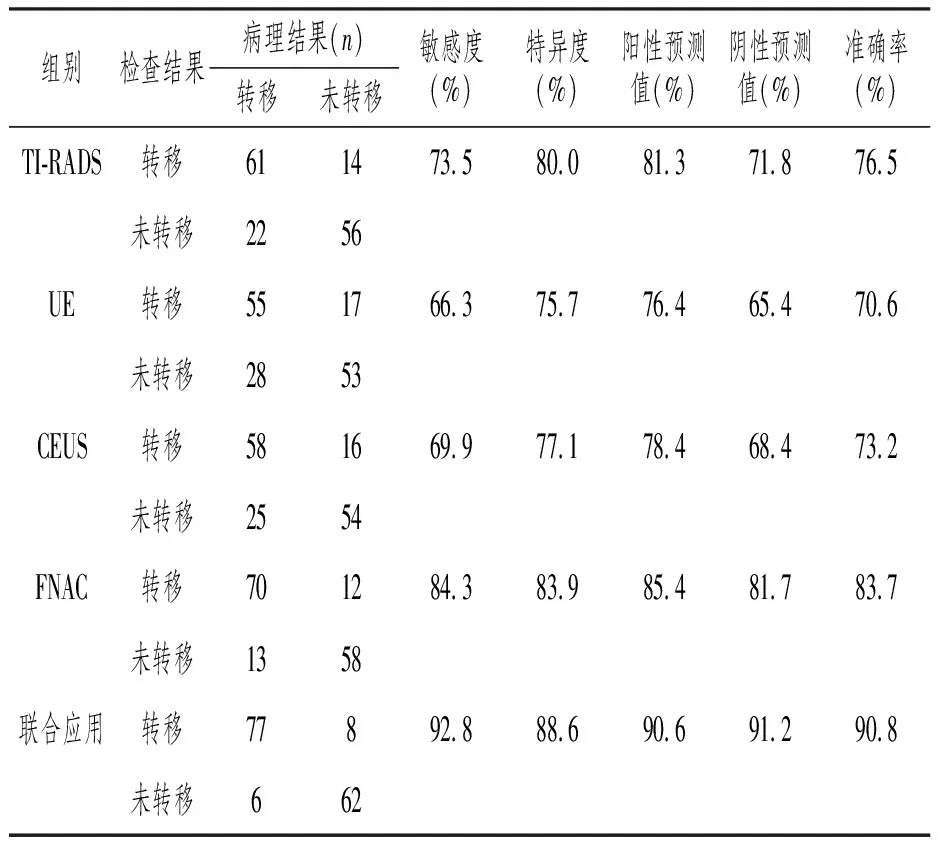
表2 TI-RADS、UE、CEUS、FNAC预测甲状腺乳头状癌颈部淋巴结转移的效能比较
2.3 单因素分析
两组患者原发灶内微钙化、病变结节的纵横比、颈部淋巴结内钙化、增强方式、充盈缺损情况相比,差异无统计学意义(P>0.05);而两组患者PSV、RI、淋巴结内囊性变、包膜被累及程度、弹性评分、增强模式、内部增强均匀、环形灌注及FNA-Tg情况相比,差异有统计学意义(P<0.05)。见表3。
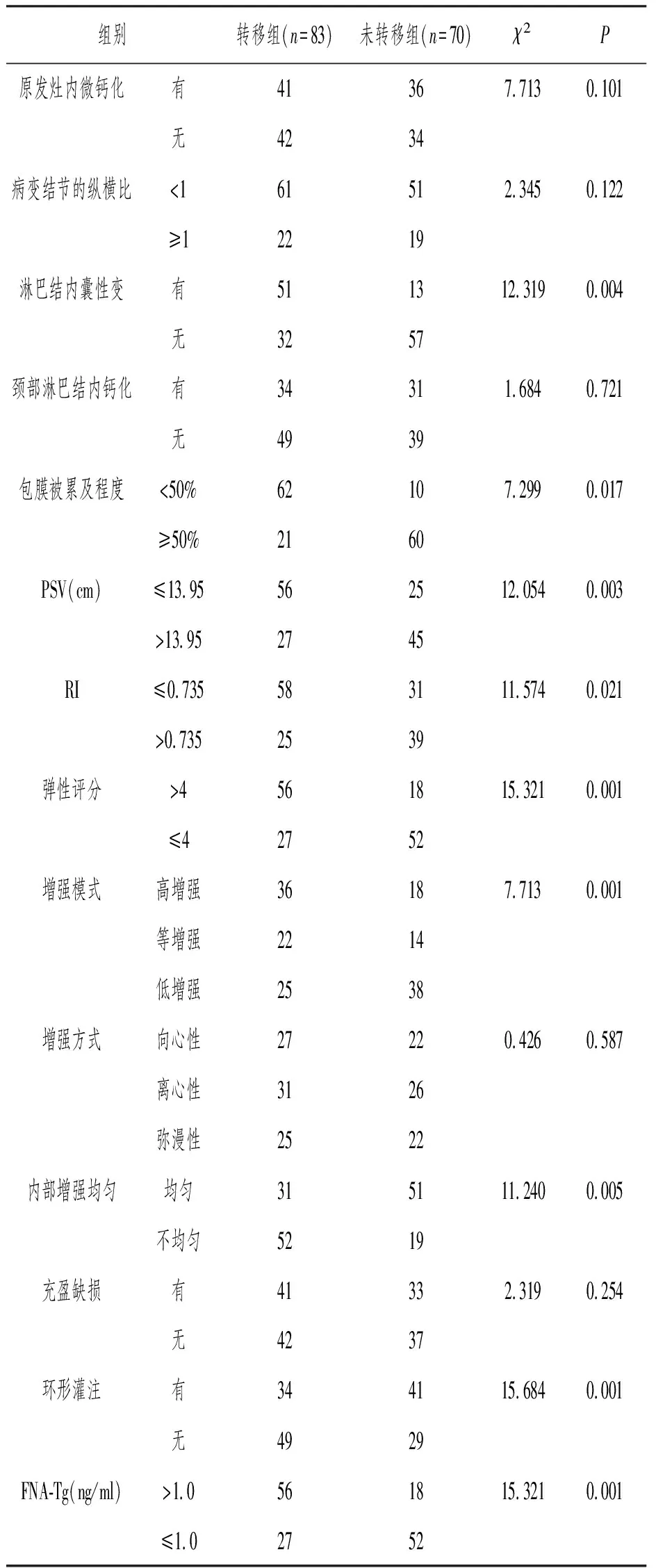
表3 单因素分析
2.4 多因素分析
将上述具有统计学意义的单因素纳入多因素Logistic回归分析,结果显示,PSV、RI、淋巴结内囊性变、包膜被累及程度、弹性评分、内部增强均匀及FNA-Tg是甲状腺乳头状癌患者发生颈部淋巴结转移的独立危险因素,差异有统计学意义(P<0.05)。见表4。
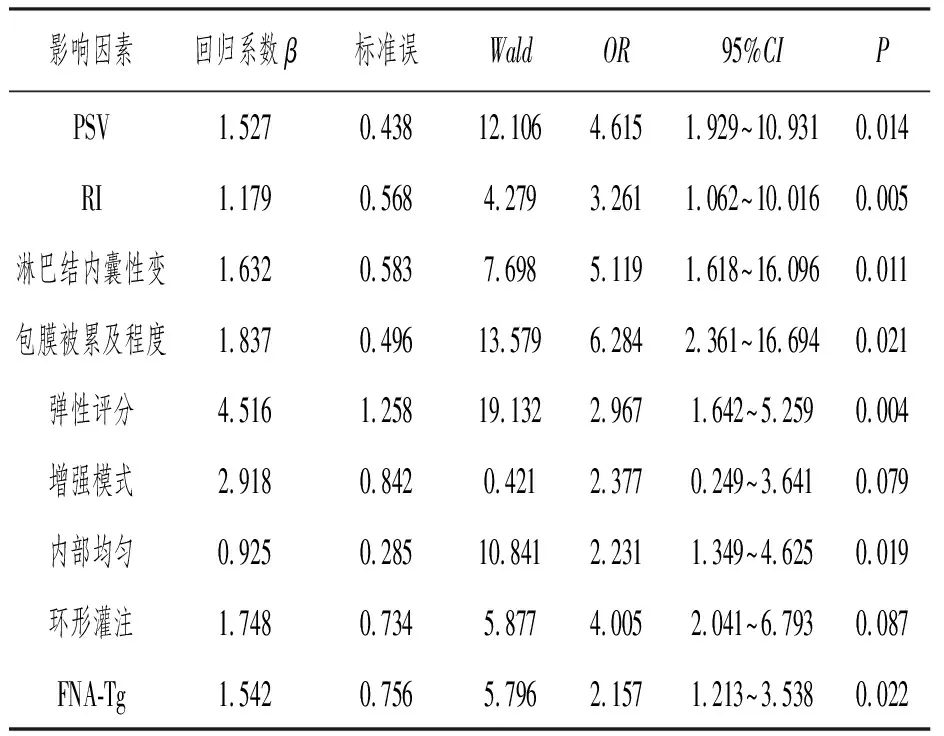
表4 多因素分析
2.5 建立预测模型
根据Logistic多因素结果建立预测模型。ROC曲线下面积为(0.783±0.014),95%CI:0.684~0.803,SE=0.101,P=0.023,根据约登指数最大原则可知,截断点为1.136。其灵敏性、特异度、阳性预测值和阴性预测值分别为86.29%、79.64%、83.73%和87.21%。
3 讨 论
甲状腺癌是内分泌系统最常见的恶性肿瘤,而甲状腺乳头状癌是甲状腺癌疾病类型最为常见的一种,预后较好、生存率较高,其发病与患者自身分泌的激素异常、碘摄入量以及生活环境等因素相关。近年来,随着超声技术的发展,甲状腺乳头状癌的检出率逐年上升,但由于甲状腺乳头状癌早期无明显临床症状,隐匿性较高,极易出现漏诊。随着病情的不断发展,肿瘤体积变大,甲状腺内会出现大小不一的肿块,甚至出现淋巴结转移,对患者的生命安全造成严重影响。有研究指出淋巴结转移是甲状腺乳头状癌预后及复发的危险因素之一[10]。
常规超声是公认的甲状腺及其淋巴结的首选检查方式,但单一的超声特征不能准确地鉴别结节的良恶性,因此,Park等[11]联合多种超声征象对甲状腺结节的诊断进行标准分级,制订了TI-RADS。有研究发现TI-RADS对甲状腺乳头状癌颈部,尤其是中央区淋巴结转移预测准确率较低,原因可能是超声检查易受锁骨干扰,对中央区深部组织显示欠佳,且转移淋巴结多体积较小,容易漏诊[12]。US是近年来兴起的一项超声新技术,目前已被广泛应用于肝脏、甲状腺、乳腺等疾病的诊断中[13]。CEUS是一种安全有效的成像技术,能够动态观察病灶血流灌注信息及血管形态学变化,对甲状腺癌的诊断及评估预后有重要价值[14]。刘振华等[15]研究发现超声弹性成像与超声造影诊断甲状腺乳头状癌颈部淋巴结转移的敏感度、特异度及准确率的差异无统计学意义。与本文研究结果一致。与常规淋巴结手术活检病理学检查相比,细针穿刺细胞学检查损伤较少,操作简便,可直接获取病灶细胞,预测颈部淋巴结转移的准确性较高[16]。本研究比较TI-RADS、UE、CEUS、FNAC预测颈部淋巴结转移的效能,发现FNAC的准确性显著高于UE、CEUS,4种方法联合应用后预测颈部淋巴结转移的准确性显著升高。与既往研究结果相似。
既往研究中董永玲等[17]发现原发灶直径及PSV是甲状腺乳头状癌患者伴颈部淋巴结转移的相关独立因素。石文媛等[18]研究认为,包膜被累及程度达80%以上是甲状腺乳头状癌患者发生淋巴结转移的独立危险因素。也有研究[19]指出超声成像中甲状腺包膜被累及程度可作为甲状腺乳头状癌患者发生颈部淋巴结转移独立诊断的指标。张恒等[20]也发现淋巴结内囊性变、甲状腺包膜被累及程度、PSV和RI对预测甲状腺乳头状癌颈部淋巴转移具有较高的诊断价值。多项研究[12,21]发现超声造影增强模式与甲状腺乳头状癌颈部淋巴结转移有关,且高增强组甲状腺乳头状癌颈部淋巴结转移的发生率显著高于低增强组。樊金芳等[22]研究发现弹性评分与超声造影内部增强均匀与否是甲状腺乳头状癌患者发生颈部淋巴结转移的危险因素。然而陶玲玲等[23]发现超声造影的增强模式及内部增强均匀与否与甲状腺乳头状癌患者有无淋巴结转移情况无相关性,原因可能是医师分析图像时出现误差。甲状腺球蛋白(Tg)是甲状腺滤泡上皮分泌的大分子糖蛋白,绝大多数由甲状腺细胞合成并释放进入甲状腺滤泡的残腔中,在正常的甲状腺组织中含量极微,但在分化好的甲状腺癌组织中或是发生转移的淋巴结含量上升,因此,若在颈部淋巴结穿刺物中检测到高浓度Tg,表明来源于甲状腺乳头状癌癌细胞已转移到颈部淋巴结[24]。陈荣荣等[25]发现FNA-Tg预测甲状腺乳头状癌患者发生颈部淋巴结转移的准确性较高。本研究通过单因素分析发现PSV、RI、淋巴结内囊性变、包膜被累及程度、弹性评分、增强模式、内部增强均匀与否、环形灌注及FNA-Tg与预测甲状腺乳头状癌患者颈部淋巴结是否转移有关,再通过Logistic回归法进行多因素分析发现,PSV、RI、淋巴结内囊性变、包膜被累及程度、弹性评分、内部增强均匀与否及FNA-Tg是甲状腺乳头状癌患者发生颈部淋巴结转移的危险因素。再根据Logistic多因素分析结果绘制ROC曲线图,建立预测模型,发现其有较高的检验效能,能够敏感、高效地为临床上预测甲状腺乳头状癌患者颈部淋巴结转移提供一定的参考。
综上所述,TI-RADS、UE、CEUS、FNAC联合在预测甲状腺乳头状癌颈部淋巴结转移的应用价值较高,为术前评估病情及选择手术方案提供更有力的参考依据。

