超声引导下微波消融术治疗乳腺良性结节的临床价值分析*
李俊韬 戴素娟 李琳
乳腺结节是一种局灶性乳腺病变,其中良性结节的危害性相对较低,临床以育龄期女性较为常见,发病率约占乳腺疾病的60%~85%[1]。现阶段,常规药物保守治疗乳腺良性结节的效果并不理想,因此手术仍为治疗乳腺良性结节最有效的方式,但不同的手术优缺点有所差异[2]。超声引导下微波消融术是一种近几年发展起来的新型微创术式,具有微创、安全、操作简单、不留瘢痕等优势,该术式已广泛应用于甲状腺结节、肝脏肿瘤、子宫肌瘤等疾病的治疗中,但目前超声引导下微波消融术应用于乳腺良恶性肿瘤治疗的报道仍较少,给临床医生带来一定困扰[3]。因此,本研究回顾性分析2018 年1 月-2020 年10 月赣州市人民医院收治的98 例乳腺良性结节手术患者的临床资料,探讨超声引导下乳腺良性结节微波消融术的临床应用价值,现报道如下。
1 资料与方法
1.1 一般资料 回顾性分析2018 年1 月-2020 年10 月本院收治的98 例乳腺良性结节手术患者的临床资料。纳入标准:(1)符合《乳腺结节的评估、诊断及处理》中乳腺结节诊断标准[4];(2)于本院接受乳腺手术治疗;(3)手术病理检查确认结节性质为良性;(4)单侧或双侧乳腺发病;(5)术后随访时间12 个月;(6)临床资料完整清晰。排除标准:(1)既往存在乳腺外科手术史;(2)合并脏器功能严重损伤;(3)术前合并其他原发性乳腺病变;(4)凝血功能异常;(5)合并急性感染;(6)合并严重血液疾病。根据手术方式的差异将患者分为开放手术组(34 例)、微创旋切组(32 例)、微波消融组(32 例)。所有患者手术均由赣州市人民医院同一组医护人员完成,本研究经赣州市人民医院医学伦理委员会批准,入选患者术前对治疗内容完全知情。
1.2 方法 术前准备。所有患者术前均通过乳腺超声、磁共振成像(magnetic resonance imaging,MRI)检查、X 线片、触诊等方式评估患者乳腺病变情况,明确乳腺结节位置与大小;同时结合问诊情况收集患者生育医院、年龄、病史等资料,最终确认患者符合乳腺结节手术指征[4]。
开放手术组行传统开放手术。患者取仰卧位,行局部浸润麻醉,外展患侧上肢使腋窝充分暴露,消毒切除部位20 cm 范围内区域后常规铺巾,根据患者病灶实际情况作一合适大小切口,常规游离皮下组织使乳腺结节暴露,彻底切除结节及结缔组织,行术中快速病理检查后常规缝合。
微创旋切组行麦默通微创手术。患者取仰卧位,采用彩色多普勒超声诊断系统(生产厂家:美国General Electric 公司,型号:E10 型)定位引导,明确肿块数量、大小、位置等基本信息后以标记笔标记,在超声引导下进行局部麻醉,采用麦默通真空辅助乳腺微创旋切系统(生产厂家:美国Johnson公司,型号:revolve 型)进行手术,旋切前以生理盐水润滑管路,定位预穿刺点并使用尖刀切开皮肤,然后在超声引导下刺入旋切刀头至肿物下方,调整旋切刀位置,使刀槽落在目标病灶下方,采用Sample 模式进行旋切与抽吸,超声检查确认无病灶残留后终止旋切,常规封闭刀槽口并退出患者体内,检查出血情况,确认出血后采用无菌胶纸黏合切口。
微波消融组行超声引导下微波消融术。患者取仰卧位,外展患侧上肢使乳腺暴露,常规消毒、铺巾,超声探头涂耦合剂后以无菌塑料护套包裹,行利多卡因乳房后间隙局部浸润麻醉,彩超引导下在目标结节周围注射冰生理盐水肾上腺素溶液5~20 mL,形成一个宽约5 mm 的安全隔离带以防术中周围组织损伤,超声引导下经皮将半自动活检针(美国Bard 公司,18 G)置入部分结节进行穿刺活检,超声引导下经皮将微波消融针沿肿块长径方向直接刺入目标病灶,预设输出功率40 W,常规消融时间60 s,穿刺过程中使针尖始终处于超声可观察的范围内,进行多点、多面消融,当整个目标结节被热量生成的强回声完全覆盖,同时彩色超声检查治疗区彩色血流信号完全消失时即消融完成,消融后常规退出设备并黏合切口。
术后处理。所有患者均采用胸部多头带加压包扎24~48 h,术后2 周内避免剧烈晃动患侧乳房,术后清淡饮食,忌刺激性食物,给予常规抗炎、镇痛及血栓预防治疗,术后当天指导患者进行肩关节锻炼以防皮下积液,术后第2 天指导患者进行患侧上肢慢举、上肢慢屈、上肢慢拉等康复训练以促进患者患侧运动功能的恢复;所有患者术后均随访观察12 个月。
1.3 观察指标及判定标准(1)比较三组疼痛评分。术后1、2、3、24、48 h 采用视觉模拟评分法(visual analogue scale,VAS)评估患者术后主观疼痛感,该量表总分10 分,分值越高提示主观疼痛越剧烈[5]。(2)比较三组术前和术后7 d 的炎症指标。空腹时采集患者外周静脉血3 mL,采用双抗夹心免疫化学发光法检测肿瘤坏死因子-α(tumor necrosis factor,TNF-α),采用酶联免疫法检测C反应蛋白(C reactive protein,CRP)。(3)比较三组瘢痕美观度。末次随访时(术后12 个月)采用瘢痕美容评估与评级(scar cosmesis assessment and rating,SCAR)量表评估患者术后瘢痕美观度,根据总得分情况分为优(≤3 分)、良(4~8 分)、差(≥9 分)[6]。优良=优+良。评分细则见表1。(4)比较三组术后12 个月的疗效,结合患者超声扫描影像评估临床疗效;疗效标准:①显效,患侧乳腺病灶体积较治疗前缩小>90%,患者无任何不适感;②有效,乳腺病灶体积缩小70%~90%,或存在乳房胀痛、周期性疼痛;③无效,乳腺病灶体积缩小<70%[4]。总有效=显效+有效。(5)比较两组术后并发症发生情况,包括切口出血、感染、上肢水肿等,本研究最终随访日期截至2021 年10 月。

表1 SCAR量表评分规则
1.4 统计学处理 采用 SPSS 22.0 进行统计学分析,满足正态性且组间方差相等的计量资料(年龄、同一时间的VAS 评分、体重指数、PCT、结节直径、CRP、病程)用()表示,采用方差分析进行多组间比较;计数资料(术后并发症、疗效)以率(%)表示,比较采用χ2检验;同组不同时间的VAS 评分比较采用重复测量方差分析。以P<0.05为差异有统计学意义。
2 结果
2.1 三组一般资料比较 三组一般资料比较比较,差异均无统计学意义(P>0.05),具有可比性。见表2。

表2 三组一般资料比较

表2 (续)
2.2 三组术后疼痛评分比较 术后1、2、3、24、48 h,三组VAS 评分比较,差异均有统计学意义(P<0.05)。术后2、3、24 h,三组VAS 评分均高于术后1 h,差异均有统计学意义(P<0.05)。术后1、2、3、24、48 h,开放手术组的VAS 评分均高于微创旋切组与微波消融组,差异均有统计学意义(P<0.05)。术后1、2、3、24、48 h,微创旋切组与微波消融组VAS 评分比较,差异均无统计学意义(P>0.05)。见表3。三组术后VAS 评分变化趋势图见图1。
表3 三组术后疼痛评分比较[分,()]
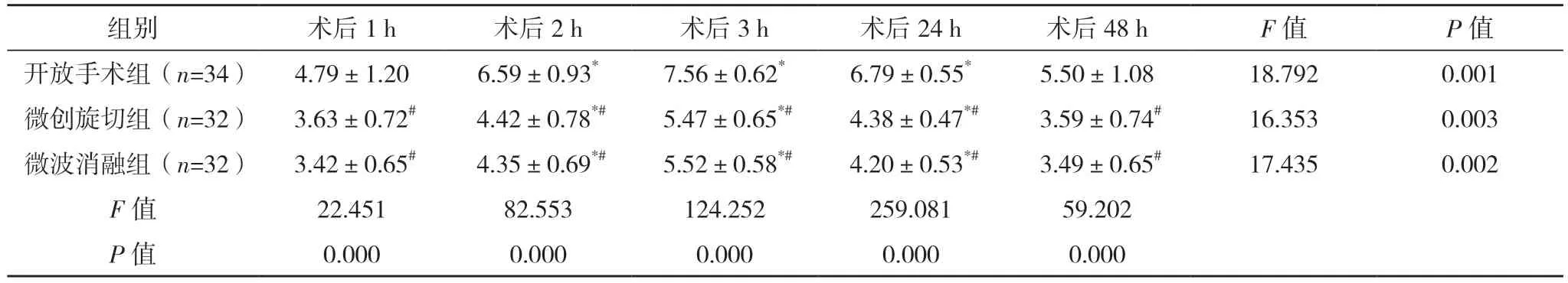
表3 三组术后疼痛评分比较[分,()]
*与术后1 h 比较,P<0.05;#与开放手术组比较,P<0.05。

图1 三组术后VAS评分变化趋势图
2.3 三组炎症指标比较 术前,三组TNF-α、IL-6 水平比较,差异均无统计学意义(P>0.05);术后7 d,三组TNF-α、IL-6 水平均高于术前,差异均有统计学意义(P<0.05)。术后7 d,三组TNF-α、IL-6 水平比较,差异均有统计学意义(P<0.05)。术后7 d,开放手术组TNF-α、IL-6 均高于微创旋切组与微波消融组,差异均有统计学意义(P<0.05)。术后7 d,微创旋切组与微波消融组的TNF-α、IL-6 水平比较,差异均无统计学意义(P>0.05)。见表4。
表4 三组炎症指标比较()

表4 三组炎症指标比较()
*与术前比较,P<0.05;#与开放手术组比较,P<0.05。
2.4 三组术后瘢痕美观度比较 三组瘢痕优良率比较,差异有统计学意义(χ2=9.696,P<0.05)。开放手术组的瘢痕优良率均低于微创旋切组与微波消融组,差异均有统计学意义(P<0.05)。微创旋切组与微波消融组的瘢痕优良率比较,差异无统计学意义(P>0.05),见表5。

表5 三组术后瘢痕美观度比较[例(%)]
2.5 三组术后12 个月疗效比较 术后12 个月,三组总有效率比较,差异有统计学意义(χ2=9.121,P<0.05)。开放手术组与微波消融组总有效率均高于微创旋切组,差异均有统计学意义(P<0.05)。开放手术组与微波消融组总有效率比较,差异无统计学意义(P>0.05),见表6。

表6 三组术后12个月疗效比较[例(%)]
2.6 三组术后并发症发生情况比较 三组并发症发生率比较,差异有统计学意义(χ2=7.461,P<0.05)。微波消融组并发症发生率低于开放手术组(P<0.05)。开放手术组与微创旋切组并发症率比较,差异无统计学意义(P>0.05),见表7。

表7 三组术后并发症发生情况比较[例(%)]
3 讨论
乳腺良性结节是我国女性多发性疾病,良性结节相对恶性结节危害性更低,但若未采取及时的治疗可能导致结节持续生长,进而影响患者乳腺正常功能,而且良性结节具有一定恶变风险,因此针对性治疗对于提高患者预后具有重要意义[7-9]。常规保守治疗乳腺良性结节的效果并不理想,因此临床主要以手术切除治疗为主[10-12]。长期以来,传统开放手术一直是临床治疗乳腺良性结节的最常用术式,该术式具有操作简单、经济性强、操作视野好、切除干净等优势,但存在创伤大、恢复慢、术后并发症多等劣势,不仅会留下明显瘢痕从而影响美观,还会对患者输乳管造成损伤,不适用于存在生育计划的育龄期女性[13]。随着微创技术的发展,真空辅助微创旋切疗法逐渐应用于乳腺良性结节的临床治疗中,该术式对无法触诊的隐匿性病灶及较小病灶切除效果较好,存在创伤小、恢复快、疼痛轻微等优势。但有研究表明,真空辅助微创旋切治疗较大病灶(≥3 cm)的复发风险较高,且易导致病灶残留,术后中远期疗效并不理想,存在一定局限性[14]。超声引导下微波消融术作为新型微创术式,具有操作方便、创伤小、肿瘤灭活效果好等优势,在肝脏、子宫、甲状腺等部位实体瘤的治疗中已应用广泛,但在乳腺良性结节中的应用较少[15]。
本研究回顾性分析江西省赣州市人民医院98 例乳腺良性结节手术患者的临床资料,探讨超声引导下乳腺良性结节微波消融术的临床应用价值。研究结果显示,术后1、2、3、24、48 h,开放手术组的VAS 评分及术后7 d 的TNF-α、IL-6 水平均高于微创旋切组与微波消融组(P<0.05),表明开放手术术后感染风险及疼痛感均高于微创旋切与微波消融两种微创术式;但微创旋切组与微波消融组术后1、2、3、24、48 h 的VAS 评分及术后7 d的TNF-α、IL-6 水平比较,差异均无统计学意义(P>0.05),表明微创旋切与微波消融两种微创术式在术后疼痛及感染方面的差异不显著,与刘晓璐等[16]的研究结果相近。本研究结果显示,术后12 个月开放手术组的SCAR 瘢痕优良率低于微创旋切组与微波消融组(P<0.05),但微创旋切组与微波消融组的SCAR 瘢痕优良率比较,差异无统计学意义(P>0.05),表明微创旋切与微波消融两种术式瘢痕美观度均高于开放手术,但微创旋切与微波消融两种术式的瘢痕美观度差异不显著。术后12 个月,开放手术组与微波消融组的总有效率高于微创旋切组(P<0.05),开放手术组与微波消融组的总有效率比较,差异无统计学意义(P>0.05),与Wang 等[17]的研究相似,表明开放手术与微波消融的疗效优于微创旋切,且开放手术与微波消融两种术式的近中期疗效差异不显著。
综上所述,超声引导下微波消融术治疗乳腺良性结节的优势明显,疗效优于微创旋切,术后瘢痕美观度高于开放手术,术后并发症少于开放手术,术后疼痛感与感染风险低于开放手术,操作简单且治疗效果好,具有临床推广应用价值。

