急性主动脉夹层保守治疗院内死亡危险因素分析及预测模型的构建*
肖子亚 王新艳 耿加兴 张亚斌 高磊 师猛 李勇
急性主动脉夹层(acute aortic dissection,AAD)是严重的主动脉疾患,是由各种原因引起的主动脉壁内膜破裂,血液通过内膜破口处进入主动脉中层,形成真假两腔并存的病变[1],以起病急、进展快、发病后死亡率高为特点[2],如果不进行及时有效的救治,每小时死亡率高达1%~2%[3]。主动脉夹层最有效的治疗方式是外科手术或介入治疗,但仍有部分患者由于各种原因进行了药物保守治疗。本研究对87 例药物保守治疗的AAD 患者的临床特征进行了回顾性分析,探讨其预后相关影响因素,为临床提供参考依据。现报道如下。
1 资料与方法
1.1 一 般资料 收集2019 年1 月-2020 年12 月济宁医学院附属医院经主动脉CTA 确诊的87 例药物保守治疗的AAD 患者临床资料进行回顾性分析。纳入标准:首次诊断AAD;发病来诊时仍在急性期(≤14 d);未行外科手术或介入治疗;病例资料完善。排除标准:年龄≤18 岁;妊娠期妇女;合并严重肝肾功能不全。本研究获得了济宁医学院附属医院伦理委员会批准。
1.2 方法 根据患者住院期间是否死亡分为存活组和死亡组,收集两组临床资料,包括性别、年龄、Stanford 分型、Debakey 分型、高血压病史、糖尿病病史、马凡/外伤/梅毒病史、入院生命体征,实验室指标首次测定值:肌红蛋白(MYO)、肌酸激酶同工酶(CKMB)、肌钙蛋白I(cTnI)、D-二聚体(D-dimer)、脑利钠肽(BNP)、C 反应蛋白(CRP)、白细胞(WBC)、红细胞(RBC)、血红蛋白(Hb)、血小板(PLT)、活化部分凝血酶时间(APTT)、凝血酶原时间(PT)、纤维蛋白原(FIB)、丙氨酸氨基转移酶(ALT)、天门冬氨酸氨基转移酶(AST)、尿素氮(BUN)、肌酐(Cr),主动脉CTA 表现:有无内膜破口、有无血栓、有无外壁钙化、窦部是否受累、累及分支血管数量、假腔范围[将主动脉根据重要分支血管分为4 个段,升主动脉到主动脉弓段(①段受累)、主动脉弓到腹腔干段(②段受累)、腹腔干到肾动脉段(③段受累)、肾动脉到髂动脉段(④段受累),以上分段受累=1,未受累=0,总范围按累计段数赋值],心脏彩超表现:主动脉瓣有无累及、主动脉瓣反流程度(无=0,轻度=1,中度=2,重度=3),左室射血分数(LVEF)值,升主动脉直径,有无心包积液。
1.3 统计学处理 采用SPSS 21.0 软件对所得数据进行统计分析,符合正态分布的计量资料用()表示,组间比较采用两独立样本的t 检验;非正态分布计量资料采用M(P25,P75)表示,组间比较采用非参数检验;计数资料以率(%)表示,比较采用χ2检验;根据两组间单因素分析的结果,将差异有统计学意义的研究因素进一步行多因素logistic 回归分析,采用基于最大似然估计的向前逐步回归法(Forward:LR 法),最后一步是最终筛选进入模型的变量和其参数,最终进入模型的是有统计学意义;建立死亡风险预测模型,采用Homser-Lemeshow 进行拟合优度检验,绘制受试者工作特征曲线(ROC)对该模型预测AAD 患者发生院内死亡风险的性能进行评价。以P<0.05 为差异有统计学意义。
2 结果
2.1 基本临床特征 本组87 例AAD 患者,Stanford分型,A 型34 例(39.08%),B 型53 例(60.92%);根据Debakey 分型,Ⅰ型32 例(36.78%),Ⅱ型2 例(2.30%),Ⅲ型53 例(60.92%)。本组院内死亡共38 例,死亡率43.69%。按照住院期间是否死亡分为存活组和死亡组,两组性别、年龄、高血压病史、糖尿病病史、马凡/外伤/梅毒史比较,差异均无统计学意义(P>0.05),具有可比性。见表1。
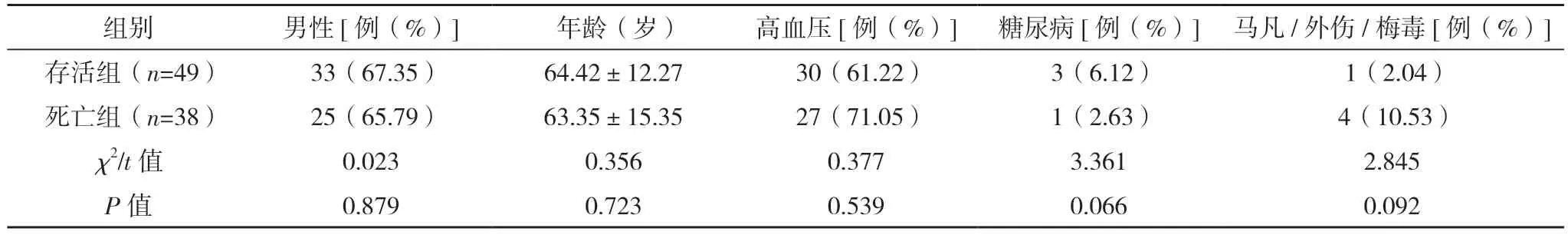
表1 两组基本临床特征比较
2.2 AAD 患者保守治疗院内死亡危险因素的单因素分析 将死亡组和存活组入院生命体征、实验室指标首次测定值、主动脉CTA 表现、心脏彩超表现进行单因素分析,死亡组WBC、PT、有内膜破口、窦部受累、累及分支血管数量、假腔范围、升主动脉到主动脉弓段(即①段)受累、主动脉瓣受累、主动脉瓣反流程度、升主动脉直径、有心包积液例数明显高于存活组,入院收缩压和舒张压(较多患者入院休克)、PLT 明显低于存活组,差异均有统计学意义(P<0.05)。见表2~5。
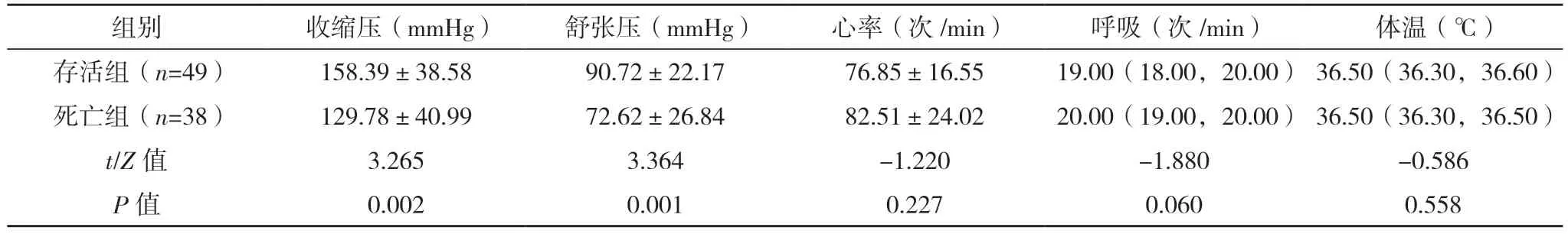
表2 两组入院生命体征比较
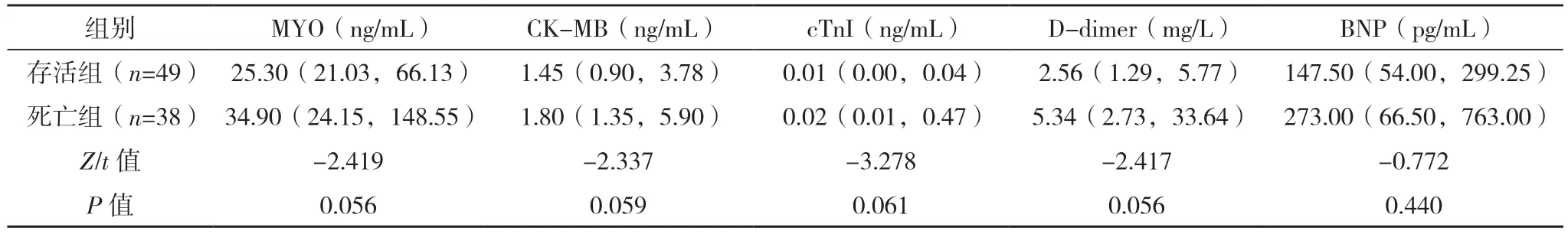
表3 两组实验室指标首次测定值比较
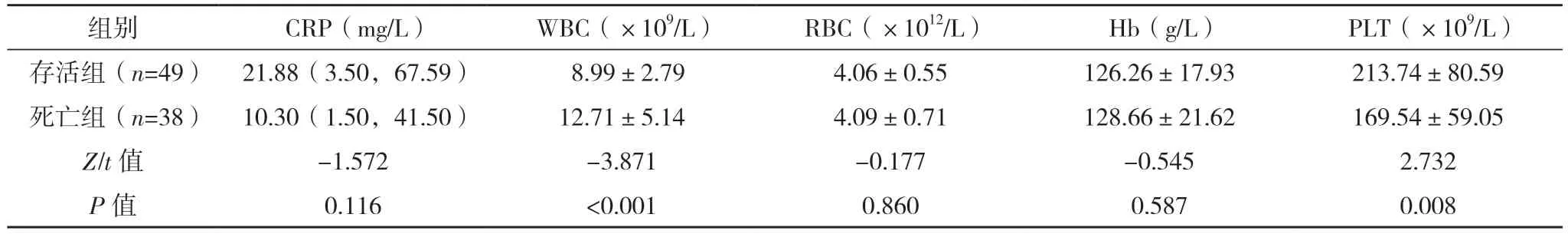
表3 (续)
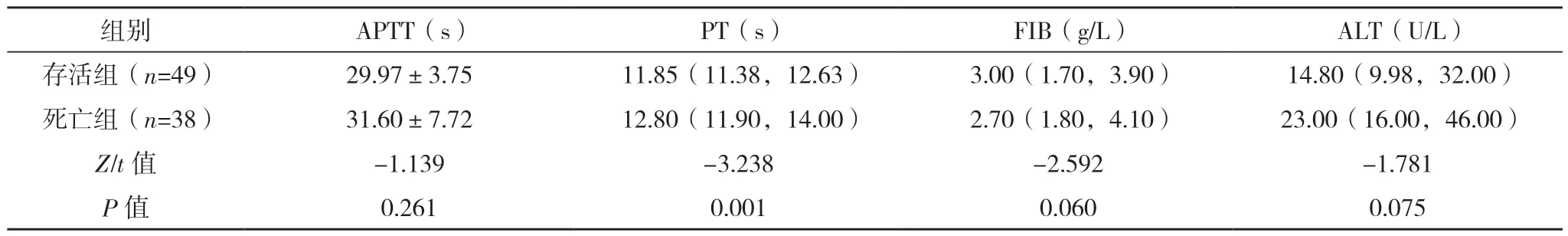
表3 (续)

表3 (续)

表4 两组主动脉CTA检查结果比较

表4 (续)
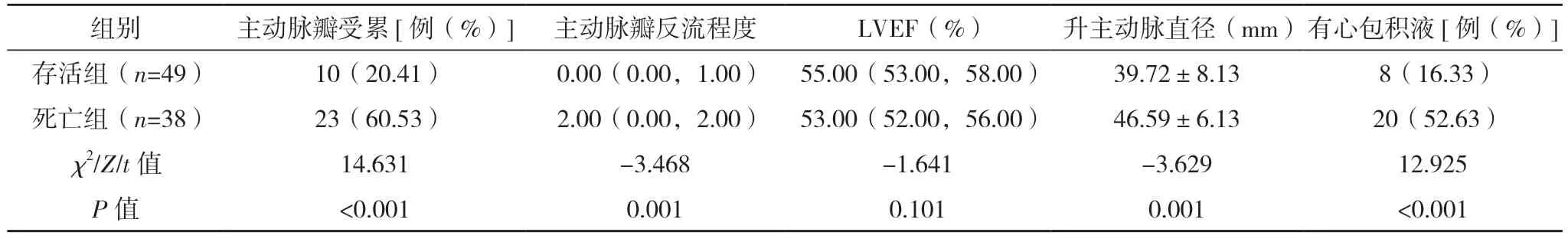
表5 两组心脏彩超检查结果比较
2.3 AAD 患者保守治疗院内死亡危险因素的多因素分析 将上述单因素分析有统计学意义的14 项研究指标进行赋值,见表6。采用logistic 回归的向前逐步回归法(Forward LR)对变量进行筛选,建立二分类logistic 回归模型,结果显示,累及分支血管数量、假腔范围、①段受累均是AAD 患者保守治疗院内死亡的独立危险因素(P<0.05),见表7。得到预测模型公式:logP=-6.698+0.749×累及分支血管数量+1.437×假腔范围+2.748×升主动脉到主动脉弓段受累。采用Homser-Lemeshow 进行拟合优度检验,结果显示χ2=2.325,P=0.940,表明该模型可以很好的拟合。
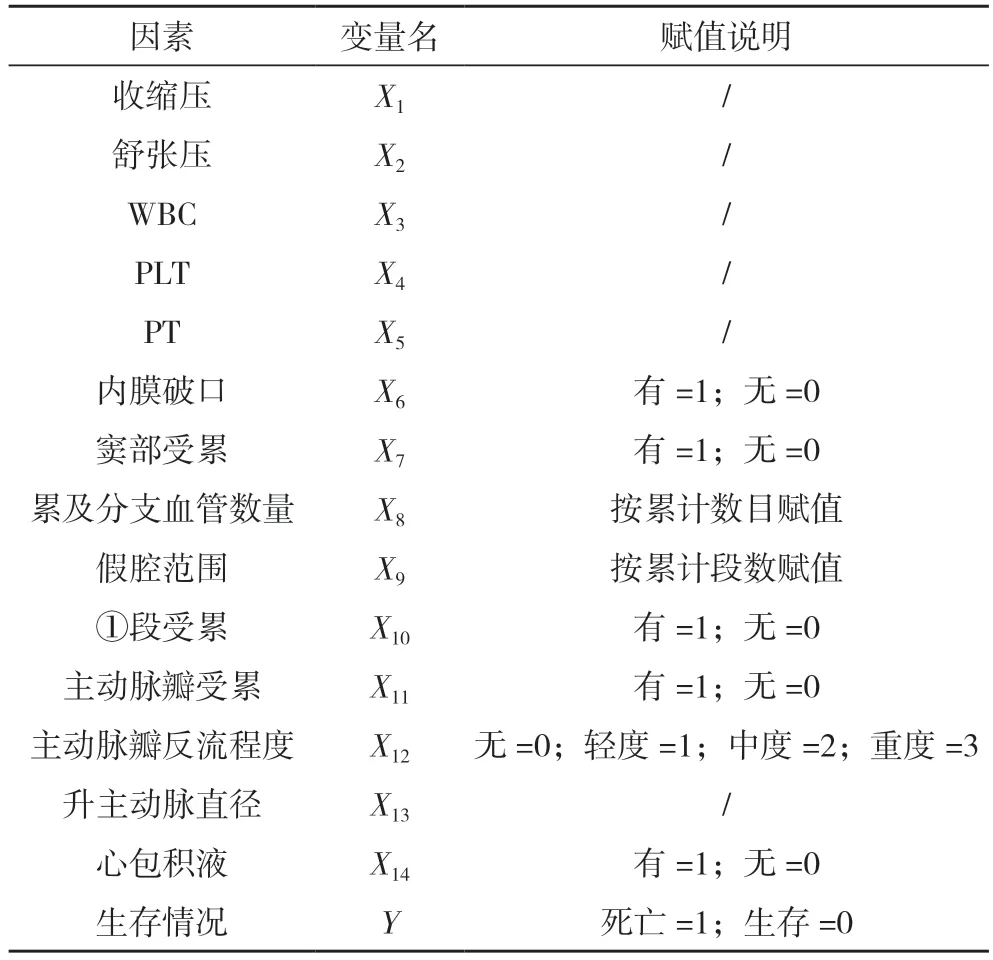
表6 AAD患者保守治疗院内死亡危险因素的赋值情况
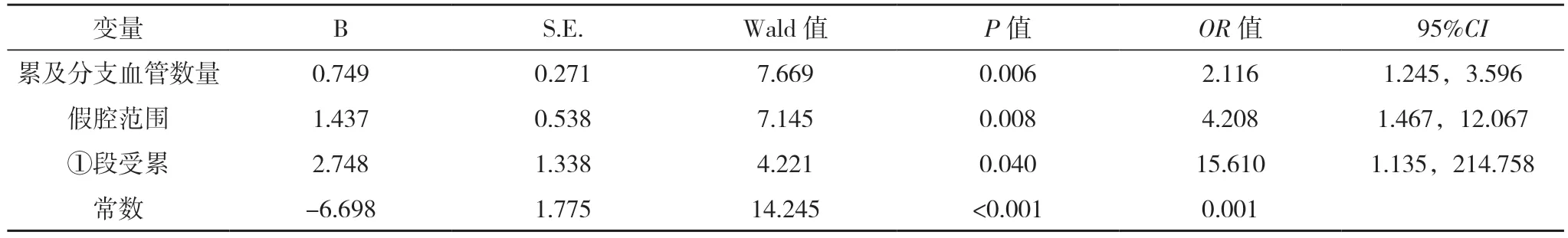
表7 AAD患者保守治疗住院期间死亡风险的多因素logistic回归分析
2.4 ROC 曲线分析 根据logistic 回归模型,得到预测概率,绘制ROC 曲线,曲线下面积为0.924,95%CI(0.863,0.984),P<0.01,敏感度为76.92%,特异度为90.70%,见图1。
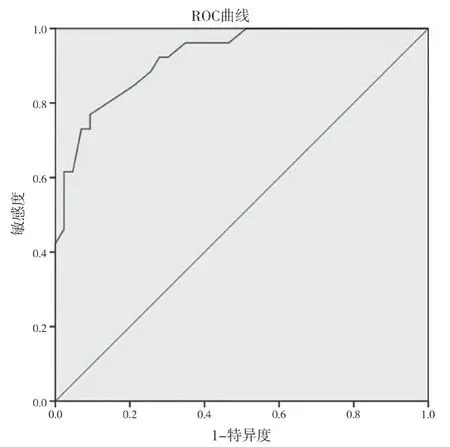
图1 模型预测AAD保守治疗患者院内死亡的ROC曲线图
3 讨论
AAD 是公认的外科急危重症,发病率有逐年上升的趋势[4-5],且漏诊误诊率高[6],如果治疗延误死亡率将会明显升高。随着医疗水平的提高,对于AAD 患者的治疗也有了相当大的进展。大量研究表明,手术或介入治疗是治疗AAD 最直接有效的手段[7-8],但仍有较多患者因为各种原因无法进行手术治疗。主动脉夹层发病的危险因素较多[9-11],尽早估测患者预后,明确相关危险因素有很大的临床意义[12]。本研究共纳入87 例药物保守治疗的AAD患者,院内死亡人数共38 例,死亡率达43.69%,死亡组和存活组基本临床资料比较,差异均无统计学意义(P>0.05)。本组病例根据患者的临床资料,通过单因素及多因素logistic 回归分析,对14 个可疑研究因素进行评价,发现累及分支血管数量、假腔范围、升主动脉到主动脉弓段受累均是AAD 患者保守治疗院内死亡的独立危险因素(P<0.05)。
AAD 患者发生夹层病变时,血流通过主动脉血管长轴方向扩展,向远端撕裂,可直接延伸至主动脉的各个重要分支血管,影响分支血管向对应的器官、肢体供血,严重时可导致严重的脑、内脏、肾、脊髓和四肢缺血,甚至坏死[13]。研究表明,脏器低灌注综合征是预测急性主动脉夹层患者病死率的重要危险因素[14-16]。本研究统计分析也提示,夹层累及的分支血管数量是药物保守治疗的AAD 患者独立危险因素,累及分支血管数目越多,受影响的器官越多,预后越差,保守治疗难以解决受累分支血管的血供问题,因此,有手术条件的分支血管受累患者,依然推荐尽早行手术治疗。
笔者既往的研究也发现,通过多层螺旋CTA 影像学能判断AAD 患者夹层撕裂的严重程度,AAD患者假腔撕裂范围越大,病情越重,预后越差[17]。本研究结果与既往研究一致。对于药物保守治疗的AAD 患者,假腔撕裂的问题没有得到根本解决,如果血压控制不稳,假腔撕裂范围可能逐渐增大,受累的部位也会越多,造成主动脉纵隔血肿,心包腔、胸腔积液或积血等,甚至可能影响分支血管血供,可出现脑缺血、脑梗死、肠缺血坏死、肾衰竭、肢体缺血坏死等严重并发症,危及患者生命。
主动脉夹层根据升主动脉是否受累分为A、B两种类型。本组病例研究表明,升主动脉到主动脉弓段受累是AAD 患者保守治疗院内死亡的独立危险因素,也就是说,保守治疗的患者A 型死亡风险要高于B 型。夹层累及升主动脉,血肿范围可进一步扩大,有发生心包填塞的风险,Stanford A 型患者病情凶险,并发心包积液、心力衰竭和意识障碍的发生率和死亡率均较Stanford B 型患者为高[18]。手术封闭撕裂的破口是最有效的治疗方法[19-20]。研究表明,对于A 型患者,接受手术治疗的住院死亡率明显低于接受保守治疗的患者,A 型夹层患者比B型夹层患者的预后差,这与文献[21]研究结果一致。因此,对于升主动脉到主动脉弓段受累的患者,保守治疗预后差。
本研究对AAD 患者保守治疗的临床资料进行总结,分析院内死亡危险因素,建立了AAD 患者院内死亡风险预测模型,ROC 曲线分析表示,此模型有较好的敏感度(76.92%)及特异度(90.70%),有利于临床医生尽早地判断患者预后,对于高死亡风险患者,临床医师应采取更为积极主动的治疗决策,及时评估患者的疾病进展,以减少患者的死亡风险。然而,本研究也存在回顾性分析的局限性,且样本量较小,为AAD 患者构建更准确的死亡风险预测模型,需要进一步扩大样本,多个医疗中心共同研究。

