经皮耳甲迷走神经刺激对难治性抑郁症的即刻脑效应研究
王智,何家恺,2,孙继飞,马跃,郭春蕾,洪洋*,方继良
1.中国中医科学院广安门医院放射科,北京 100053;2.中国中医科学院针灸研究所,北京 100700;*通信作者 洪洋 hongyang671129@126.com
抑郁症已成为国际第二大致残疾病,据世界卫生组织预测,到2030年,抑郁症将成为世界第一经济负担的疾病[1]。目前对抑郁症的治疗以药物为主,但将近1/3的患者经过多种规范药物治疗,症状仍得不到缓解,称为难治性抑郁症(treatment-resistant depression,TRD)[2]。多种物理疗法已应用于TRD的治疗中,如电刺激迷走神经耳支的新技术,又称为经皮耳甲迷走神经刺激术(transcutaneous auricular vagus nerve stimulation,taVNS)[3]。本课题组前期研究发现,taVNS治疗抑郁症有效[4],进一步观察到taVNS对维持药物治疗的TRD患者具有明显的增效作用[5],但其神经影像机制尚不明确。度中心度(degree centrality,DC)是一种基于图论的分析方法,已广泛应用于脑功能影像研究[6-8]。本研究将采用DC分析方法,初步比较taVNS即刻刺激TRD患者和健康志愿者前后的脑功能差异,为taVNS应用于TRD的长期治疗提供科学依据,阐明其疗效脑功能机制。
1 资料与方法
1.1 研究对象 纳入2018年9月—2020年1月在中国中医科学院广安门医院心身医学科、宣武医院神经内科、清华大学玉泉医院精神科门诊就诊的34例TRD患者进行前瞻性研究。纳入标准:①参照Sackeim[9]的诊断标准,2种或2种以上足量、足疗程的抗抑郁药治疗无效的抑郁症患者,入组之前的抗抑郁治疗已经稳定6周以上;②年龄18~70岁;③右利手;④汉密尔顿抑郁量表(17-item Hamilton depression scale,HAMD-17)总分>17分;⑤临床查体和实验室检查无明显异常。排除标准:①合并其他精神障碍和神经系统疾病;②严重冲动、自杀倾向或自伤风险高;③近6个月有酒精和药物依赖;④妊娠和哺乳期女性;⑤有MRI检查禁忌证。
同期经广告招募的34例身心健康者,并通过第5版《精神障碍诊断与统计手册》[10]非患者版的结构化访谈合格者。纳入标准:①年龄18~70岁;②右利手;③HAMD-17总分<7分;④既往无精神疾病史;⑤临床查体和实验室检查无明显异常,无MRI检查禁忌证。
本研究通过中国中医科学院广安门医院伦理委员会批准(批准号:2017-021-SQ),受试者均签署知情同意书,均在广安门医院参加脑MR扫描及taVNS治疗。
1.2 方法 本研究中的方法参考本课题组前期研究[11],具体如下。
1.2.1 刺激方法 耳甲部经75%酒精常规消毒后,耳夹表皮电极分别置于双侧耳甲处,再连接治疗仪(SDZ-IIB,江苏苏州医疗仪器公司),然后打开刺激仪开关后,设置治疗参数为:疏密波,频率4/20 Hz,调节电流强度,以能耐受又不引起疼痛为宜,既往经验显示为4~8 mA,每次持续刺激30 min。TRD组与对照组刺激参数、时间均一致。
1.2.2 量表评定 本研究采用HAMD-17、汉密尔顿焦虑量表(hamilton anxiety scale,HAMA)、抑郁自评量表(self-rating depression scale,SDS)、焦虑自评量表(self-rating anxiety scale,SAS),对患者的抑郁和焦虑症状进行评估;采用冗思反应量表(ruminative response scale,RRS)评估抑郁性冗思的严重程度。
1.2.3 MRI数据采集 所有受试者均参加脑部MR扫描(Magneton Skyra 3.0T,西门子公司),采用20通道头颈联合线圈。扫描全程中受试者均保持静息状态。首先进行T2WI MRI平扫,以排除脑器质性病变。脑功能MR数据采集方法:先行3D T1WI脑结构像扫描,具体参数:TR 2 530 ms,TE 2.98 ms,视野256 mm×256 mm,层厚1.0 mm,层间距0 mm,层内分辨率256×192,翻转角7°;然后采用血氧水平依赖序列(BOLD,GRE-EPI)采集脑功能影像数据,具体参数:TR 2 000 ms,TE 30 ms,翻转角90°,层厚3.5 mm,层间隔0.6 mm,层数32层,视野224 mm×224 mm,层间分辨率64×64。TRD组、对照组均在刺激前及刺激后即刻(刺激完约3 min内)各扫描1次功能MRI,扫描序列、相关参数与TRD组一致。
1.2.4 数据预处理 基于MATLAB(版本号R2020a)平台和DPABIV4.3(http://rfmri.org/DPABI),对采集的静息态功能磁共振成像数据进行预处理。具体步骤:对医学数字成像和通信格式数据进行转换,再剔除10个时间点数据,然后行时间校正、头动校正(在x、y、z 3个方向上的平移不能超过1.5 mm,运动旋转不能超过1.5°,否则要求重新扫描)、再使用联合分割算法,将配准后的结构像进行分割,配准到平均模板上,去除脑白质、脑脊液等协变量因素后,进行空间标准化(3 mm×3 mm×3 mm)、选用4 mm全宽半高高斯平滑核进行空间平滑以提高信噪比、再进行去线性漂移及在0.01~0.1 Hz频段进行滤波。
1.2.5 DC值分析 对上述预处理图像数据进行分析计算:提取每个体素的时间序列,计算与全脑其他体素之间的Pearson相关系数,r阈值取0.25;再将上述相关系数进行Fisher-Z转化,以提高正态性;对每个体素,DC的计算为该体素与全脑所有其他体素有显著功能连接的相关性权重总和,以得到每个受试者的DC图。
1.3 统计学分析 采用SPSS 25.0软件,计数资料采用χ2检验。符合正态分布的计量资料采用±s表示,两组比较采用独立样本t检验;不符合正态分布的数据用M(Q1,Q3)表示,组间比较采用秩和检验。P<0.05表示差异有统计学意义。
采用DAPBI软件中的统计模块对DC图进行统计分析,所有受试者的平均头动均<0.5,统计时将年龄、性别、受教育程度作为协变量纳入统计,以减少混杂因素对结果的影响。比较刺激前TRD组与对照组DC图的差异脑区;利用DAPBI软件中图片计算功能计算两组刺激前后的DC图,获得两组刺激前后的减值图(刺激后-刺激前;ΔDC);比较两组刺激前后的差异脑区;提取差异脑区的TRD组刺激前后、对照组刺激前后的DC值进行事后分析,对结果采用Benferroni校正,以P<0.016为差异有统计学意义;上述差异脑区均定义为经高斯随机场校正(Gaussian random field,GRF)校正后(以体素水平阈值P<0.01,簇水平P<0.05定义为差异脑区)的脑区。进一步分别将TRD组、对照组刺激后DC值减去刺激前的DC值,分别获得两组刺激前后的ΔDC值,然后将两组的ΔDC值分别与HAMD-17、HAMA、SDS、SAS、RRS评分进行Pearson相关性分析,以P<0.05为差异有统计学意义。
2 结果
2.1 一般资料 TRD组与对照组年龄、性别、受教育程度差异均无统计学意义(P>0.05)。TRD组的HAMD-17、HAMA、SDS、SAS评分均明显高于对照组(P<0.001)(表1)。
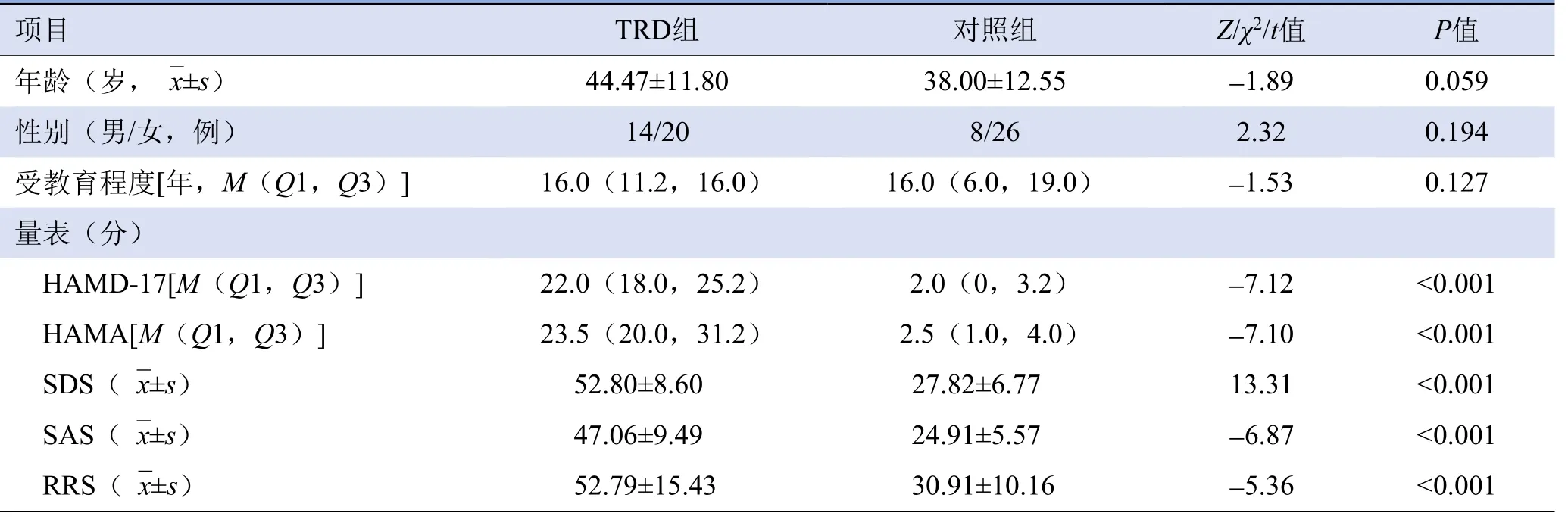
表1 TRD组与对照组的临床特征比较
2.2 DC分析 与对照组比较,TRD组左侧海马旁回/杏仁核/伏隔核、双侧背外侧前额叶(左侧额中回、右侧额中回/额上回)DC值较高、左侧枕中回/枕上回DC较低(表2,图1)。两组ΔDC在额叶前扣带回膝部/眶回内侧部存在差异(表2,图2)。事后分析结果显示,TRD组和对照组刺激前的DC值分别为-0.116±0.329 和-0.384±0.305,刺激后分别为-0.289±0.225和-0.159±0.446,TRD组刺激前DC值高于对照组(t=2.531,P=0.014),TRD组刺激后DC值明显低于刺激前(t=-4.029,P=0.000 3);对照组刺激前后DC值比较,差异无统计学意义(t=1.750,P=0.088)。
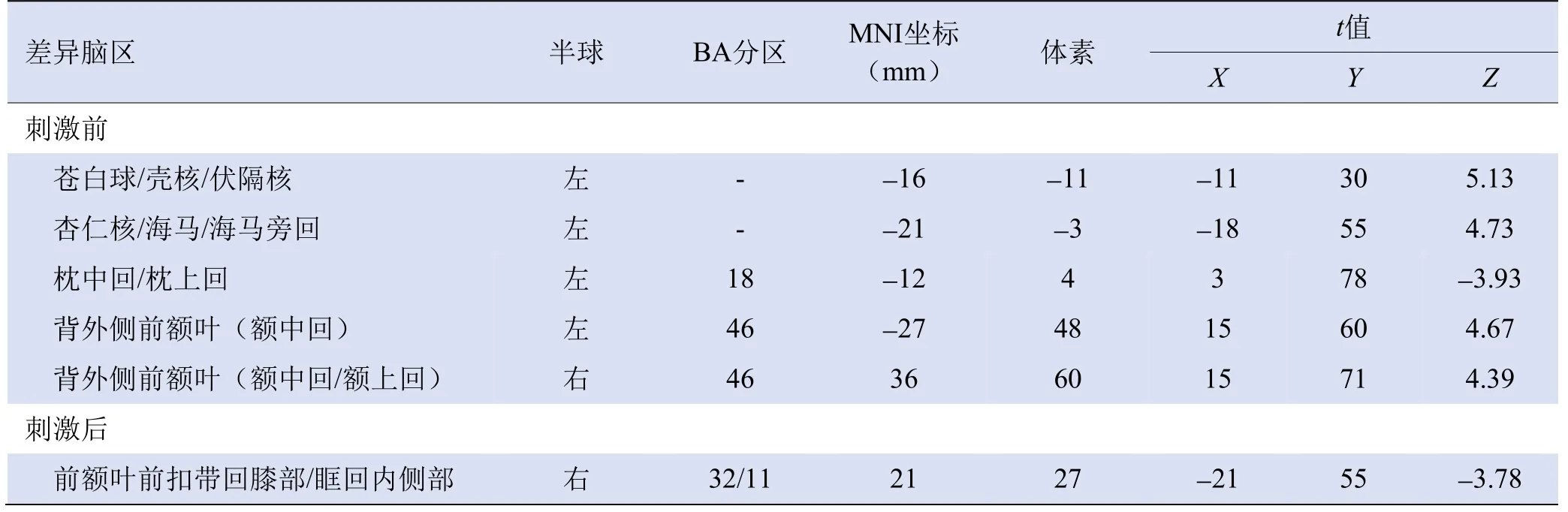
表2 TRD组与对照组刺激前后差异脑区
2.3 相关性分析 TRD组在前额叶前扣带回膝部/眶回内侧部刺激前后的ΔDC值与SDS(r=-0.389,P=0.023)、RRS评分呈负相关(r=-0.132,P=0.042);而与HAMD-17、HAMA、SAS评分无相关性(P>0.05);对照组在该脑区的DC差值与HAMD-17、HAMA、SDS、SAS、RRS评分均无相关性(P均>0.05)。
3 讨论
DC又称为功能连接强度,若某个像素或某个脑区与全脑连接发挥的枢纽作用越强,则该处DC值越高,因此常用于揭示脑网络的核心枢纽脑区[12]。本研究发现TRD患者在左侧海马旁回/杏仁核/伏隔核、双侧背外侧前额叶(左侧额中回、右侧额中回/额上回)的DC值较高、左侧枕中回/枕上回明显低于对照组;在taVNS刺激后,TRD组与对照组相比在前额叶前扣带回膝部/眶回内侧部存在明显差异,在该脑区治疗前TRD组的DC值高于对照组,TRD组刺激后明显低于刺激前,且TRD的ΔDC差值与SDS、RRS评分呈负相关。
3.1 TRD存在情绪、奖赏及认知障碍相关脑区功能异常 抑郁症是抑郁障碍的一种典型症状,伴有显著情感、认知障碍;情感障碍常表现为心境低落、兴趣减退、甚至出现快感缺失[13]。荟萃分析显示抑郁症患者的大脑灰质体积和功能较健康者存在明显差异,特别是在杏仁核、壳核、苍白球、丘脑、海马等脑区[14];其中杏仁核是情绪反应的关键脑区,通过与海马的共同作用,调节人类对外显情绪的学习和记忆;伏隔核、苍白球、壳核是奖赏环路的重要组成部分,与快感缺失密切相关[15-17]。功能MRI研究证明杏仁核、海马的功能损伤与抑郁症的负性情绪有关[18]。本研究发现TRD患者在苍白球/壳核/伏隔核、杏仁核/海马/海马旁回DC值较高;结合既往研究结果,进一步佐证了本研究的观点:TRD除情绪相关脑区功能异常外,奖赏环路也存在功能异常。
另外,抑郁症患者在经历反复的负性情绪刺激之后,会逐渐出现认知障碍包括执行能力、视觉信息处理、语言流畅性等方面[19]。研究显示当边缘系统特别是杏仁核受到负性刺激之后,可导致前额叶正确识别情绪的能力下降,从而导致抑郁症患者出现自下而上的认知偏差[20]。有研究发现背外侧前额叶主导的认知控制功能障碍与情绪和发作次数有关[21]。背外侧前额叶作为认知控制网络的核心脑区,参与高级认知任务,当该脑区功能出现异常时可导致自上而下的认知异常,进一步加重情绪障碍[22]。本研究发现TRD患者在背外侧前额叶DC值较高,进一步说明TRD患者也存在认知相关脑区功能异常,这有可能与TRD患者反复经历负性情绪刺激有关。枕叶是视觉信息处理和言语情节记忆关键脑区[23]。多个研究发现抑郁症患者枕叶存在结构、功能异常[24];本研究发现TRD患者左侧枕中回视中枢DC值较低,这也可能与TRD患者存在复杂脑网络异常有关。
3.2 taVNS对情绪相关脑区有即刻调节作用 前扣带回协调杏仁核等边缘脑区以及眶额回等高级脑区在情绪加工中具有重要作用,前扣带回膝部(the rostral anterior cingulate,rACC)位于扣带回前背部[25]。Webb等[26]和Pizzagalli等[27]发现抑郁症患者中rACC活性较低,可通过提高rACC活性以增加抗抑郁疗效。Ge等[28]发现TRD患者在治疗前rACC与右侧背外侧前额叶功能连接(functional connectivity,FC)较低,与左侧外侧前额叶FC较高,在12个月的经颅磁刺激治疗后rACC与全脑的FC与健康人无异。Tu等[29]发现经过4周taVNS治疗后rACC与双侧内下丘脑FC降低,且FC的变化与HAMD-17评分降低有关。Mkrtchian等[30]发现氯胺酮可以改善TRD尾状核与前额叶(前扣带回、眶额回)、尾状核与左背外侧前额叶、右侧腹外侧前额叶FC,进而改善TRD情感及认知障碍。本研究发现经30 min的taVNS治疗后,TRD患者rACC/眶额回内侧部DC值较前明显降低,且ΔDC与SDS评分呈负相关;既往研究也发现奖赏与主观愉悦体验主要刺激眶回内侧部[31],由此可推测taVNS可通过rACC/眶回内侧部调节TRD的负性情绪处理过程。本研究还发现TRD患者在刺激后rACC的DC值变化与RRS评分成反比;有研究提出rACC功能异常可能会导致情绪失调和持续性反刍[32],rACC可通过协调默认网络和认知控制网络正常发挥作用减少冗思行为[33]。结合Fang等[34]发现,taVNS对TRD患者的冗思反应可能也有一定的调节作用。因此,笔者推测长期多次的taVNS刺激可能推动负性情绪相关症状改善,甚至可能进一步改善TRD认知功能;但本研究仅发现taVNS对rACC/眶回内侧的DC有即刻调节作用,没有其他治疗方法的作用范围广;其次taVNS对对照组rACC/眶回的变化方向与TRD组不一致,这可能与taVNS刺激的特征有关:单次短时间的刺激很难引起广泛脑区的功能改变,特别是离孤束核较远的脑区[35];rACC/眶回的功能是taVNS抗抑郁作用的重要指标,这也可能是taVNS对TRD的调节作用与健康人不一致的原因。
本研究证实,TRD患者存在静息状态下多个与情绪异常、奖赏缺陷和认知功能损害有关的脑网络节点;经过30 min的taVNS治疗后,即刻调节了rACC/眶额叶内侧部度中心度,表明taVNS对情绪重要调控脑区存在即刻激发效应,这也为采用taVNS长期治疗抑郁症达到疗效提供了科学基础。
本研究的局限性:①样本量相对较小,仅为探索taVNS对TRD的即刻调节作用的初步研究,未来仍需进一步扩大样本进行深度挖掘;②DC主要用于描述某一脑区或某一脑网络的节点重要性,并不能完整地揭示TRD其他异常脑活动特征,在未来的研究中还需结合多种分析方法,全面探讨taVNS治疗TRD的脑效应机制。

