三阴性乳腺癌与Luminal A型乳腺癌的MRI背景实质强化差异比较
罗红兵,杨定彬,王春华,刘圆圆,周鹏,任静*
1.电子科技大学医学院附属肿瘤医院,四川省肿瘤医院肿瘤研究所放射科,四川 成都 610041;2.乐山市人民医院,四川 乐山614000;*通信作者 任静 renjennycd@163.com
乳腺癌是女性最常见的恶性肿瘤,根据不同免疫组化表型分为Luminal A、Luminal B、人类表皮生长因子受体-2(human epidermal growth factor receptor type 2,HER2)过表达及三阴性乳腺癌(triple negative breast cancer,TNBC)[1]。不同分子分型乳腺癌的临床治疗策略与预后均存在巨大差异,其中TNBC的侵袭性最强、预后最差、治疗方法最少,Luminal A型预后相对最好[1-4]。乳腺背景实质强化( background parenchymal enhancement,BPE)是正常乳腺腺体组织在注射造影剂后的磁共振成像增强。在MRI检查中,乳腺癌的BPE特征对其检测和诊断均具有重要意义,而BPE受乳腺血供分布、激素变化水平、内分泌治疗和放射治疗等影响[5-6]。近年BPE与乳腺癌发生以及分子分型的关系逐渐成为研究热点[7-11]。如果能通过手术前MRI特征分析,对TNBC和Luminal A型进行更精准的诊断和预测,将有利于临床医师进行更准确的术前评估和选择个性化的治疗策略。本研究拟比较TNBC和Luminal A型乳腺癌术前MRI双侧乳腺BPE的差异,探讨依据乳腺BPE鉴别两种不同类型乳腺癌分子分型的可行性,以期为临床提供更精准的影像诊断信息。
1 资料与方法
1.1 研究对象 回顾性收集2017年9月—2019年6月四川省肿瘤医院收治的乳腺癌病例,纳入标准:①经手术后病理确诊为浸润性乳腺癌,且分子分型为TNBC和Luminal A型;②术前1周内在本院接受MRI检查并具有完整的MRI资料。排除术前同侧乳腺病灶已接受手术、放射治疗、化学治疗、激素及靶向等治疗者。最终纳入114例乳腺癌患者,免疫组化诊断:TNBC 67例,Luminal A型47例,所有患者均为女性。本研究经本院伦理委员会审核通过(审批号SCCHEC 2015029),所有患者均签署知情同意书。
1.2 MRI 检查 使用3.0T MR 扫描仪(Skyra,Siemens),专用16通道双侧乳房相控线圈。患者取俯卧位,头先进,双侧乳房自然悬垂于线圈内。扫描范围包括双侧乳腺组织及腋窝,扫描序列,①平扫轴位和矢状位T2WI扫描:使用TIRM序列,扫描参数:TR 3 570 ms,TE 70 ms,层厚4.0 mm,层间隔1.5 mm,视野340 mm×340 mm,采集矩阵358×448,总采集时间3 min 29 s。②轴位扩散扫描:使用Resolve-DWI,扫描参数:TR 5 700 ms,TE 66 ms,b值取0、800 s/mm2。③动态增强多期MRI扫描:采用超快速并行采集技术、水脂分离压脂技术和时间分辨交叉随机轨迹成像技术的容积插入法屏气扫描检查(VIBE),即CDT-VIBE序列,扫描参数[12]:TR 5.64 ms,TE 2.46/3.69 ms,视野360 mm×360 mm,矩阵224×179,采用无间隔扫描,翻转角10°,共采集图像26期,总采集时间6 min。④轴位薄层高分辨增强延迟期扫描:采用轴位VIBE序列,扫描参数:TR 4.1 ms,TE 1.6 ms,视野320 mm×320 mm,矩阵448×358,翻转角10°。按0.1 mmol/kg注射对比剂钆双胺注射液,流速2.5 ml/s,然后以相同流速注射生理盐水15 ml。
1.3 MRI特征分析及双侧BPE评价 由2名从事乳腺影像诊断的高年资医师采用盲法对所有病例的动态增强最后一期薄层高分辨图像[13]进行病灶同侧和对侧BPE评价,意见不统一时协商达成一致。依据乳腺影像报告和数据系统标准,结合乳腺MR检查及诊断规范专家共识[14],将BPE类型分为几乎不强化(增强腺体约占所有腺体<25%)、轻微强化(增强腺体约占所有腺体25%~50%)、中度强化(增强腺体约占所有腺体51%~75%)和显著强化(增强腺体约占所有腺体76%~100%)。在纳入病例中,2例患者既往已接受对侧乳房全切术,故未评价其病灶对侧BPE情况。同时评价病灶类型(肿块和非肿块样强化区域)和病灶乳腺纤维腺体组织构成分类(几乎全脂肪类、散在纤维腺体类、不均质纤维腺体类和绝大部分纤维腺体类),并在MRI图像上测量病灶长径和短径。
1.4 病理及免疫组化检查 提取每例患者的基本病理及免疫组化资料,并根据雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)、HER2表达情况和Ki-67水平,将乳腺癌分为TNBC组(ER阴性、PR阴性、HER2阴性)和Luminal A组(ER阳性、PR阳性、HER2阴性且Ki-67<14%)[1]。
1.5 统计学方法 采用SPSS 20.0软件,符合正态分布的计量资料以±s表示,两组间比较采用独立样本t检验;计数资料以例数或百分比表示,组间比较采用χ2检验。使用Kappa检验比较乳腺癌病灶同侧和对侧BPE的一致性。P<0.05表示差异有统计学意义。
2 结果
2.1 两组患者基本临床资料及病理资料比较 67例TNBC患者年龄35~76岁,47例Luminal A型乳腺癌患者年龄35~78岁。两组肿瘤细胞分级差异有统计学意义(χ2=37.521,P=0.000),其余各项临床及病理特征差异均无统计学意义(P>0.05),见表1。

表1 两组乳腺癌患者基本临床及病理特征比较
2.2 病灶同侧和对侧BPE一致性 Luminal A型乳腺癌对侧BPE和同侧BPE的一致性较好(Kappa=0.799,P=0.000)。TNBC对侧和同侧BPE的一致性一般(Kappa=0.474,P=0.000)。
2.3 TNBC组与Luminal A组病灶对侧、同侧BPE比较两组病灶对侧不同类型BPE分布差异无统计学意义(χ2=0.730,P=0.694),但两组病灶同侧不同类型BPE分布差异有统计学意义(χ2=6.951,P=0.031),见图1、2。TNBC组病灶MRI测量病灶长径和短径均显著大于Luminal A组(t=5.652、6.336,P=0.000);两组病灶类型和乳腺纤维腺体组织不同类型分布差异均无统计学意义(P>0.05),见表2。
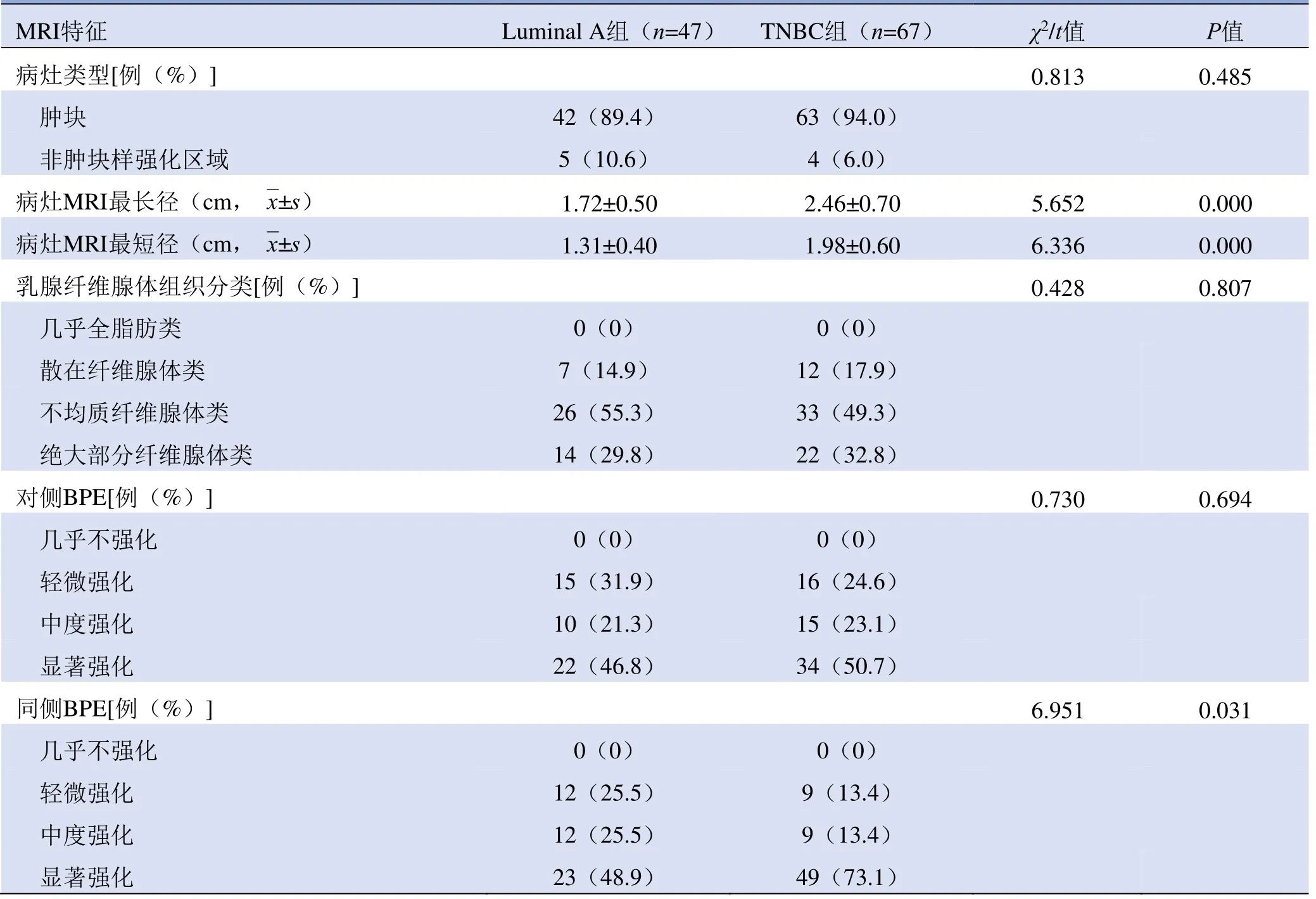
表2 两组乳腺癌患者基本MRI特征及双侧BPE比较

图1 女,64岁,已绝经,右乳非特殊类型浸润性癌II级。肿瘤细胞免疫表型:ER(>90%++),PR(90%++),CerbB-2(++),Ki-67(10%)。FISH基因未扩增。分子分型为Luminal A型。A为增强扫描后病灶层面MRI图像;B为增强扫描后相同序列MRI图像,显示同侧BPE和对侧BPE类型一致且均为轻微强化
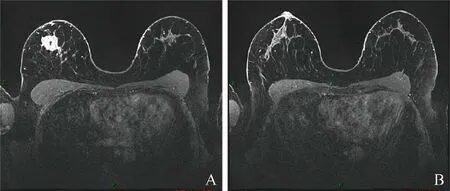
图2 女,54岁,已绝经,右乳非特殊类型浸润性癌III级伴坏死。肿瘤细胞免疫表型:ER(-),PR(-),CerbB-2(0),Ki-67(55%+)。分子分型为TNBC。A为增强扫描后病灶层面MRI图像;B为增强扫描后相同序列MRI图像,显示同侧BPE为显著强化,对侧BPE为轻微强化
2.4 不同月经状态时病灶对侧及同侧BPE比较 未绝经组和绝经组乳腺癌患者病灶对侧不同类型BPE分布差异有统计学意义(χ2=17.284,P=0.000),未绝经组显著强化BPE类型占65.7%(44/67),绝经组占26.7%(12/45)。未绝经组和绝经组患者病灶同侧BPE类型分布差异有统计学意义(χ2=6.951,P=0.031),其中未绝经组患者显著强化BPE类型占比70.1%(47/67),绝经组占比53.2%(25/47),见表3。
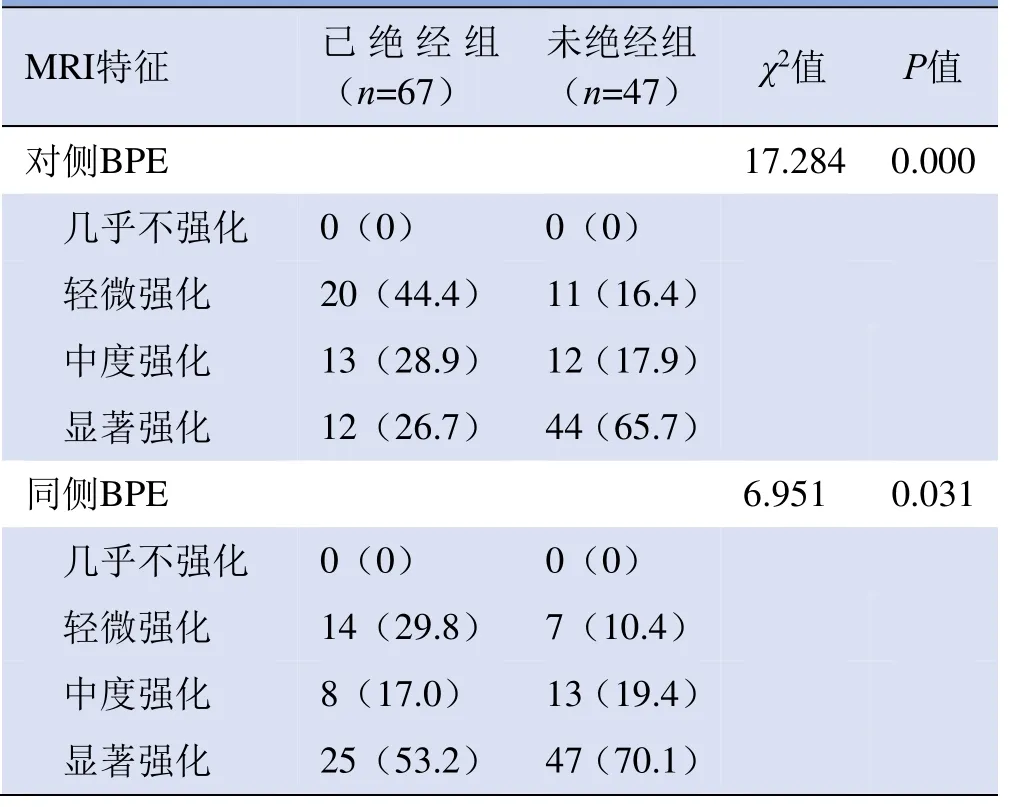
表3 114例乳腺癌患者绝经前后双侧BPE比较
3 讨论
乳腺癌是全球发病率最高的恶性肿瘤[15-16],也是一种高度异质性肿瘤,不同分子分型的乳腺癌影像特征、临床治疗策略及预后等均存在很大差异[17-18]。TNBC是ER和PR阴性且HER2无扩增的一种乳腺癌分子类型,其侵袭性强且有效治疗方法较少,是乳腺癌预后最差的分子类型。Luminal A型是ER和PR均为阳性且Ki-67低表达及HER2无扩增的一种乳腺癌分子类型,临床预后相对最好[19]。在乳腺癌的影像评价方法中,MRI是一种形态与功能结合的检查方法[20],其临床应用越来越广泛。本研究结果显示,TNBC和Luminal A型乳腺癌病灶同侧不同类型BPE分布存在显著差异,其中TNBC同侧显著强化BPE类型占比高于Luminal A型,但两组病灶对侧不同类型BPE分布无显著差异。
既往关于BPE与乳腺癌分子分型的相关性存在争议。Kim等[21]和Ha等[22]研究显示,对侧BPE在乳腺癌不同分子分型间无相关性;但Wang等[23]研究显示同侧BPE影像组学特征对TNBC和其他分子类型乳腺具有鉴别诊断价值。Dilorenzo等[9]和Wu等[24]研究显示同侧BPE的部分特征对鉴别不同分子分型有价值。上述研究结果不一致的可能原因是不同研究者进行BPE评价时选择的乳房侧不同。因此,为了更好地揭示BPE与乳腺癌分子分型的关系,尤其是预后最差的TNBC和预后最好的Luminal A型乳腺癌间的差异,本研究在同时评价乳腺癌病灶对侧和同侧BPE的基础上,分别比较病灶对侧和同侧BPE在TNBC和Luminal A型乳腺癌间的差异,结果显示乳腺癌对侧BPE在TNBC和Luminal A型乳腺癌间无显著差异,与Kim等[21]和Ha等[22]的研究结果类似。但乳腺癌同侧BPE在两组间有显著差异,即TNBC病灶同侧显著强化BPE类型占比高于Luminal A型乳腺癌,提示同侧BPE显著强化类型可以作为TNBC辅助诊断的影像特征。与Wang等[23]、Wu等[24]和Dilorenzo等[9]的结果类似,其中Wu等[24]的研究结果同样显示同侧BPE的特征对于鉴别不同分子分型有价值,尤其有助于鉴别TNBC和Luminal A型。Dilorenzo等[9]报道TNBC的BPE常表现为中等强化或显著强化。Verardi等[25]研究发现,乳腺癌病灶同侧的非对称性血管增加,与该侧发生乳腺癌、乳腺肿瘤较大和组织分级较高存在相关性。Sung等[26]研究显示乳腺癌同侧BPE与肿瘤微血管密度增加呈显著正相关。上述结果提示,随着乳腺癌恶性程度增加,乳腺癌同侧血管生成相应地增加,从而导致血流和血管通透性增加,MRI增强时表现出同侧BPE程度增加,可能是同侧BPE较对侧BPE与乳腺癌恶性程度相关性更好的病理生理基础。
本研究结果显示,无论是对侧还是同侧BPE,未绝经患者的显著强化BPE类型占比均高于绝经患者,与King等[27]的研究结果一致,均表明绝经前乳腺癌患者的BPE水平高于绝经后患者。此外,本研究结果还显示,Luminal A型乳腺癌对侧BPE和同侧BPE的一致性较好,而TNBC病灶对侧和同侧BPE的一致性一般,其原因可能是由于TNBC病灶侵袭性更强,进而对同侧BPE影响更大;Luminal A型乳腺癌侵袭性相对较弱,而对同侧BPE影响相对小所致,与本研究中TNBC病灶同侧显著强化BPE类型占比率高于Luminal A型乳腺癌一致。
本研究的创新性在于同时比较了TNBC和Luminal A型乳腺癌同侧和对侧BPE的差异,对两种类型乳腺癌BPE分布差异进行了更全面的研究。本研究的局限性:①对BPE的评价仍然依靠影像医师的主观评价,结果可能存在一定的偏倚,未来随着人工智能自动化分割和定量化技术的应用,可能会减少这样的主观偏倚。②限于统计学处理方便,本研究仅选择TNBC和Luminal A型乳腺癌这两种最具代表性的分子分型进行双侧BPE分布比较,初步探讨双侧BPE对乳腺癌分子分型的辅助诊断价值,以期为后续研究奠定基础。
总之,乳腺癌病灶同侧BPE显著强化可以作为TNBC和Luminal A型乳腺癌的辅助诊断征象,有助于影像医师对乳腺癌进行更精准的诊断。

