Maresin 1对肝缺血再灌注损伤的影响及机制研究
黄泽伟 郑毓英 刘雪燕 姜远旭
肝缺血再灌注损伤是肝移植、肝部分切除术和失血性休克后急性肝脏损伤的重要因素[1]。肝缺血再灌注后不但导致肝脏损伤,而且导致肺、肾、肠、胰腺等远隔器官损伤[2]。因此,有效降低肝缺血再灌注损伤的措施可能会提高患者术后的生存期。尽管过去对肝缺血再灌注损伤的病理生理有一定了解,但对其确切机制了解较少,也缺少有效的治疗方法。目前研究认为,过度的氧化应激反应和炎症反应共同导致肝细胞坏死和凋亡[3-4]。因此,抗炎和抗氧化在抗肝缺血再灌注损伤中尤为重要。Maresin 1(MaR1)是从二十二碳六烯酸中提取的一种新型促炎症消退介质。近些年研究表明,MaR1通过抗炎、抗氧化作用减轻肺和肾缺血再灌注损伤[5-6],且对四氯化碳、刀豆球蛋白A诱导的肝损伤有保护作用[7-8]。然而,MaR1对缺血再灌注诱导的肝损伤保护作用及其机制尚不完全清楚。本研究通过建立部分肝缺血再灌注损伤模型,探究MaR1是否通过抗炎及抗氧化作用减轻肝缺血再灌注损伤,并探讨其可能的机制。
1 材料和方法
1.1 实验动物 SPF级Wistar大鼠24只,4~7周龄,体重200~220 g,购于广东省医学实验动物中心,许可证号:SCXK(粤)2019-0035。
1.2 主要药物、试剂和仪器 Maresin 1购自美国Cayman公司(批号:1268720-28-0);抗磷脂酰肌醇-3激酶(phosphatidylinositol 3-kinase,PI3K)抑制剂 LY2-94002购自德国 Merck公司(批号:154447-36-6);TNF-α、IL-1β、IL-6、IL-10 ELISA试剂盒购自南京建成生物工程研究所(批号:H052-1、H002、H007-1-1、H009-1);丙二醛(malondialdehyde,MDA)、谷胱甘肽(glutathione,GSH)、过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)检测试剂盒均购自南京建成生物工程研究所(批号:A003-1-2、A006-2-1、A007-1-1、A001-1-2);PI3K、磷酸化PI3K(p-PI3K)、蛋白激酶B(protein kinase B,Akt/PKB)、磷酸化 Akt(p-Akt)、转录因子NF-E2 相关因子 2(transcription factor NF-E2-related factor 2,Nrf2)、血红素氧合酶-1(heme oxygenase-1,HO-1)抗体购自美国CST公司(批号:4255S、17366S、4691S、13038S、12721S、21416S);辣根过氧化物酶标记的羊抗兔IgG二抗购自美国CST公司(批号:32935S);β-actin抗体购自美国CST公司(批号:4970S)。显微镜购自日本OLYMPUS公司(型号:CKX53),全自动生化分析仪中国迈瑞公司(型号:BS-380),低温离心机购自中国瑞沃德公司(型号:M1324R),石蜡切片机购自中国瑞沃德公司(型号:S700A),酶标仪购自美国Bio-Rad公司(型号:1681130A),电泳仪购自美国Bio-Rad公司(型号:1645050)。
1.3 模型制作、分组及处理 所有大鼠实验前均经历至少一个昼夜循环,自由饮水。根据文献报道的方法建立肝缺血再灌注模型[12],主要步骤:腹腔注射3%戊巴比妥钠50 mg/kg麻醉大鼠,腹部正中切口,暴露肝门(肝动脉、门静脉、胆管),微血管钳阻断肝左叶、肝中叶血管,保留肝右叶和尾叶血流,阻断血流60 min后,移除血管钳开始再灌注,缝合切口,建立部分(70%)肝缺血再灌注损伤模型。大鼠按随机数字表法分为假手术组(Sham组)、肝缺血再灌注损伤组(I/R组)、MaR1治疗组(I/R+MaR1组)、I/R+MaR1+LY294002治疗组(I/R+MaR1+LY294002组),每组6只。各组大鼠采用3%戊巴比妥钠50 mg/kg进行麻醉,Sham组开腹关腹,不阻断血流;参照文献[13],I/R+MaR1组在肝缺血再灌注前1 h腹腔注射4 mg/kg MaR1,I/R+MaR1+LY294002组在肝缺血再灌注前30 min腹腔注射LY294002 0.5 mg/kg,其余处理同I/R+MaR1组。再灌注6 h后各组大鼠采用3%戊巴比妥钠50 mg/kg再次进行麻醉,分离右颈总动脉,置入套管针,取3 ml血液静置20 min后,4℃、3 000 r/min离心10 min,离心半径10 cm,取血清冻存备用。颈动脉放血后处死大鼠,立即开腹,取500 mg肝左叶组织冻存备用。
1.4 肝组织病理学检查 肝组织用4%多聚甲醛固定,石蜡包埋,恒温冷冻切片机切片(4 μm),HE染色,评估组织病理学变化。使用奥林巴斯光学显微镜(放大倍数为20倍)观察切片,每个切片随机选取6个视野进行肝损伤评估。根据Suzuki等[9]提出标准,依据充血、炎性和坏死的严重程度进行评分,0分为无,1分为极其轻微,2分为轻度,3分为中度,4分为严重,统计各组各项得分之和。
1.5 肝功能检测 大鼠处死前取1 ml颈动脉血,室温静置20 min,4℃、3 000 r/min离心10 min,离心半径10 cm,取上清液,采用全自动生化分析仪立即检测AST、ALT、乳酸脱氢酶(lactate dehydrogenase,LDH)水平,严格根据厂家说明书操作。
1.6 血清TNF-α、IL-1β、IL-6、IL-10水平的检测 取冰冻的血清解冻,采用ELISA测定TNF-α、IL-1β、IL-6、IL-10水平,严格按照ELISA试剂盒说明书操作。
1.7 肝组织MDA、GSH、CAT、SOD水平检测 取100 mg肝组织解冻,准确称重后,剪碎,置于组织匀浆器中,按1∶9的比例加入预冷0.9%氯化钠注射液(1 g组织加入9 ml0.9%氯化钠注射液),在0~4℃冰盒中研磨,制备10%组织匀浆液,4℃、3 000 r/min离心5 min,离心半径10 cm,取上清液测定肝组织中MDA、GSH、CAT、SOD水平,严格按说明书操作。
1.8 肝组织p-PI3K、p-Akt、Nrf2、HO-1蛋白表达的检测 采用Western blot法。取100 mg肝组织,裂解缓冲液匀浆(16 000 r/min,离心15 min),收集上清液。采用BCA蛋白检测试剂盒测定蛋白水平。样品加入上样缓冲液,用10%或15%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)分离。然后在250 mA电流下将条带转移到PVDF膜上,持续2 h。5%脱脂奶粉封闭1 h,封闭完毕后用PBS-T洗膜5次,5 min/次,然后加入抗PI3K、p-PI3K、Akt、p-Akt、Nrf2、HO-1一抗,在1%脱脂奶粉中孵育过夜。膜在TBS-T中洗涤10 min,加入辣根过氧化物酶(HRP)二抗,孵育1 h。二抗孵育结束后再次用TBS-T洗膜5次,5 min/次,洗膜后加入化学发光增强剂,自显影。采用图像分析处理系统(Image J软件)对蛋白条带扫描分析,测得的蛋白光密度值与β-actin光密度值的比值表示各蛋白的相对表达量。
1.9 统计学处理 采用SPSS 24.0统计软件。正态分布的计量资料以表示,多组间比较采用单因素方差分析,两两比较采用SNK-q检验;非正态分布的计量资料以M(P25,P75)表示,组间比较采用Kruskai-WallisH检验。P<0.05为差异有统计学意义。
2 结果
2.1 4组大鼠肝组织病理学检查结果 Sham组大鼠肝组织细胞排列有序,细胞形态正常。与Sham组比较,I/R组肝组织出现严重的肝损伤,如细胞排列不规则、肝细胞变性、坏死、炎性细胞浸润等,而MaR1治疗明显减轻I/R诱导的病理学变化,见图1(插页)。I/R组肝组织病理学评分为[3(3,4)]分,明显高于Sham 组[0(0,1)]分(P<0.05);I/R+MaR1组肝组织病理学评分为[1.5(1,2)]分,较 I/R 组明显降低(P<0.05),而LY294002逆转了MaR1的作用,I/R+MaR1+LY294002组肝组织病理学评分为[2.5(2,3)]分,高于I/R+MaR1组(P<0.05)。
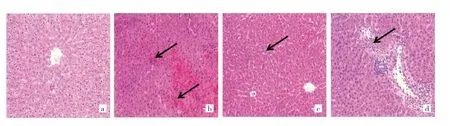
图1 4组大鼠肝组织病理学改变图(a:Sham组;b:I/R组;c:I/R+MAR1组;d:I/R+MAR1组+LY294002组;HE染色,×200)
2.2 4组大鼠血清AST、ALT、LDH水平的比较 与Sham组比较,I/R组血清AST、ALT、LDH水平均升高(均P<0.05);与I/R组比较,I/R+MaR1组AST、ALT、LDH水平均降低(均P<0.05);而LY294002逆转了MaR1的作用,与I/R+MaR1组比较,I/R+MaR1+LY294002组AST、ALT、LDH水平均升高(均P<0.05),见表1。

表1 4组大鼠血清AST、ALT、LDH水平的比较(U/L)
2.3 4组大鼠血清TNF-α、IL-1β、IL-6、IL-10水平的比较 与Sham组比较,I/R组血清TNF-α、IL-1β、IL-6水平均升高(均P<0.05),而IL-10无明显变化(P>0.05);与I/R组比较,I/R+MaR1组TNF-α、IL-1β、IL-6水平均降低,IL-10水平升高(均P<0.05);而LY294002逆转了MaR1的作用,与I/R+MaR1组比较,I/R+MaR1+LY294002组TNF-α、IL-1β、IL-6水平均升高,IL-10水平降低(均P<0.05),见表2。
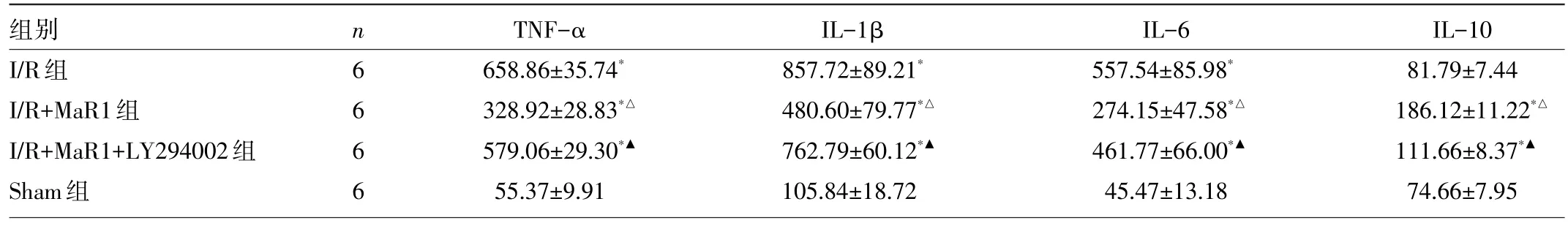
表2 4组大鼠血清TNF-α、IL-1β、IL-6、IL-10水平的比较(pg/ml)
2.4 4组大鼠肝组织MDA、GSH、CAT、SOD水平的比较 与Sham组比较,I/R组肝组织中MDA水平升高,而GSH、SOD、CAT水平均降低(均P<0.05);与I/R组比较,I/R+MaR1组MDA水平降低,而GSH、SOD、CAT水平均升高(均P<0.05);而LY294002逆转了MaR1的作用,与I/R+MaR1组比较,I/R+MaR1+LY294002组MDA水平升高,而GSH、SOD、CAT水平均降低(均P<0.05),见表3。

表3 4组大鼠肝组织MDA、GSH、CAT、SOD水平的比较
2.5 4组大鼠肝组织p-PI3K、p-Akt、Nrf2、HO-1蛋白表达的比较 与Sham组比较,I/R组肝组织p-PI3K、p-Akt、Nrf2、HO-1蛋白相对表达量均升高(均P<0.05),与I/R组比较,I/R+MaR1组p-PI3K、p-Akt、Nrf2、HO-1蛋白相对表达量进一步升高(均P<0.05);而LY294002逆转了MaR1的作用,与I/R+MaR1组比较,I/R+MaR1+LY294002组p-PI3K、p-Akt、Nrf2、HO-1蛋白相对表达量均降低(均P<0.05),见表4和图2。
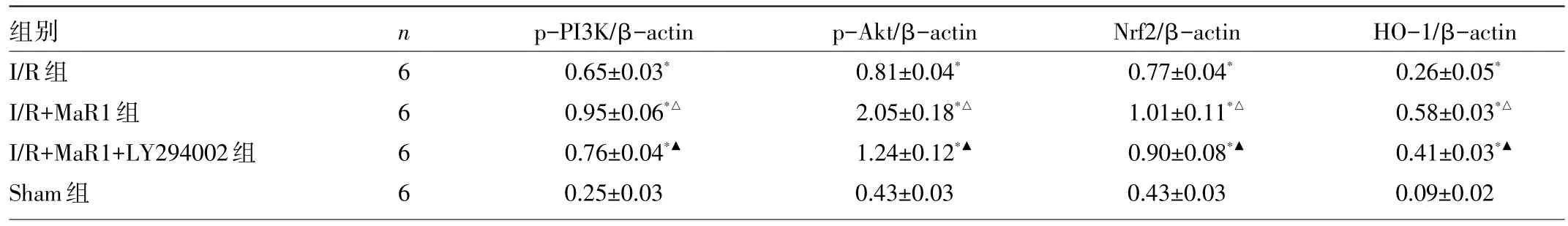
表4 4组大鼠肝组织p-PI3K、p-Akt、Nrf2、HO-1蛋白相对表达量的比较
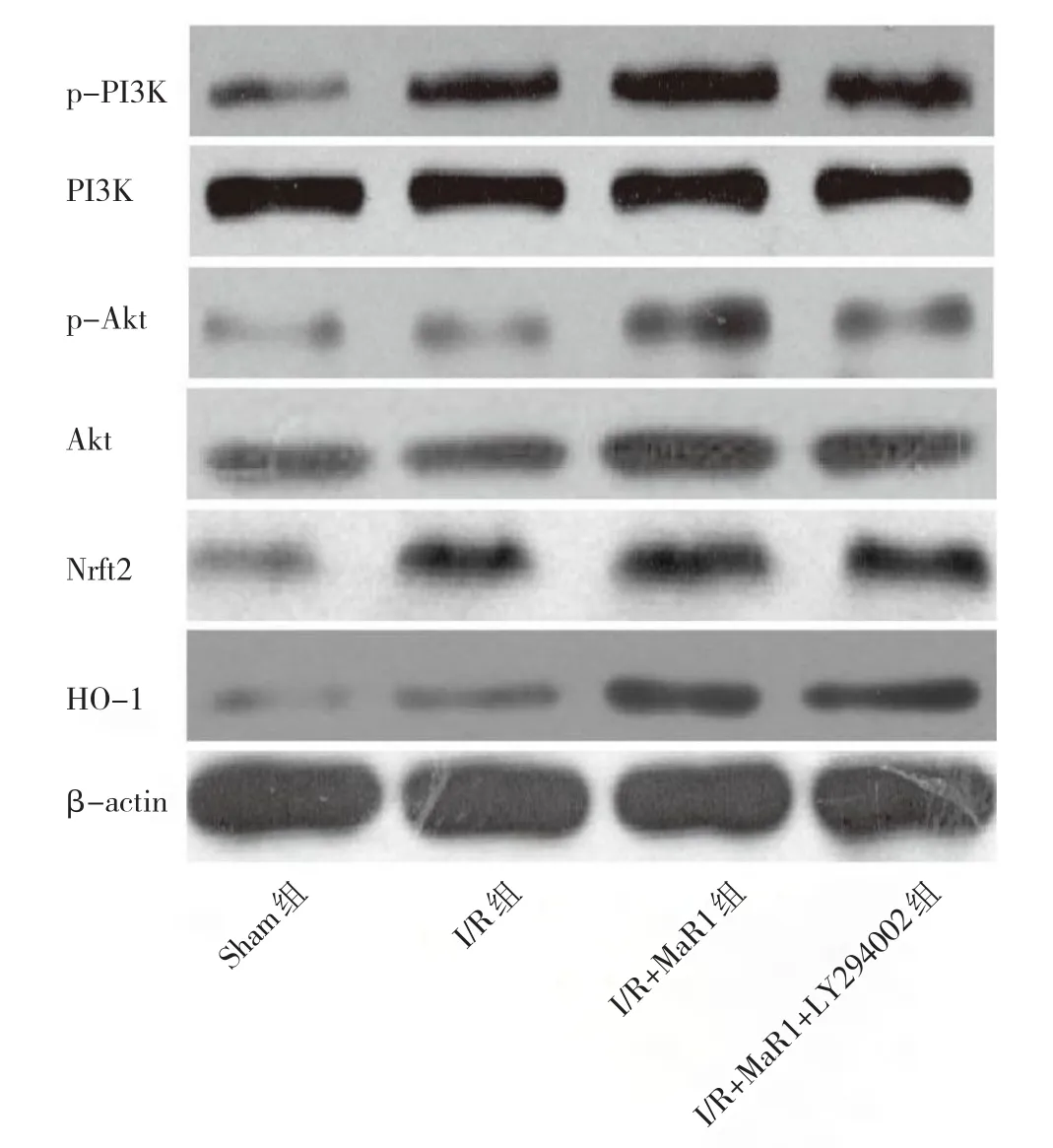
图2 4组大鼠肝组织p-PI3K、p-Akt、Nrf2、HO-1蛋白表达的电泳图
3 讨论
临床上进行肝脏手术时,往往会阻断肝脏血流。遗憾的是,在缺血区域组织恢复血流灌注后,发生了更严重的损伤,即肝缺血再灌注损伤。本研究中通过夹闭肝左及肝中叶血管,然后恢复再灌注来建立肝部分缺血再灌注损伤。结果发现,在缺血1 h及恢复再灌注6 h后,大鼠血清ALT、AST、LDH明显高于Sham组,表明肝功能障碍。此外,肝组织学的检测也表明,缺血再灌注诱导明显的肝组织炎性细胞浸润及肝细胞坏死。这些研究结果说明本实验成功诱导了肝缺血再灌注损伤模型。另外,本研究发现,MaR1治疗降低血清中ALT、AST、LDH水平,且减轻缺血再灌注诱导的病理学改变。与此同时,MaR1治疗明显降低肝损伤评分。以上这些数据表明,MaR1治疗减轻肝缺血再灌注诱导的损伤。
有研究表明,肝缺血再灌注后,激活的枯否细胞、巨噬细胞等释放TNF-α、IL-1β等炎性细胞因子导致过度炎性反应,进而导致肝细胞损伤[10-11]。MaR1是巨噬细胞中由二十二碳六烯酸产生的一种介质。既往有研究表明,MaR1通过减轻中性粒细胞浸润,抑制炎性细胞因子释放而减轻炎性反应[12-13]。本研究结果显示,MaR1治疗显著降低血清中TNF-α、IL-1β、IL-6水平,增加IL-10水平,表明MaR1减轻肝细胞损伤可能与其抑制炎性反应有关。除炎性反应外,肝缺血再灌注后中性粒细胞、巨噬细胞活化产生的活性氧(reactive oxygen species,ROS)诱导的氧化反应在肝损伤中也起重要作用[14]。过量的ROS通过脂质过氧化导致蛋白质和DNA损伤,被认为是缺血再灌注损伤过程中细胞膜氧化损伤的主要原因。MDA可反应体内脂质过氧化水平,而活性自由基的清除主要是通过一系列抗氧化酶来实现的,如SOD、CAT、GSH等,以维持氧化反应和抗氧化反应的平衡。以往研究发现,MaR1减轻氧化应激导致的肝细胞损害[8]。本研究发现,MaR1治疗显著降低肝组织中MDA水平,提高SOD、CAT、GSH水平。以上研究表明,MaR1减轻肝缺血再灌注损伤除了与抑制缺血再灌注诱导的炎性反应有关外,也与其抑制氧化反应有关。然而,MaR1的抗炎、抗氧化作用部分被PI3K抑制剂逆转,表明其作用是PI3K依赖的。
HO-1作为Ⅱ期抗氧化酶之一,在生理条件下,通过调控血红素的分解,其代谢产物具有抗氧化和抗炎作用。研究发现,外源性诱导HO-1表达增加对肺、肝和肾缺血再灌注损伤具有保护作用[15],提示在缺血再灌注损伤中,增加HO-1表达是减轻损伤的有效治疗措施。有研究发现,MaR1通过上调HO-1表达而发挥抗炎、抗氧化及器官保护作用[5]。HO-1表达受多个上游分子的调控,其中,PI3K/Akt/Nfr2是调控HO-1表达的一条重要信号通路。首先,HO-1受Nrf2紧密调控,而PI3K/Akt信号通路参与激活Nrf2[16-17]。一旦被激活,Nrf2就与Keap1分离,转位到细胞核与ARE结合,调控靶基因的表达,包括HO-1。既往研究发现,PI3K/Akt信号通路激活后,通过抑制炎症和线粒体产生的ROS,同时促进抗凋亡作用,在肝脏缺血再灌注损伤中发挥重要作用[18]。据报道,激活PI3K/Akt和Nrf2/HO-1通路减轻硫代乙酰胺诱导的肝毒性作用[17],提示激活PI3K/Akt/Nrf2/HO-1通路可能成为治疗肝缺血再灌注损伤的潜在靶点。研究表明,MaR1通过激活PI3K/Akt减轻神经炎性反应和认知功能障碍[19]。本研究发现,缺血再灌注诱导PI3K、Akt、Nfr2、HO-1表达增加,其原因为缺血再灌注后机体在启动促炎反应的同时,也激发了抗炎反应系统,属于一种保护机制。然而,本研究中I/R组诱发了明显的炎性反应,表明这种保护机制不足以抵消缺血再灌注诱发的促炎性反应,从而表现出过度的炎性反应。值得注意的是,MaR1治疗进一步增加PI3K、Akt、Nfr2、HO-1的表达,而给予PI3K抑制剂后,部分逆转了MaR1的这些作用。以上研究结果提示:MaR1通过激活PI3K/Akt/Nrf2/HO-1通路减轻缺血再灌注导致的肝组织损伤。
综上所述,MaR1减轻缺血再灌注诱导的炎性反应和氧化应激反应,减轻肝缺血再灌注损伤,且MaR1治疗进一步上调 PI3K、Akt、Nfr2、HO-1蛋白表达,而MaR1的这些作用部分被PI3K抑制剂LY294002逆转。MaR1通过激活PI3K/Akt/Nrf2/HO-1信号通路抑制肝缺血再灌注诱导的炎性反应和氧化应激反应,进而减轻肝缺血再灌注损伤。

