联合检测手术前后外周血乳酸脱氢酶与白蛋白比值变化对结肠癌预后的评估价值
谢智惠,吴 平,高敏国
1江南大学附属医院胃肠肿瘤外科,2营养科,江苏 无锡 214062;3无锡市疾病预防控制中心,江苏 无锡 214029
结肠癌是世界第三大高发的恶性肿瘤,其发病率在我国居恶性肿瘤的第4位,病死率居第5 位,严重威胁人类健康[1-2]。临床传统使用TNM分期判断结肠癌患者的预后,但TNM 分期依赖大体解剖,不能全面反映肿瘤生物学特异性,需要联合其他生物学指标多维度地进行风险分层,更精准地预估预后信息。很多研究提示,与肿瘤相关的炎症反应、机体的免疫状态与肿瘤的发生、进展及转移相关[3-4]。乳酸脱氢酶(lactate dehydrogenase,LDH)与白蛋白比值(LDH/albumin ratio,LAR)综合了乳酸脱氢酶和白蛋白两个重要指标,在多项研究中,被认为与胰腺癌、进展期胃癌等恶性肿瘤的预后生存相关,可成为其独立的预后不良因素[5-7]。Aday 等[8]提出LAR高值通常能够提示结直肠癌患者预后较差。笔者之前对126例结肠癌患者术前LAR值的预后意义展开分析,结果提示术前LAR值可作为结肠癌患者独立的不良预后因素[9]。但目前这些研究都集中在探索术前LAR水平,而联合术前和术后LAR值评估结肠癌预后的价值却未见报道。本研究通过回顾性分析134例结肠癌患者临床资料,目的在于研究手术前后LAR水平动态变化对结肠癌预后的评估价值。
1 对象和方法
1.1 对象
2013 年1 月— 2016 年12 月 在江南大学附属医院初治的结肠癌患者共134 例,根据2012 年国际抗癌联盟(UICC)第7 版分期标准进行分期。纳入标准包括:①临床资料记录完备(包括年龄、性别、家族史、TNM分期),术后病理学确诊的结肠癌初诊患者;②术前1周内、术后2周内均进行过血清生化检查,且数据完整;③均接受了根治性手术。排除标准包括:①合并其他原发肿瘤;②合并严重的心、肺、肝、肾疾病;③术前或术后合并有急性或慢性的感染;④合并有肠梗阻或穿孔、大出血。本研究获得了江南大学附属医院伦理委员会的批准(伦理编号:LS2021079),所有患者知情同意。
1.2 方法
1.2.1 治疗方法
采集患者术前1周内、术后2周内的外周静脉血样本,使用江南大学附属医院检验科Roche cobas C702 生化仪检测肝功能,记录LDH 和白蛋白数值,并计算LAR 值,计算公式为LDH/白蛋白。患者术后均按照2013年版NCCN 指南指导治疗,Ⅰ期患者术后随访观察,Ⅱ期伴低危因素患者术后随访观察,伴普危因素患者术后口服卡培他滨片单药,伴高危因素患者术后行6~8疗程的mFOLFOX6辅助化疗,Ⅲ期及ⅣA 期患者术后均行6~8 个疗程的mFOLFOX6辅助化疗。
1.2.2 随访
定期随访,术后3 年内每3 个月复查1次,3 年以上每6 个月复查1 次,5 年后每年进行1 次,随访截至2021 年12 月;随访方式为门诊复查、住院等;随访项目包括体格检查、肿瘤标志物、头胸腹盆CT或MRI、骨扫描。总生存时间(overall survival,OS)定义为手术之日到死亡时间或者随访截止时间,无进展生存期(progression⁃free survival,PFS)为术后病理确诊至物理检查提示发生转移或出现肿瘤标志物持续升高的时间。
1.3 统计学方法
应用R软件计算LAR的截断值;采用SPSS 26.0软件进行统计分析:t检验计算手术前后LAR 值与结肠癌临床病理特征的关系,Kaplan⁃Meier 法计算OS 及PFS 并进行Log⁃rank 检验,应用Cox 模型进行多因素分析。P<0.05为差异有统计学意义。
2 结果
2.1 术前LAR、术后LAR与临床病理特征之间的差异性比较
共收治接受手术治疗的结肠癌患者134 例,其中男71例,女63例;中位年龄66岁(19~89岁);根据2012 年国际抗癌联盟第7 版分期标准:Ⅰ期12 例,Ⅱ期45例,Ⅲ期61例,ⅣA期16例。术前LAR水平与结肠癌患者的淋巴结转移具有相关性,有统计学意义(P<0.01);术后LAR 水平与患者的年龄、淋巴结转移均具有相关性(P<0.05),患者的性别、肿瘤侵犯深度、临床分期与术前LAR、术后LAR 无明显相关性(表1)。

表1 术前LAR和术后LAR与结肠癌患者临床病理特征之间的相关性Table 1 Correlation between preoperative LAR,posto⁃perative LAR and clinicopathological features of colon cancer patients
2.2 术前LAR和术后LAR的最佳截点及分组
134 例结肠癌患者,以患者死亡为终点,运用ROC 曲线计算Youden 指数(灵敏度+特异度-1)。术前LAR 的受试者工作特征曲线(receiver opera⁃ting characteristic curve,ROC 曲线)的曲线下面积(area under the curve,AUC)为0.722,当术前LAR 为4.911 时,Youden 指数达到最大值为0.385,此时灵敏度、特异度分别为48.6%和89.9%(表2,图1A);故将4.911 作为术前LAR 最佳截点,将患者分为术前高LAR 组(LAR>4.911,n=28)和术前低LAR 组(LAR≤4.911,n=106)。术后LAR 的ROC 曲线下面积AUC为0.623,当术后LAR为5.982时,Youden 指数达到最大值为0.235,此时灵敏度、特异度分别为45.7% 和77.8%(表2,图1B);故将5.982 作为术后LAR 最佳截点,将患者分为术后高LAR 组(LAR>5.982,n=40)和术后低LAR组(LAR≤5.982,n=94)。选择术前、术后LAR联合分析,按术前LAR 及术后LAR各自最佳截点,将134例患者进一步分为3 个组,分别为LAR1 组(术前和术后LAR 均高,n=18)、LAR2 组(术前或术后只有1 次LAR 高,n=32)和LAR3组(术前和术后LAR均低,n=84)。
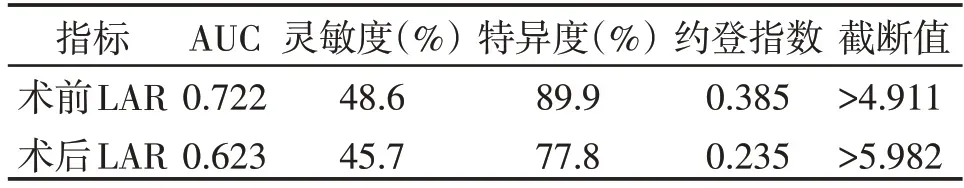
表2 术前LAR和术后LAR的最佳截断值Table 2 Optimal cutoff values of preoperative LAR and postoperative LAR

图1 134例结肠癌患者术前(A)、术后(B)LAR最佳分界点的ROC曲线Figure 1 ROC curve of the best dividing point of LAR be⁃fore(A)and after(B)operation in 134 patients with colon cancer
2.3 生存分析
分析患者性别、年龄、侵犯深度、淋巴结转移、临床分期、术前和术后LAR对PFS、OS的影响,中位随访时间72 个月(2~102 个月),术前高LAR 组、术前低LAR组的5 年OS率分别为42.9%和84.9%,5年PFS率分别为45.4%和82.6%,术前高LAR组的患者OS 和PFS 明显短于术前LAR 低组患者。术后高LAR 组、术后低LAR 组的术后5 年OS 率分别为62.5%和81.9%,5 年PFS 率分别为70.0%和77.3%,术后高LAR 组患者的OS及PFS较术后低LAR 组患者短。单因素及多因素分析结果显示,LAR1 组、LAR2组LAR3组的5 年OS率分别为33.3%、78.1%、84.5%,差异有统计学意义(P<0.01,图2),术前和术后LAR 均高的患者OS 最短,预后最差;5 年PFS率分别为33.5%、84.0%、79.4%,但3 组差异无统计学意义(P>0.05)。此外,淋巴结转移与患者的OS、PFS 显著相关(P<0.01),临床分期与患者的PFS 显著相关(P<0.01),但在多因素分析中与OS 无相关性(P>0.05)。单因素分析显示,女性患者的PFS较男性患者短,但在多因素分析中无显著相关性(P>0.05)。年龄、侵犯深度与患者PFS、OS 均无显著相关性(P>0.05,表3)。

图2 LAR1组、LAR2组、LAR3组患者生存曲线的比较Figure 2 Comparison of survival curves of patients in LAR1 group,LAR2 group and LAR3 group
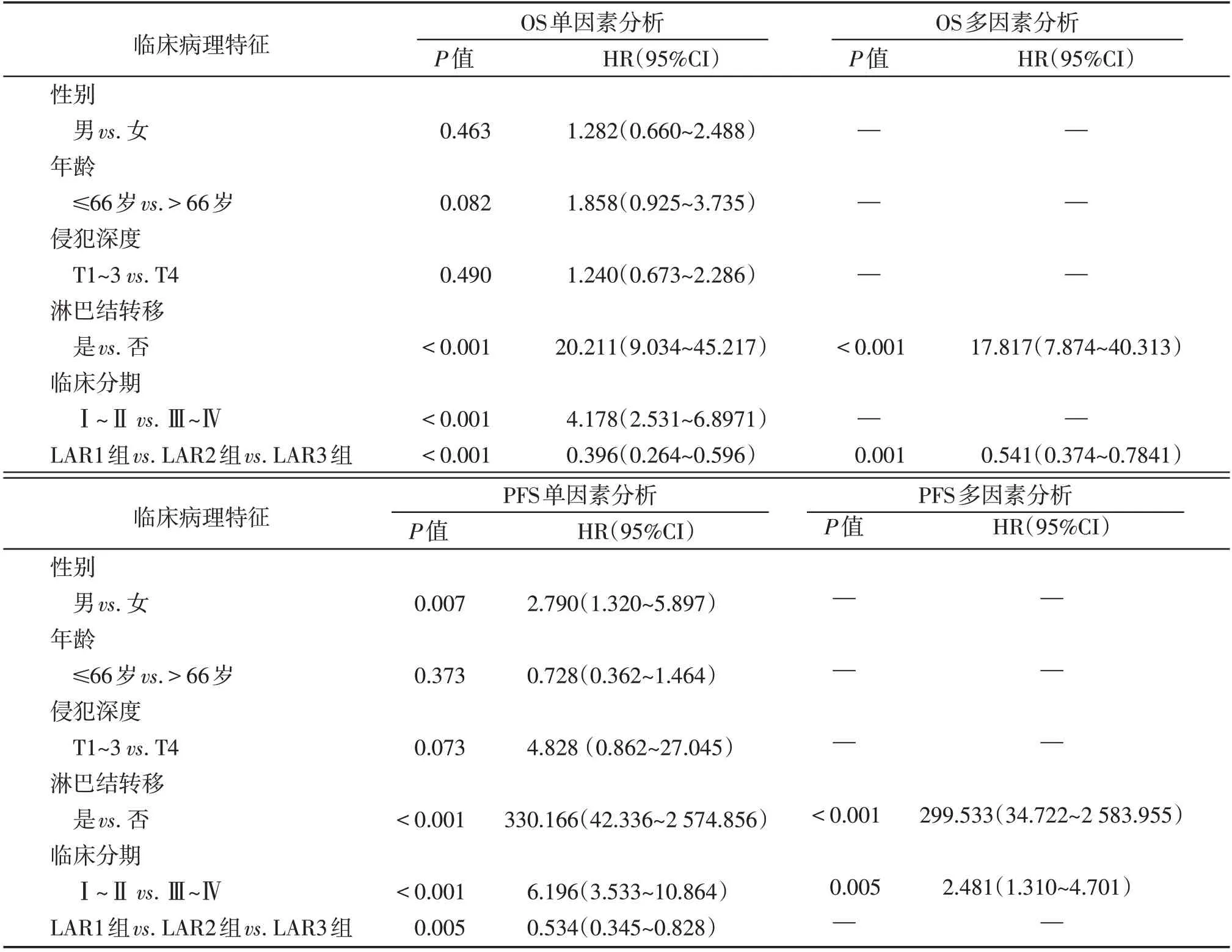
表3 结肠癌患者OS和PFS的单因素及多因素分析Table 3 Univariate and multivariate analysis of OS and PFS in patients with colon cancer
3 讨论
目前已有共识认为肿瘤的临床分期、淋巴结转移是影响结肠癌患者预后的危险因素[10]。随着手术根治和综合治疗方法的开展,结肠癌的生存期已大大提高,但仍有部分患者即使处于肿瘤早期,在根治性切除术后仍出现复发转移[11],可见仅凭物理解剖结果对个体行预后评估尚有欠缺,结合有效的生化指标来分析其对恶性肿瘤患者预后的潜在影响十分必要。
在肿瘤微环境中,炎症细胞能够释出炎症细胞因子、活性介质,持续产生炎症反应,从而削弱机体的免疫防御,促进细胞的恶变、侵袭和转移[12]。LAR值为LDH与白蛋白的比值,可以从不同角度评估肿瘤基线数据,提供更多的预后信息。在细胞代谢过程中,LDH 是丙酮酸转化为乳酸所需的关键酶,肿瘤细胞异常增殖过程中,其微环境大量耗氧,通过LDH无氧酵解来提供维持其存活及增殖的能量,同时它产生的乳酸可以改变肿瘤微环境,以抑制和逃避宿主的免疫攻击[13]。白蛋白能够反映全身营养状况,低白蛋白往往提示着患者的营养状况较差、个体免疫力下降[14],同时,低白蛋白被认为与机体慢性炎症相关,炎症反应可刺激相关细胞释放IL⁃4、IL⁃6 等促炎因子影响白蛋白的合成,从而使白蛋白水平下降[15-16],并促成微血管的生成以及肿瘤发生转移[17]。因此LAR 值可反映肿瘤负荷、肿瘤乏氧程度、全身营养状况、炎症反应及免疫状态。
本研究显示在LAR 值与临床病理特征的关系中,术前及术后LAR值与性别、侵犯深度、临床分期均无相关性。术前及术后LAR 与淋巴结转移存在相关性,有淋巴结转移的患者,其LAR 值更高。炎性微环境参与肿瘤的发生、发展,同时可诱导免疫抑制并介导免疫逃逸[18-19],机体的免疫状态受损,淋巴细胞减少,导致淋巴结转移风险增加[20]。考虑与LAR高值患者炎症反应增加、机体免疫被抑制有关。同时术后LAR 值与患者的年龄相关,年龄越大的患者,术后LAR值越高,高龄患者接受手术后,往往恢复能力较年轻者差,容易发生营养摄取不足及免疫力下降。
已有研究表明,术前LAR与食管癌、结直肠癌、进展期胃癌等恶性肿瘤的预后生存密切相关,Feng等[21]研究示346例可切除食管鳞状细胞癌患者的5年肿瘤特异性生存率为31.8%,其中LAR 高值(>5.5)的患者与较低的肿瘤特异性生存率相关(13.3%vs.38.3%,P<0.001),多变量分析显示LAR 是可切除食管鳞状细胞癌患者的独立预测因子。这一结果与本研究结果一致:高LAR 值患者的OS 相对低LAR值患者短,生存预后不佳。Aday 等[8]回顾性观察了接受根治性手术后的结直肠癌患者,LAR低值患者和LAR 高值患者的5 年无病生存(disease free survival,DFS)率分别为65.4%和55.2%,5年OS率分别为68.5%和55.4%,LAR 高值与较差的DFS 和OS显著相关(P=0.003、P<0.001)。董鑫等[6]分析术前LAR与进展期胃癌患者预后的关系,单因素结果显示高LAR 组患者的OS和PFS均明显短于低LAR组(P<0.05),通 过Cox多因素分析,LAR是影响OS 及PFS 的独立危险因素。虽然本研究结果中,高LAR值与患者的OS 显著相关,与PFS 不相关,与上述两篇文献并不一致,考虑是否为入组病例的选择、治疗方法上的差异以及样本量少造成的。
目前这些研究都集中在患者术前LAR水平,但患者的炎症反应通常贯穿整个围手术期,特别是手术创伤会对患者的免疫系统造成伤害,故笔者认为在围手术期若积极采取措施减轻炎症反应,纠正低白蛋白水平,加强营养治疗,对提高患者抗肿瘤免疫有更积极的意义。所以与以往研究不同,本研究对LAR值行动态监测,联合分析了术前及术后LAR值。本队列患者术前LAR、术后LAR的AUC分别为0.722、0.623。结合生存分析,术前高LAR 组、术后高LAR 组的5年OS及PFS分别短于术前低LAR 组和术后低LAR 组,且术前高LAR 值患者的OS 及PFS 更短。结果分析显示,术前LAR 的预测价值及敏感性要优于术后LAR,原因是术前原发肿瘤的存在,可持续刺激LDH 的无氧酵解[12],引起LDH水平升高,LDH水平升高又能使组织产生氧合障碍并加剧肿瘤乏氧,肿瘤迅速增长的风险也相应增高,同时抑制营养摄取及免疫防御;而根治性手术后的患者处于无瘤状态,术后通常进行能量支持,可一定程度改善患者的营养及免疫状态,这也许是术后LAR 不如术前LAR 敏感的原因。结果中术前高LAR组及术后高LAR组均出现了5年OS率低于5年PFS率的情况,这提示即使患者肿瘤未出现进展,但全身营养及免疫状态不佳,亦可影响其预后生存,LAR 值在患者整个抗癌治疗周期内的变化值得重视。在联合分组中,LAR1组、LAR2组、LAR3组5年PFS率分别为33.5%、84.0%、79.4%,LAR1组较另两组更易发生肿瘤进展,但3 组的差异无统计学意义(P>0.05)。在多因素分析中,LAR 值与PFS 不相关,联系之前的结果术前和术后LAR值与淋巴结转移相关,生存分析中又与患者的PFS无关,这两者显然出现矛盾,考虑与纳入本研究的患者均行根治手术,同时除Ⅰ期患者以外,其余均完成辅助化疗有关;并且此研究为回顾性分析,可能出现选择偏差,或与本研究所选取的样本量较小有关。LAR1 组、LAR2 组、LAR3 组5 年OS 率分别为33.3%、78.1%、84.5%,差异有统计学意义(P<0.01),术前和术后LAR 均高组的患者生存预后最差,这一结果可成为影响结肠癌OS的独立危险因素,提示对术前及术后LAR 均高的结肠癌患者需行综合评估,制定出针对性的治疗方案,在整个围手术期全程均应积极改善其营养状况,提高免疫能力,减轻炎症反应,再行后续的手术或辅助治疗,同时考虑缩短随访时间,及时了解其肿瘤有无进展,即使在其后续的恢复生存期,同样不能忽视营养支持及提高免疫力,以期延长其生存期。
本研究生存分析中,单因素及多因素结果表明,淋巴结转移与结肠癌患者的PFS及OS存在显著相关,这与传统共识相一致[9]。而临床分期仅与PFS相关,与OS在多因素分析中无关。临床分期作为判断恶性肿瘤预后的标准是公认的,但它依赖大体解剖与病理,会受原发肿瘤浸润的深度、淋巴结转移个数等的影响,易呈浩等[22]发现ⅡC 期的5 年生存率为44.8%,比ⅢA期79.6%、ⅢB期58.0%的5年生存率明显低。同时肿瘤的异质性也会导致临床分期对肿瘤预后或治疗反应不一致[23]。本研究获得的结果中临床分期并不能全面评估结肠癌预后,除了上述原因,考虑还与OS多因素分析中纳入变量的影响相关。
本研究旨在从炎症反应、机体免疫、营养状态多角度寻找影响结肠癌患者预后的危险因素,初步提示了联合术前LAR和术后LAR值,有助于判断结肠癌的生存预后。本研究的缺陷是单中心回顾性临床研究,样本量较小,分组难以进一步细化,易出现选择性偏差。今后需设计更加合理的实验方案,进行多中心、前瞻性的研究。

