谷物中阿拉伯木聚糖改善动物肠道健康的研究进展
王宇欣,赵金标,鲁琳
(1.中国农业大学动物科学技术学院,动物营养学国家重点实验室,北京 100193;2.北京农学院动物科学技术学院,北京 102206)
超早期仔猪断奶技术已被养猪业广泛使用。仔猪早期断奶后由于各方面的应激会损伤肠道屏障发育和微生态环境,导致仔猪食欲下降、消化不良和腹泻,甚至死亡。仔猪生产中缓解断奶应激导致的肠道屏障损伤是目前急需解决的问题。阿拉伯木聚糖(Arabinoxylan,AX)可以特异性地促进益生菌的增殖,是谷物及其加工副产物中维持肠道屏障功能的主要活性成分之一。AX 被动物肠道微生物降解成低聚木糖,且进一步被降解生成短链脂肪酸(SCFA),SCFA 通过激活G 蛋白偶联受体(GPRs)、抑制组蛋白去乙酰化酶(HDAC)以及降低肠道的pH 来改善机体肠道健康。富含AX 的谷物饲喂断奶仔猪,提高了血清中抑炎因子白细胞介素-10(IL-10)含量,改善仔猪的生长性能。AX 被肠道微生物降解后同时生成游离态阿魏酸,阿魏酸能抑制大肠杆菌和蜡状芽孢杆菌的增殖。研究表明AX 中结合态阿魏酸在清除自由基和防止微粒体脂质氧化等抗氧化能力显著高于游离态阿魏酸,这表明微生物降解AX合成的阿魏酸和SCFA 对于提高机体抗氧化能力存在协同互作。但是关于阿魏酸介导SCFA 调控肠道健康的作用机制尚不清楚,还需要进一步探索。本文主要综述了SCFA 和游离态阿魏酸的生物学功能,并在此基础上提出阿魏酸协同SCFA 调控宿主肠道健康的新观点,旨在拓展AX 作为功能性益生元调节肠道健康的作用机制,丰富纤维聚糖理论。
1 AX 的结构、来源及代谢
1.1 AX 的结构 AX 是一类由阿拉伯糖和木糖组成的非淀粉多糖,其结构由-D-吡喃木糖残基经-(1→4)-糖苷键连接而成的木聚糖主链和-L-呋喃阿拉伯糖为侧链的多分支结构,含有一定量的阿魏酸或香豆酸。根据AX 的物理特性,AX 可分为水溶性阿拉伯木聚糖(Water Extractable Arabinoxylan,WEAX)和不可溶性阿拉伯木聚糖(Water Unextractable Arabinoxylan,WUAX)。二者的结构组成相似,但WUAX 的聚合度和阿拉伯侧链取代程度高于WEAX。阿魏酸在WUAX的特殊结构中起到了关键性作用。AX 的一个结构特征是其主链的平均取代度,即阿拉伯糖与木糖的比值(A/X)。阿拉伯糖残基的相对数量和取代情况的不同是造成AX 理化性质和发酵特性等方面差异的主要原因。研究表明不同作物谷粒及副产物的AX 存在不同的侧链基团。与小麦、黑麦、大麦的麸皮相比,大米和高粱谷物的麸皮含有更丰富的侧链(包括吡喃木糖、吡喃半乳糖、糖醛酸)。AX 的另一个结构特点是可在C(O)-5 位经由一个酯键与阿魏酸(Ferulic Acid,FA)形成交联构成多(低)聚糖阿魏酸酯,而FA 侧链还能与-葡聚糖、纤维素、葡萄糖、蛋白质形成复杂的网状结构。谷物中阿魏酸主要有水溶性、脂溶性和不溶性3 种存在形式。其中,水溶性和脂溶性阿魏酸在人体和动物肠道中可以直接被肠上皮细胞吸收利用。阿魏酸基团常常与AX 的阿拉伯残基相结合,被肠道微生物降解生成游离阿魏酸。
1.2 饲料中AX 的来源 AX 可与其他非淀粉多糖共同构成细胞壁。在玉米、小麦、稻米、高粱、燕麦等大多数谷类中,胚乳细胞的细胞壁和糊粉层中含AX 大约为60%~70%。在小麦籽粒的不同结构中分布着不同含量的AX,整个小麦籽粒中AX 含量约为4.8%~7.0%,胚乳中约为1.5%~3.0%,而麸皮中则高达20.0%~25.0%。不同部位的AX,在细胞壁非淀粉多糖组成中也有不同,麸皮中AX 所占比例为64%~69%,而在胚乳中达到88%。不同谷物中AX 和结合态阿魏酸含量见表1。

表1 不同谷物中AX 和结合态阿魏酸的含量 mg/100g
1.3 AX 的代谢 AX 是谷物原料改善肠道屏障功能的主要功能性成分之一,人和动物不能分泌内源性消化酶来降解AX,但可以通过肠道菌群发酵产生SCFA。同时,AX 被人体和动物肠道微生物降解可以释放出游离态阿魏酸。阿魏酸是一种可抗氧化、抗炎症的酚酸,通过激活Keap1-Nrf2-ARE 信号通路提高抗氧化酶活性,降低活性氧(ROS)浓度来达到抗氧化损伤,或直接清除自由基或产生自由基的酶产生抗氧化作用。此外,AX 结构差异显著影响肠道微生物的代谢规律,拟杆菌属是结肠近端的优势细菌,可将低支AX 降解为聚合度较低的阿魏糖基化低聚木糖。双歧杆菌和乳酸杆菌更倾向于降解高度分枝的AX 或低聚木糖。这些优势菌群的靶向代谢活性是由其对不同链长的偏好以及在AX 中以阿拉伯糖取代木聚糖主链所维持的,从而形成宿主肠道微生态系统的平衡状态。
2 AX-肠道微生物-SCFA 轴交互联系
AX 作为益生元具有促进肠道有益菌增殖,改善肠道菌群数量及结构的作用,且其益生作用不同于某些低聚糖或多糖在肠道最前端就被快速降解利用,从而引起机体胀气和不适等肠道疾病。AX 不能被机体的消化酶系统所消化和吸收,其进入结肠后端,被特定的戊聚糖水解酶所降解而产生SCFA,这将有利于有益菌的增殖,并且可以有效调节后端结肠的健康情况。有研究发现,在商品猪饲粮中添加高水平(12.9%)的小麦AX 可提高盲肠SCFA 含量,缓解结肠细胞DNA 损伤,提高结肠中段普雷沃菌属和梭菌IV 含量。此外,还有研究发现,添加WUAX 会诱导细菌合成木聚糖酶和阿魏酸酯酶等胞外水解酶,从而可以促进宿主对于AX的吸收利用。
3 SCFA 的生理学功能
3.1 免疫调节 AX 被肠道微生物降解生成SCFA 可使肠道pH 降低,促进营养物质吸收,改善肠道健康。SCFA 可与肠上皮细胞G 蛋白偶联受体结合,作为肠上皮细胞GPRs 的配体参与调节宿主的肠道屏障功能(图1)。同时抑制HDAC 活性,下调NF-B 信号通路的表达,促进调节性T 细胞(Regulatory T Cells,Treg)分化。Treg 可以通过主动调节的方式抑制潜在的自身反应性T细胞,调节机体的免疫力。SCFA 诱导转化生长因子-(TGF-)的直接表达,提高肠道淋巴细胞活性和分泌性免疫球蛋白A(slgA)浓度。通过激活Janus 激酶/信号转导和转录激活因子-3(JAK/STAT3),直接提高紧密连接蛋白的表达,促进肠上皮细胞的增殖与分化。SCFA 还能够刺激肠内分泌细胞来调节肠道上皮细胞的完整性和促炎和抗炎细胞因子的产生,介导炎症反应。与此同时,SCFA 可促进生长因子和花生四烯酸代谢物的合成,有利于肠上皮杯状细胞的增殖、黏蛋白的分泌、紧密连接蛋白和Toll 样受体的表达,从而改善肠道屏障功能。有研究报道,丁酸钠通过抑制HDAC 活性和激活激活蛋白1(AP-1)信号通路,调节IL-2、IL-6、IL-8 和肿瘤坏死因子-(TNF-)的释放,增强宿主的肠道免疫功能。同时,丁酸钠通过激发GPR 43 降低炎症因子IL-2 水平,增加抗炎因子IL-4 和抗菌肽LL-37 的分泌,有效调控T 淋巴细胞功能,最终抑制宿主的炎症反应。丁酸通过激活结肠巨噬细胞抗原呈递细胞上的GPR 109A,促进促炎细胞因子的分泌,导致T 调节细胞分化,促进IL-10 的分泌。此外,SCFA 还可以通过识别GPR 43 激活Pyrin Domain Containing Protein-3(NLRP3)炎性小体,抑制干扰素-(IFN-)和IL-18 的表达,从而改善肠道免疫。综上所述,SCFA 可以通过激活GPRs 和抑制HDAC 来提高机体肠道免疫功能,降低肠道通透性。
3.2 糖脂代谢 AX 被微生物发酵降解后产生SCFA,被结肠黏膜上皮细胞吸收后参与胆固醇、三酰甘油及脂肪酸的代谢过程,调节机体糖脂代谢平衡。研究表明,饲料中添加AX 后,宿主的组织脂肪和内脏脂肪重量均有所降低。SCFA 作为一种信号分子,经肠道上皮细胞吸收后,与G 蛋白偶联受体41(GPR 41)和43(GPR 43)结合,刺激胰高血糖素样肽(GLP-1)和多肽YY(PYY)等肠道激素的分泌,降低胰岛素耐受。此前有研究报道,SCFA 对糖尿病的保护作用可能与宿主肠道和肝细胞上GPRs 的激活有关,调节葡萄糖耐量和胰岛素敏感性。GLP-1 可以促进机体胰岛素分泌,调节血糖代谢,PYY 可以减慢胃排空,降低葡萄糖吸收速率。SCFA 与GPR41 或GPR43 结合后,刺激肝脏和肌肉组织磷酸腺苷活化蛋白激酶(AMPK)活性,进而激活下游的过氧化物酶体增殖物激活受体辅助激活因子-1(PGC-1),PGC-1能够控制过氧化物酶体增殖物激活受体(PPAR)等转录因子的表达,促进脂肪酸的氧化,从而调节脂质代谢。SCFA 还可以促进脂肪组织中瘦素受体、Janus 激酶2(JAK2)和信号转导及转录活化因子3(STAT3)的蛋白表达水平,调节脂肪代谢。
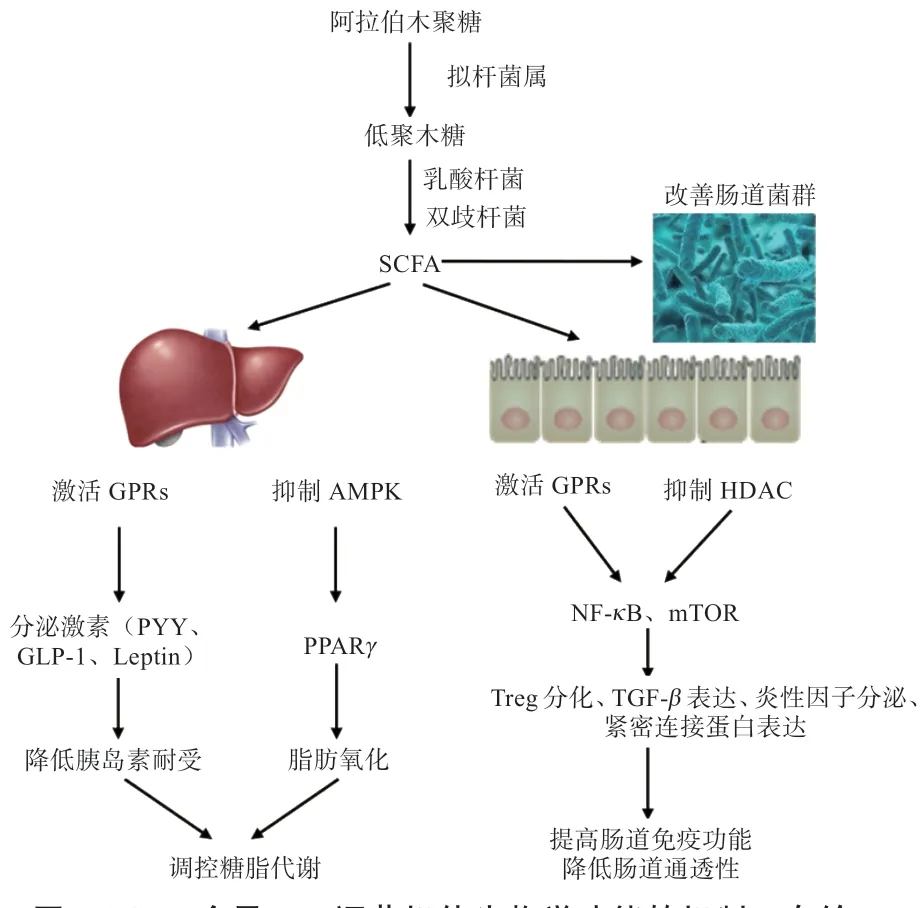
图1 SCFA 介导AX 调节机体生物学功能的机制(自绘)
4 阿魏酸的生理学功能
4.1 抗氧化作用 自由基是机体正常新陈代谢的产物。一般情况下,机体产生的自由基可被生物体内的抗氧化系统所平衡。机体本身的各种抗氧化酶和抗氧化成分会清除过量的ROS,但由于某些原因可能会导致平衡被破坏,损害机体造成不可逆转的氧化破坏。AX 中阿魏酸是与阿拉伯糖残基结合,经由肠道微生物发酵释放游离阿魏酸和SCFA。刘珂伟等测定了阿魏酸对羟基、活性氧以及DPPH 自由基的清除能力和对铁离子的还原能力,结果表明阿魏酸对Fe具有很强的还原能力,相对还原力是维生素C 的2 倍。阿魏酸通过激活Keap-Nrf2 信号通路,消除ROS,提高抗氧化酶活性,激活PPAR上调总抗氧化能力(T-AOC)、超氧化物歧化酶(SOD)活性以及降低ROS 和丙二醛(MDA)等氧化应激因子含量(图2)。Mahmoud 等发现,甲氨蝶呤(MTX)处理小鼠连续口服15 d 阿魏酸后与未饲喂FA 小鼠相比,肝脏损伤明显减轻,ROS、MDA和一氧化氮(NO)等氧化应激因子含量显著降低,谷胱甘肽(GSH)含量和SOD 等抗氧化酶活性显著提高。Perez-Ternero 等研究表明,阿魏酸显著改善了小鼠线粒体功能,降低了小鼠动脉和上皮细胞氧化应激。林秋珊等利用阿魏酸对过氧化氢处理PC12 细胞进行干预,发现阿魏酸使细胞上清液中乳酸脱氢酶(LDH)活性和MDA 含量显著降低,SOD 活性显著升高,表明FA 缓解了PC12 细胞的氧化应激。

图2 阿魏酸的生物学功能(自绘)
4.2 免疫调节作用 免疫应激条件下,机体内促炎症因子,如IL-6、肿瘤坏死因子-a(TNF-a),其含量显著提高。阿魏酸可以通过干扰NF-B 蛋白移位,来降低促炎因子表达量,从而实现抗炎的作用。研究表明,糖尿病小鼠灌服阿魏酸后显著降低了肾脏中促炎因子TNF-、IL-1和IL-6 的表达量,使肾脏炎症和防御性自噬得到改善。Cao 等发现,相比过氧化氢处理,阿魏酸处理下调了血管平滑肌细胞中NF-B 表达,降低了TNF-a、IL-1和IL-6 等炎症因子含量。Mahmoud 等研究也表明,阿魏酸降低了MTX 处理小鼠肝细胞中NF-B 的表达量和血清中TNF-a、IL-1含量。NF-B 是炎症反应中起重要作用的转录因子。在免疫应激条件下,核因子B 抑制蛋白激酶(IKK)被磷酸化,使NF-B 与核因子B 抑制蛋白(I-B)分离并移位至细胞核,诱导促炎症因子和相关酶表达。FA可以防止IKK 磷酸化,从而抑制NF-B 的移位,实现消炎作用。
4.3 糖脂代谢 阿魏酸作为天然植物提取物具有调节葡萄糖和脂肪代谢的作用,可以影响宿主的代谢性疾病。当为小鼠提供高脂高糖饮食时,阿魏酸可降低血清中总甘油三酯、总胆固醇、游离脂肪酸、葡萄糖和胰岛素浓度,从而改善葡萄糖耐量和胰岛素抵抗。阿魏酸调控宿主能量代谢的作用主要是降低瘦素浓度和脂肪酶活性,从而降低食物摄取量。阿魏酸激活AMPK 和改善蛋白激酶B 的磷酸化,从而提高胰岛素活性,分解碳水化合物和脂肪酸。同时,阿魏酸通过下调二酰基甘油酰基转移酶基因()的表达来抑制脂肪酸的合成,改善糖类和脂类物质代谢。阿魏酸还可以通过维持HFFD 小鼠胚胎干细胞(ESCs)和脂肪来源间充质干细胞(ADMSCS)的自我更新,达到减肥及维持糖类与脂类代谢平衡效果。
4.4 杀菌作用 阿魏酸对细菌具有抑制作用,其根本原因是由于FA 能够对于细菌的N-乙酰转移酶产生抑制作用,从而达到抑菌的目的。Zhang 等研究发现,1 mg/mL 阿魏酸对嗜麦芽寡养单胞菌的增殖具有非常显著的抑制作用。FA 抑菌作用机制还有可能是降低细菌细胞内pH,破坏细胞膜功能,从而导致细菌死亡。
5 SCFA 和阿魏酸协调调控肠道健康的潜在联系
SCFA 可以通过抑制NF-B 信号通路激活GPR 43和GPR 109A 来调控宿主的炎症反应。此外,游离阿魏酸通过激活Keap1-Nrf2 信号通路可以提高了宿主的抗氧化能力,包括增加抗氧化酶活性和降低ROS 浓度。PPAR是一类配体,被核转录因子激活。已有研究表明,当Nrf2 敲除或其活性被抑制时,基因表达也会下调,表明是PPAR信号通路的重要转录调控因子。同时,有文献报道,PPAR的激动剂罗格列酮可增强结肠炎小鼠基因表达,下调NF-B和TNF-的表达,提示可竞争性抑制NF-B的激活。同时,SCFA 激活GPRs 增加了肝脏和肌肉中AMP 激活的蛋白激酶活性,进而激活和PGC-1,导致脂肪酸氧化改善和脂肪积累减少。因此,由SCFA 和阿魏酸共同介导的信号通路在调节宿主的抗氧化能力、免疫功能和脂肪酸代谢方面发挥重要作用。基于上述研究结果推测,微生物发酵产生的阿魏酸和SCFA 对宿主健康和代谢具有潜在的相互作用。其中,阿魏酸可通过调控Keap1-Nrf2 信号激活,并与SCFA 共同抑制NF-B 信号的磷酸化。因此提出假设,AX 被微生物降解生成的阿魏酸通过活化Keap 1-Nrf2 激活,继而协同SCFA 抑制NF-B 表达以缓解仔猪的断奶氧化应激并提高肠道免疫屏障功能。然而,作为SCFA 和阿魏酸之间的枢纽来调控谷物阿魏酸化AX 的益生元效应的假说有待进一步实验验证。

图3 阿魏酸和SCFA 调节机体肠道健康的潜在联系(自绘)
6 小 结
谷物来源的AX 在调节肠道微生物群落、肠道屏障、免疫功能、糖脂代谢等方面发挥着重要作用。到目前为止,AX 对宿主健康和代谢的潜在分子机制是通过激活GPRs 或抑制HDAC 活性来抑制微生物发酵产生的SCFA 介导的NF-B 信号通路。阿魏酸激活Keap1-Nrf2 信号通路,调控仔猪断奶后肠道氧化还原状态。在调节机体免疫应答反应和抗氧化功能中均发挥重要的作用。因此,本文提出假设,即AX 被微生物降解生成的阿魏酸通过活化Keap 1-Nrf2 激活PPAR,继而协同SCFA 抑制NF-B 表达以缓解仔猪的断奶氧化应激,并提高肠道免疫屏障功能。

