中药通过激活内源性神经干细胞治疗阿尔茨海默病的研究进展
宋宛珊 赵冠华 徐伟 朱金墙,3
(1天津中医药大学第二附属医院,天津 300250;2天津中医药大学;3天津中医药大学中医药研究院组分中药国家重点实验室)
阿尔茨海默病(AD)是一种起病隐匿的进行性发展的神经系统退行性疾病,临床上表现为记忆障碍、失语、失用、失认、视空间技能损害、执行功能障碍及人格和行为改变等全面性痴呆。由于其病理机制极其复杂,至今未能完全阐明,目前对其治疗只能缓解症状以提高患者生活水平,尚无法阻止神经变性,故不能康复〔1〕。上个世纪90年代,Johnasson等〔2〕在胚胎和成年个体的神经系统中发现了神经干细胞(NSCs),它们具有自我更新、多潜能分化、迁移及良好的组织融合性和低免疫源性等特点,可分化成神经元、星形胶质细胞和少突胶质细胞。由于NSCs可修复及补充受损的神经细胞,增强神经突触之间的联系,建立新的神经环路,改善认知功能,故NSCs疗法已成为治疗AD的新手段〔3〕。根据来源不同,可将NSCs分为外源性和内源性两大类,其中外源性NSCs不仅难以找到合适的来源,并存在伦理问题及免疫反应等局限性;而内源性NSCs可以少量增殖、迁移,分化成相应组织细胞以修复病变组织及改善机体功能,并可随着环境的变化而调整增殖与分化的速度,不局限于正在进行神经组织生成的区域,且可以避免免疫反应、肿瘤发生及伦理问题〔4〕。研究表明AD患者本身能够一定程度诱导内源性NSCs活化,以实现机体功能的代偿恢复,但还不足以完全修复损伤,且随着病程的延长及年龄的逐渐增长,内源性NSCs的活化亦发生障碍〔3〕。因此,激活内源性NSCs其分化成新的神经元以替代死亡的神经元是治疗AD的有效途径之一〔5〕。近年来,通过外源性手段激活内源性NSCs而治疗AD受到医学界的广泛关注〔6〕。部分中药可通过多种途径激活内源性NSCs,促进其增殖,进行自我更新和定向分化,并迁移至靶区进一步分化与整合〔7〕,从而有效治疗AD。本研究将近年来中药通过激活内源性NSCs治疗AD的理论基础和调控机制研究进行综述,为进一步探讨中药治疗AD的作用机制提供参考。
1 理论基础
诸多中医古籍中均提出脑与肾具有密切关系,而从现代医学角度分析,肾与干细胞又密切相关。《灵枢·海论》曰:“脑为髓之海”,李时珍《本草纲目·辛夷·发明》云:“脑为元神之府”,而《素问·阴阳应象大论》指出:“肾主骨生髓” 。可见,精髓、气血为产生神的物质基础,脑赖精髓和气血的濡养才能进行各种功能活动。故《灵枢·海论》又云:“髓海不足,则脑转耳鸣,胫酸眩冒,目无所见,懈怠安卧。”因而,若精髓、气血不足,髓海失养,则脑病生焉。《灵枢·经脉》和《难经》亦提到脑与肾通过督脉相联系,二者关系紧密,相互影响。中医理论认为:“肾藏精,主骨,生髓。” 肾藏有来源于父母的“先天之精”,参与并促进胚胎的形成;胚胎干细胞来自于受精卵囊胚期(尚未着床)的内细胞团,内细胞团在母体内分化形成胎儿。可见,二者都是先身而生,来源相同。此外,中医理论还指出 “肾受五脏六腑之精而藏之”,认为肾精能够化生元气,元气通过三焦布散全身,内至脏腑经络,外达肢节皮毛,成为维持组织器官正常结构和激发推动其功能活动的重要动力;存在于成年个体组织的成体干细胞是胚胎发育过程中胚胎干细胞分化到一定阶段停留在组织中,具有维持机体正常组织结构与功能的作用。因而,肾精与干细胞的来源、分布与功能均相似。
近年来,医药研究者运用现代科学技术方法对肾精与干细胞的关系进行了深入研究。张进等〔8〕认为全能干细胞蕴藏了全部先天之精,并将已发现的多种全能成体干细胞的功能与“精”的繁衍生殖、生长发育、生髓化血等功能相比较,认为“精”与干细胞基本属性较相似,进而提出新的学术观点:干细胞具有先天之精的功能,是先天之精在细胞层次的存在形式。沈自尹〔9〕提出,在正常情况下,肾所藏之精是相对静止的,干细胞也同样处于休眠状态。因此,肾精与胚胎干细胞及其他分化为各组织器官的成体干细胞性能相似,干细胞具有先天之精的属性。张金生等〔10〕从生命起源、生理功能和衰老机制等方面分析干细胞与中医肾精同一性,进一步阐释了干细胞是“肾精”的重要细胞生物学基础。本课题组通过实验研究与文献分析,认为肾精与干细胞在来源、分布、功能上具有相近之处,肾精的物质基础主要或部分体现为干细胞及其功能,肾精亏虚导致的AD势必影响到NSCs及其功能,初步阐明了“肾生髓,脑为髓之海”的现代生物学基础(图1)〔11〕。
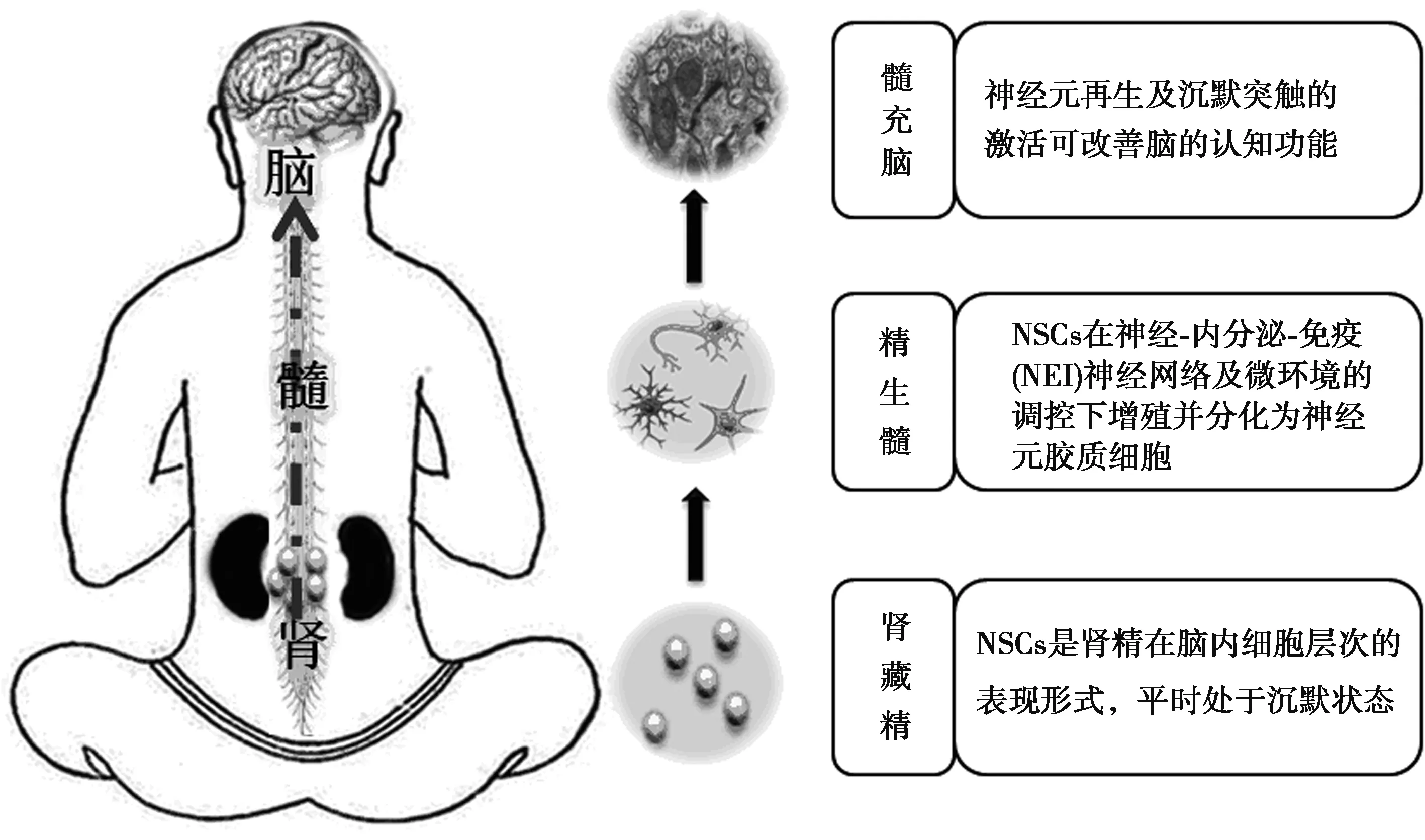
图1 “肾生髓,脑为髓之海”的现代生物学基础示意图
2 中药调节NSCs活化的机制
内源性NSCs活化的调控机制非常复杂,各种调控信号分子相互协同与依赖,NSCs的内在分化程序、所处微环境中的细胞因子、细胞外基质、黏附分子、细胞间相互作用等均与其增殖、分化密切相关〔12〕。这些调控机制可归纳为直接调控和间接调控,后者又可分为“自身转录因子和蛋白”与“微环境”两大类。中药既可以直接诱导内源性NSCs定向分化成神经元,又可以调控其转导基因信号间接促使内源性NSCs定向分化成神经元,并能通过改变其所处微环境中的神经递质、神经生长因子等物质的含量,从而间接激活内源性NSCs。
2.1直接调控 NSCs在一定条件下可以被诱导分化成神经元、星形胶质细胞和少突胶质细胞。部分中药单体、有效成分、中药复方可直接诱导内源性NSCs的分化,抑制脑内神经元、星形胶质细胞的凋亡,并促使神经元再生,替换坏死的神经元,从而有利于治疗AD(表1)。

表1 中药直接诱导内源性NSCs增殖与分化
2.2间接调控
2.2.1自身转录因子和蛋白 内源性NSCs自身的转录因子及其他功能蛋白可调控其发育,这些转录因子在特定时间通过某一途径启动或阻止下游基因表达以决定其分化命运。碱性螺旋-环-螺旋(bHLH)基因是决定神经细胞分化的功能基因,主要调节神经元及胶质细胞的命运选择,其表达异常可使神经元分化率减少,但是对胶质细胞分化率无影响〔33,34〕。DNA结合抑制因子(Id)作为bHLH转录因子的转录抑制因子,是细胞增殖、分化、死亡等活动的重要调控因子,IdS家族的重要成员Id2具有抑制分化和促进增殖的双重作用〔35,36〕。细胞因子的效应又受多种因子的调节,包括细胞因子信号抑制因子(SOCS)家族。该家族的SOCS2是一种潜在的神经分化调控因子,可负性调节生长激素(GH)信号〔37,38〕,在控制神经细胞分化和决定细胞命运方面发挥重要作用,能促进NSCs向神经元而非胶质细胞方向分化,并能通过与GH信号无关的通路调节表皮生长因子受体(EGFR)磷酸化,促进神经突起生长〔39,40〕。因而,SOCS2对神经元的结构和功能均具有重要作用。
中药可通过调控转导基因信号,使内源性NSC定向分化成神经元,从而改善AD患者症状或减缓AD的病理进程。银杏内酯B可使 Id2表达下降,从而与E蛋白结合减少,导致其对bHLH转录因子抑制作用减弱;还可上调SOCS2表达,一方面通过抑制JAK/STAT信号转导途径,阻断GH信号,促进NSCs向神经元分化,另一方面通过与EGFR结合,导致EGFR持续磷酸化,促进突起生长,从而发挥促进神经元分化和结构功能成熟的生物学效应〔41〕。这可能是银杏内酯B间接促进NSCs向神经元方向分化的作用机制之一。
2.2.2微环境 NSCs的增殖、分化等行为高度依赖于其生长的环境,即NSCs微环境。内源性NSCs所处的微环境亦可调控其发育过程。微环境包括细胞因子〔碱性成纤维细胞生长因子(bFGF)、血管内皮细胞生长因子(VEGF)、神经营养因子(NF)、脑源性神经生长因子(BDNF)、β-转化生长因子 (TGF)超家族〕、神经递质〔包括谷氨酸(Glu)、5-羟色胺(HT)、γ-氨基丁酸(GABA)、乙酰胆碱(ACh)、神经细胞黏附分子(NCAM)等〕、血小板衍化生长因子(PDGF)及激素等,它们通过调节黏着性和迁移能力使神经细胞维持存活,促使突触增长和细胞有丝分裂等,从而影响NSCs的增殖与分化〔42~45〕。内源性NSCs处于不同的微环境,其分化方向也不一样。
部分中药有效成分及复方可通过改变内源性NSCs所处微环境中的神经递质、神经生长因子等物质的含量,从而激活内源性NSCs以治疗AD(表2)。

表2 中药通过改变内源性NSCs所处的微环境促进其增殖与分化
综上,随着全球人口老龄化的日趋严重,AD发病率居高不下,不仅严重危害患者的生命和健康,也给家庭和社会带来沉重负担。单一成分、单一靶点的化学药物研发已经遇到瓶颈,越来越多的医药工作者将目光集中到具有多成分、多靶点、多途径等作用特点的中药上。由上文可见,中药可以通过直接和间接途径激活内源性NSCs,促进其增殖与迁移,并促使其向神经元定向分化(图2),从而治疗AD,发挥独特的优势。
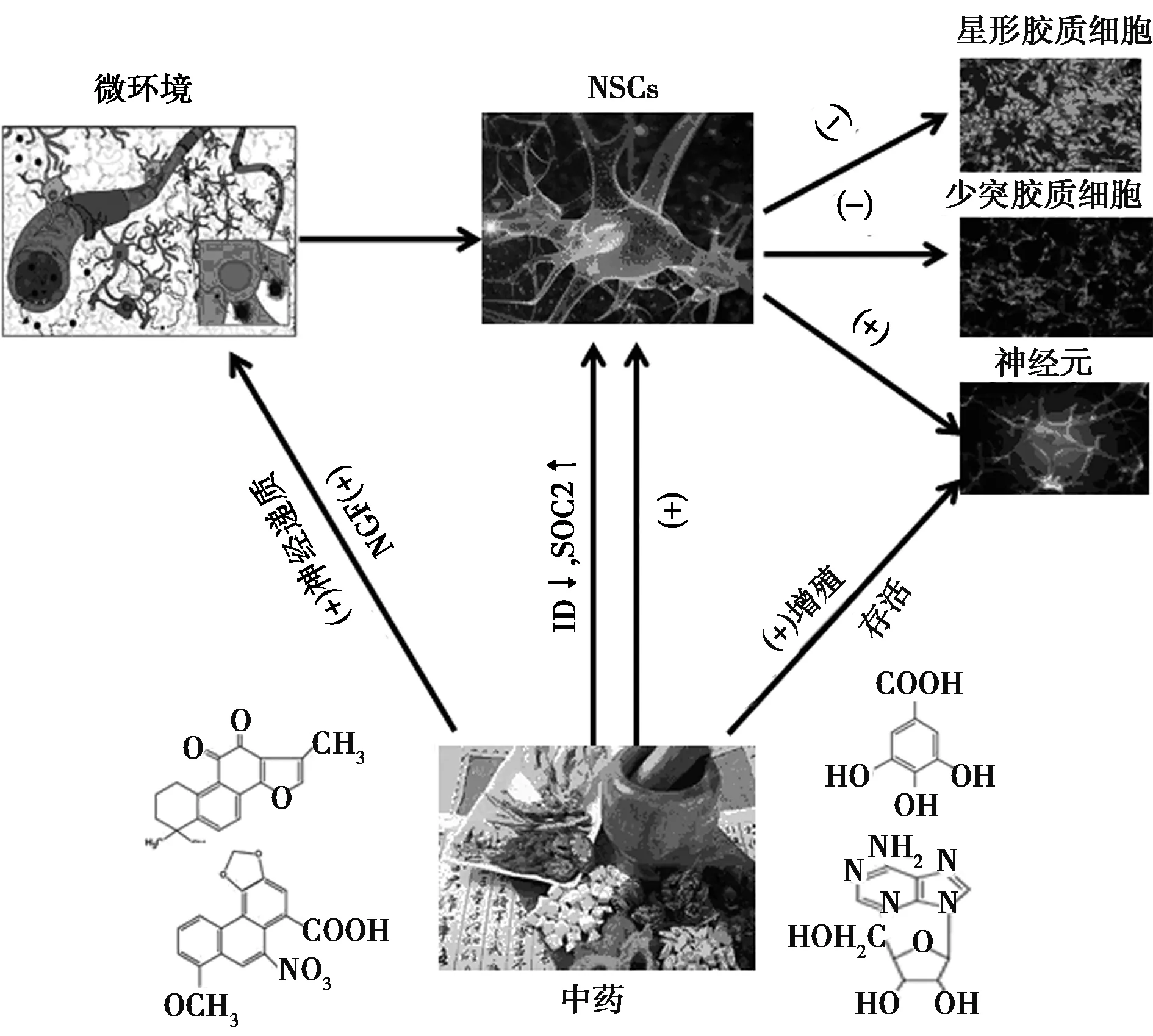
图2 中药调节NSCs活化的机制示意
但是,目前针对中药激活内源性NSCs治疗AD的实验研究较少,并存在以下问题:(1)评价指标不同:实验者由于目的不同和实验条件的差异,选择的评价指标也存在很大差异,故即使研究同一药物,其可比性也较差;(2)研究不全面:对中医药诱导内源性NSCs的增殖、迁移和分化的具体机制尚缺乏系统研究;(3)缺乏临床验证:中药促进NSCs分化成神经元后在体内是否发挥作用,对AD患者的疗效及安全性尚无明确的临床证据进行验证。因此,在今后实验研究中,应该统一评价指标,更深入、更系统地研究中药激活内源性NSCs以治疗AD的作用及机制,并通过临床研究确认其有效性及安全性,为临床治疗AD提供新思路和手段。
此外,研究发现由脑内Aβ寡聚物介导的神经再生障碍是AD神经退化的早期事件〔50〕,且Aβ1-42可通过细胞外调节蛋白激酶(ERK)-丝裂原活化蛋白激酶(MAPK)信号通路抑制NSCs迁移〔51〕;Aβ还能不可逆地干扰线粒体氧化状态及阻断线粒体生物发生和动力学,从而降低NSCs活力,并抑制其增殖与分化〔52〕。反之,NSCs可通过分泌外泌体促进突触抵抗Aβ的神经毒性〔53〕。可见Aβ与NSCs活化之间存在相互制约作用。因此,有必要深入探讨中药通过抑制Aβ产生和清除Aβ而促进NSCs活化的作用及机制,为中医药治疗AD寻找新的突破。

