柴胡皂苷A对溃疡性结肠炎大鼠IKK/IKB/NF-κB信号通路及肠上皮细胞凋亡的影响
高飞 徐琪 林怡 张杰伟
(海南医学院第一附属医院消化内科,海南 海口 570100)
溃疡性结肠炎(UC)以结肠溃疡糜烂为主要特点,与遗传、感染、环境等多因素有关〔1〕;且久治不愈,病情反复,具有癌变倾向并伴随多种复杂肠外表现,严重影响患者生活和工作〔2〕。肠道上皮细胞通透性增加和免疫炎症是主要致病因素,且肠上皮细胞凋亡可能在这一病因中发挥重要作用〔3〕。柴胡皂苷(SS)A具有强抗炎活性,主要通过抑制核因子(NF)-κB信号通路发挥抗炎特性,进而缓解炎症类疾病〔4〕。而在NF-κB抑制物激酶(IKK)/抑制因子κB(IKB)/NF-κB信号通路中抑制IKKα/NF-κB途径可抑制促凋亡蛋白B细胞淋巴瘤-2基因相关X蛋白(Bax)和天冬氨酸特异性半胱氨酸蛋白酶(caspase)-3的表达、增加抗凋亡B细胞淋巴瘤-2基因(Bcl-2)的表达从而发挥抗凋亡作用〔5〕。推测SSA在UC中影响IKK/IKB/NF-κB信号通路及肠上皮细胞凋亡。因此,构建UC模型,SSA处理后观察对UC大鼠的影响,并初步探讨其机制。
1 材料与方法
1.1材料
1.1.1实验动物 SPF级、健康SD大鼠60只均购自北京维通利华实验动物有限公司,动物生产许可证号:SCXK(京)2018-0009,动物使用许可证号:SYXK(京)2018-0047,动物质量合格证号:HG2019131476。所有动物均在温度24.5℃左右、湿度50%左右、12 h光照12 h黑暗条件下饲养,正常摄食饮食,且定期通风。本实验均经医院伦理委员会批准。
1.1.2主要试剂与仪器 2,4,6-三硝基苯磺酸(TNBS,赛默飞世尔科技中国有限公司,批号:556974);SSA(原料药,纯度99%,上海源叶生物科技有限公司,批号:20736-09-8);柳氮磺吡啶(SASP)肠溶片(上海中西三维药业有限公司,规格0.25g/片,批号:20191213);苏木素-伊红(HE)染色试剂盒、TUNEL细胞凋亡试剂盒、聚偏氟乙烯(PVDF)膜(碧云天生物科技有限公司,批号分别为:C0105、C1086、SF1127);大鼠白细胞介素(IL)-1β、IL-6、肿瘤坏死因子(TNF)-α酶联免疫吸附试验(ELISA)试剂盒(南京森贝伽生物科技有限公司,批号分别为:SBJR0546、SBJR0311、SBJR1937);一抗IKKα、IKB、NF-κB p65、caspase-3、Bcl-2、Bax、GAPDH抗体(英国abcam公司,批号分别为:ab197742、ab234570、ab100785、ab32041、ab32518、ab207297、ab13847);羊抗鼠二抗(上海中科英沐生物科技有限公司,批号:PB004F6)。显微镜(日本尼康公司,型号:LV100ND型);凝胶电泳仪(北京金时速仪器设备有限公司,型号:DYCP-44N型);凝胶成像系统(美国Bio-Rad公司,型号:GelDoc 2000)。
1.2方法
1.2.1动物造模 根据参考文献〔6〕方法制备UC大鼠模型,50只大鼠麻醉后,一次性将100 mg/kg TNBS和50%乙醇混合物0.25 ml经14号导尿管缓慢注射入肛门8 cm左右深的肠腔内,捏紧肛门并倒置数分钟。造模后随机分为模型组、SSA(低、中、高)剂量组、阳性对照组,每组10只。正常组10只大鼠相同方法注射等体积生理盐水。常规饲养2 d。第3天时SSA(低、中、高)剂量组分别灌胃(12.5、25.0、50.0)mg/kg SSA〔7〕,阳性对照组灌胃0.5 g/kg SASP〔8〕,正常组和模型组灌胃等体积生理盐水,1次/d,连续5 d。
1.2.2收集样本 实验过程中观察大鼠大便,毛色情况。结束后立即尾静脉采血;处死大鼠取肠黏膜组织,部分置于4%多聚甲醛固定,部分置于-80℃冰箱待用。
1.2.3HE染色观察肠黏膜组织形态 肠道经4%多聚甲醛固定24 h后经乙醇脱水、二甲苯透明后包埋切片(厚度6 μm),部分经苏木素染色、伊红复染后显微镜下观察肠黏膜组织形态。
1.2.4ELISA检测血清中IL-1β、IL-6、TNF-α水平 尾静脉血室温静置2 h,3 000 r/min离心10 min,收集上清,大鼠IL-1β、IL-6、TNF-α ELISA试剂盒检测血清中IL-1β、IL-6、TNF-α水平。
1.2.5TUNEL染色观察肠上皮细胞凋亡情况 取1.2.3切片,TUNEL细胞凋亡试剂盒检测肠上皮细胞凋亡情况,显微镜下可见凋亡肠上皮细胞荧光显绿色,正常肠上皮细胞细胞核DAPI染色荧光显蓝色。细胞凋亡率=凋亡细胞数/总细胞数×100%。
1.2.6Western印迹检测肠黏膜组织中IKKα、IKB、NF-κB p65、caspase-3、Bcl-2、Bax蛋白水平 -80℃冰箱中取部分肠组织约30 mg,手术剪剪碎组织,每管加1 ml蛋白裂解液冰上研磨并裂解,4℃、13 400 r/min离心20 min,上清液即为肠组织总蛋白。凝胶电泳分离蛋白质、PVDF膜转膜、5%脱脂奶粉室温封闭2 h,加入一抗IKKα、IKB、NF-κB p65、caspase-3、Bcl-2、Bax、GAPDH(稀释比均为1∶1 000)4℃孵育过夜,第二天加入羊抗鼠二抗(稀释比为1∶5 000)室温孵育1 h。蛋白凝胶成像系统拍照和定量分析。
1.3统计学分析 采用SPSS24.0软件进行方差分析,组间两两比较采用SNK-q法。
2 结 果
2.1SSA对大鼠行为学影响 正常组大鼠实验结束后毛色有光泽,大便正常;模型组大鼠毛色暗淡无光泽,大便出现不同程度的便血现象,便稀且黏;SSA 低、中、高剂量组、阳性对照组大鼠毛色较暗淡,大便出现不同程度的缓和。
2.2SSA对肠黏膜组织的影响 正常组肠黏膜组织完整,肌层结构正常;模型组肠黏膜处出现明显炎症现象,细胞排列紊乱,部分结肠腺体被浸润的炎症细胞替代,黏膜层变薄;SSA 低、中、高剂量组、阳性对照组出现不同程度的炎症浸润和肠腺溃疡现象,但较模型组有所降低。见图1。
2.3SSA对血清中IL-1β、IL-6、TNF-α的影响 与正常组相比,模型组血清中IL-1β、IL-6、TNF-α水平显著升高(P<0.05);与模型组相比,SSA 低、中、高剂量组、阳性对照组血清中IL-1β、IL-6、TNF-α水平显著降低(P<0.05);随着SSA给药剂量的增加,SSA各剂量组血清中IL-1β、IL-6、TNF-α水平逐渐降低(P<0.05),呈剂量依赖性。见表1。

图1 各组肠黏膜组织形态学情况(HE染色,×200)
表1 6组血清中IL-1β、IL-6、TNF-α水平比较
2.4SSA对肠上皮细胞凋亡的影响 与正常组相比,模型组肠上皮细胞凋亡率明显升高(P<0.05);与模型组相比,SSA 低、中、高剂量组、阳性对照组肠上皮细胞凋亡率明显降低(P<0.05);随着SSA给药剂量的增加,SSA各剂量组肠上皮细胞凋亡率明显降低(P<0.05),呈剂量依赖性。见表1、图2。
2.5SSA对肠黏膜组织中IKKα、IKB、NF-κB p65、caspase-3、Bcl-2、Bax蛋白水平的影响 与正常组相比,模型组肠黏膜组织中IKKα、IKB、NF-κB p65、caspase-3、Bax水平明显升高,Bcl-2蛋白水平明显降低(均P<0.05);与模型组相比,SSA 低、中、高剂量组、阳性对照组肠黏膜组织中IKKα、IKB、NF-κB p65、caspase-3、Bax蛋白水平明显降低,Bcl-2蛋白水平明显升高(均P<0.05);随着SSA给药剂量的增加,SSA各剂量组肠黏膜组织中IKKα、IKB、NF-κB p65、caspase-3、Bax蛋白水平逐渐降低,Bcl-2蛋白水平逐渐升高(均P<0.05),呈剂量依赖性。见表2、图3。
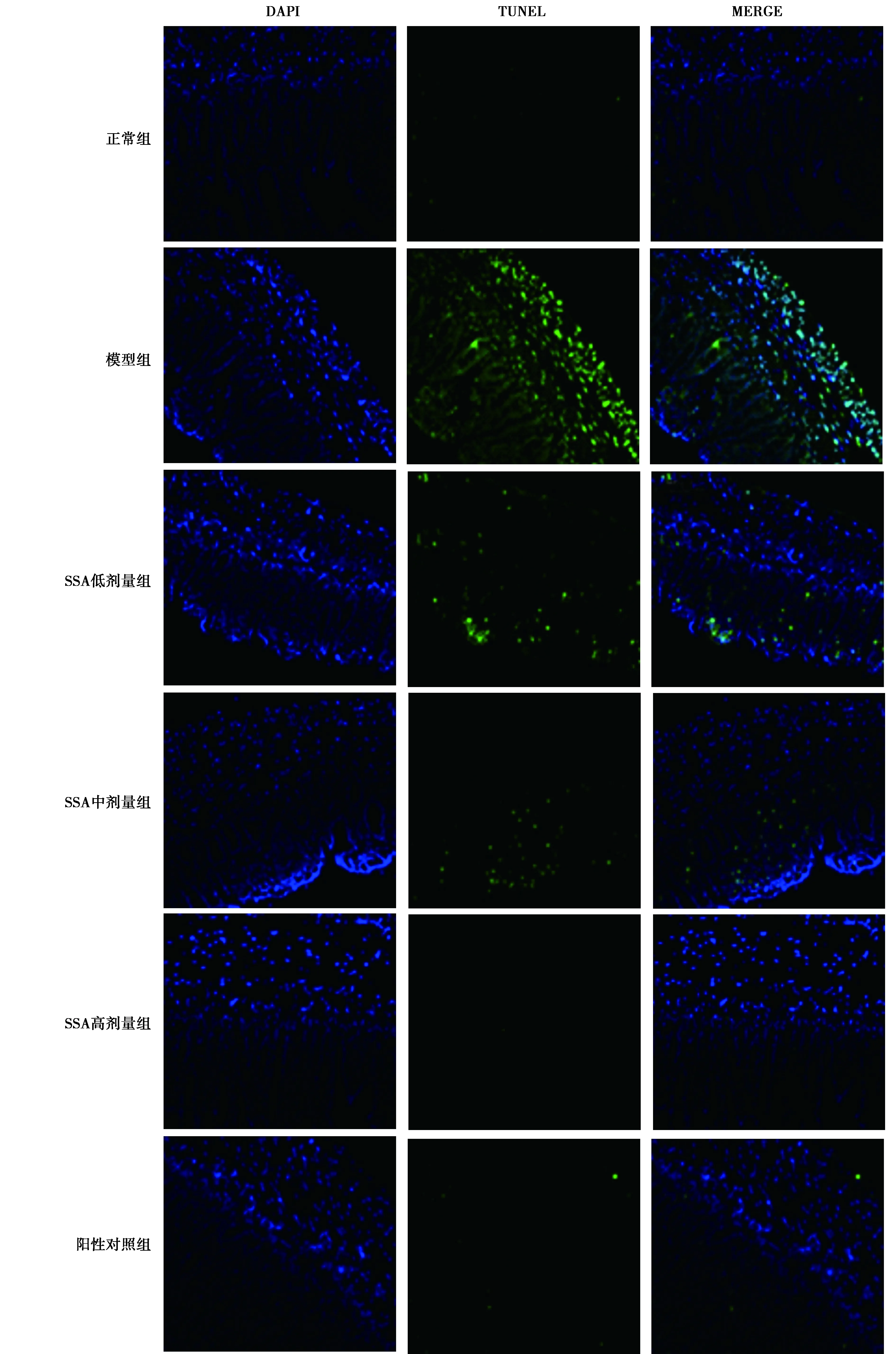
图2 6组肠上皮细胞凋亡情况(×200)
表2 6组肠黏膜组织中IKKα、IKB、NF-κB p65、caspase-3、Bcl-2、Bax蛋白水平比较
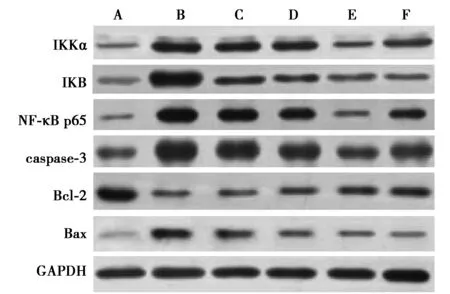
A~F:正常组、模型组、SSA低剂量组、SSA中剂量组、SSA高剂量组、阳性对照组图3 各组肠黏膜组织中IKKα、IKB、NF-κB p65、caspase-3、Bcl-2、Bax Western印迹
3 讨 论
中医《皇帝内经》中将UC归为“肠癖”“大癖泄”“久痢”“下痢”“泄泻”“休息痢”等范畴,发病与情志所伤、饮食不节制不规律、脾胃虚弱等因素有关,目前尚未明确特效药〔9〕。西医治疗UC,轻者较长时间使用水杨酸剂、重者使用激素甚至免疫抑制剂,缓解后仍需使用较长时间的水杨酸制剂,造成复发率高且存在较多的不良反应〔10〕。柴胡最早在《神农本草经》中记载,具有疏肝解郁、保肝利胆、降温抗癌等功效,有效成分SSA具有抑制炎症因子作用〔11〕;亦能够通过信号通路影响细胞增殖从而影响凋亡〔12〕。本研究提示UC大鼠肠道出现损伤,导致大鼠肠道吸收受到影响,影响大鼠毛色和大便状态。SSA可以改善肠黏膜组织症状,减少炎症现象,从而缓解疾病。
IL-1可由单核、巨噬、中性粒、内皮细胞分泌,包括IL-1α、IL-1β,IL-1β可趋化中性粒细胞等炎症细胞进入肠道病变组织,诱发肠道炎症和肠道组织破坏〔13〕。IL-6主要由巨噬、淋巴、内皮细胞分泌,可介导NF-κB信号通路进而诱导细胞间黏附因子的极化,而细胞间黏附因子是UC中中性粒细胞-上皮细胞间相互作用的重要黏附颗粒〔14〕。TNF-α是由细菌脂多糖激活单核巨噬细胞产生,可促进肠上皮细胞的分泌,促进嗜酸性、嗜碱性细胞的分泌;可改变肠上皮细胞形态和屏障功能,诱导肠上皮黏膜通透性改变〔15〕。本研究与Zhu等〔16〕研究结果类似,提示IL-1β、IL-6、TNF-α等炎症因子在UC中处于激活状态,可刺激中性粒细胞、单核巨噬细胞等的分泌,加重肠道损伤;促进信号通路表达,引发肠道结构发生变化。本研究提示SSA可抑制炎症因子的表达,从而缓解疾病。
NF-κB作为重要的基因转录因子,在炎症、氧化应激、细胞凋亡等过程中发挥重要作用〔17〕。IKK/IKB/NF-κB信号通路中IKKα控制NF-κB p65的磷酸化过程从而影响DNA结合活性,同时IKKα过度表达可诱导TNF-α的反应,即NF-κB的凋亡和活化过程〔18,19〕。而Bcl-2家族蛋白是线粒体凋亡的关键蛋白,Bcl-2主要调控凋亡途径的阻断过程,可阻断、抑制细胞凋亡;Bax可拮抗Bcl-2,发挥促凋亡作用〔20〕。caspase-3在caspase级联反应执行中发挥核心地位,是细胞凋亡的主要反映因子,是多种细胞凋亡信息传递的汇聚点〔21〕。本研究提示SSA可抑制IKK/IKB/NF-κB信号通路从而抑制炎症因子水平,对凋亡基因的促进作用减弱,抑制肠上皮细胞凋亡,实现对UC大鼠的保护。

