虾青素预处理抑制高糖作用下晶状体上皮细胞损伤的机制
张露 赵芳 杨万举 项奕
(华中科技大学同济医学院附属武汉市中心医院眼科,湖北 武汉 430030)
糖尿病白内障的发生与晶状体上皮细胞损伤有关,高血糖条件下,晶状体上皮细胞发生氧化损伤和细胞凋亡,导致晶状体上皮细胞功能缺失〔1,2〕。虾青素是一种萜烯类化合物,属于类胡萝卜素,虾青素在自然界内广泛分布,有清除氧自由基、抗衰老、提高免疫力、抗肿瘤等作用〔3〕。虾青素有保护视力的作用,其可改善视网膜损伤,虾青素预处理减少视网膜色素上皮细胞氧化损伤〔4〕。研究表明,虾青素能保护晶状体上皮细胞损伤,其可抑制紫外线诱导的晶状体上皮细胞凋亡〔5〕。虾青素处理后,高糖条件下肾小管上皮细胞氧化损伤和细胞凋亡水平均下降〔6〕。现阶段对虾青素在高糖条件下晶状体上皮细胞损伤中的作用还不明确。本研究探讨虾青素预处理对糖尿病晶状体上皮细胞损伤的作用和机制。
1 材料与方法
1.1材料 虾青素购自北京索莱宝科技有限公司;Notch1抗体、B细胞淋巴瘤(Bcl)-2相关X蛋白(Bax)抗体、Notch1受体胞内结合域(NICD)1抗体购自美国Invitrogen;丙二醛(MDA)含量检测试剂盒、超氧化物歧化酶(SOD)含量检测试剂盒购自北京百奥莱博科技有限公司;Bcl-2抗体、发状分裂相关增强子(Hes)1抗体购自碧云天生物技术有限公司;谷胱甘肽过氧化物酶(GSH-Px)含量检测试剂盒购自上海超研生物科技有限公司;过氧化氢酶(CAT)含量检测试剂盒购自上海古朵生物科技有限公司;人晶状体上皮细胞系(SRA01/04)购自通派(上海)生物科技有限公司。
1.2实验分组 晶状体上皮细胞用含有100 μg/ml链霉素、100 U/ml青霉素的DMEM培养,培养液中添加10%的胎牛血清,培养条件为:37℃,5% CO2培养箱。晶状体上皮细胞共分成5组:(1)对照组:正常培养;(2)HG组:在实验0 h时以30 mmol/L〔2〕的葡萄糖细胞培养液培养;(3)实验-L组:在实验开始前24 h,以4 μg/L的虾青素细胞培养液培养预处理,然后在实验0 h时,添加30 mmol/L的葡萄糖继续培养;(4)实验-M组:在实验开始前24 h,以8 μg/L的虾青素细胞培养液培养预处理,然后在实验0 h时,添加30 mmol/L的葡萄糖继续培养;(5)实验-H组:在实验开始前24 h,以16 μg/L的虾青素细胞培养液培养预处理,然后在实验0 h时,添加30 mmol/L的葡萄糖继续培养。
1.3CCK-8测定细胞增殖 晶状体上皮细胞分别按照每孔中添加3 000个细胞接种到96孔板内,然后按照各组分组方法处理培养,培养24 h后,将培养板从培养箱内取出,添加CCK-8溶液各10 μl,在酶标仪上测定450 nm的A值,A值越大,细胞增殖活性越强。
1.4流式细胞术测定凋亡 收集各组培养24 h后的细胞,在细胞内添加磷酸盐缓冲液(PBS),1 000 r/min离心10 min,将上清溶液弃掉,在细胞内分别添加300 μl的结合缓冲液,充分混合以后,分别添加10 μl的碘化丙啶(PI)和5 μl的Annexin V-FITC溶液,置于避光条件下结合15 min,以流式细胞仪测定细胞凋亡变化。
1.5检测细胞中MDA、SOD、GSH-Px、CAT水平 收集各组培养24 h后的细胞,以MDA含量检测试剂盒、SOD含量检测试剂盒、GSH-Px含量检测试剂盒、CAT含量检测试剂盒测定MDA、SOD、GSH-Px、CAT水平,步骤同试剂盒说明书。
1.6Western印迹检测Bax、Bcl-2、Notch1、NICD1、Hes1蛋白表达 收集各组培养24 h后的细胞,用含苯甲基磺酰氟(PMSF)的放射免疫沉淀试验(RIPA)裂解液提取各组细胞总蛋白,蛋白浓度检测按照常规二喹啉甲酸(BCA)法测定。在蛋白样品内添加2×上样缓冲液,充分混合,放在100℃中反应5 min。本次实验采用10%的分离胶和5%的浓缩胶进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),每个孔内蛋白样品的上样量为40 μg,首先以90 V的电压在浓缩胶中电泳,然后以100 V的电压在分离胶中电泳,电泳结束以后,取出凝胶,在4℃条件下,以60 V的电压进行转膜。转膜结束以后,将NC膜取出,放在含有5%脱脂奶粉的TBST溶液中,室温结合2 h,然后将NC膜放在含有稀释后的一抗溶液中,在4℃环境中过夜,最后将NC膜放在含有1∶2 000稀释的二抗溶液中,在室温中结合2 h。电化学(ECL)发光法显色,内参为甘油醛-3-磷酸脱氢酶(GAPDH),分析目的蛋白表达变化。Bax、Bcl-2、Notch1、NICD1、Hes1一抗分别按照1∶600、1∶600、1∶800、1∶1 000、1∶1 000稀释。
1.7Notch信号激活剂对虾青素影响细胞增殖、凋亡和MDA、SOD、GSH-Px、CAT水平作用 晶状体上皮细胞在实验开始前24 h,以8 μg/L的虾青素和500 μg/L的Notch信号激活剂Jagged1细胞培养液培养预处理,然后在实验0 h时,添加30 mmol/L的葡萄糖继续培养,记为实验-M+Jagged1组,以实验-M组作为参照,分析细胞增殖(CCK-8法步骤同1.3)、凋亡(流式细胞术步骤同1.4)和Bax、Bcl-2、Notch1、NICD1、Hes1蛋白表达(Western印迹步骤同1.6)及MDA、SOD、GSH-Px、CAT水平(步骤同1.5)。
1.8造模及分组 按照参考文献〔1〕造模方法制备白内障小鼠模型, 虾青素组小鼠在造模的同时给予虾青素灌胃,灌胃剂量为0.24 g/kg,每天灌胃1次,直到造模结束。取小鼠晶状体组织,检测晶状体混浊程度。晶状体混浊程度评分标注参照文献〔1〕。对照组和虾青素组每组9只小鼠。
1.9统计学分析 采用SPSS21.0软件进行t检验和单因素方差分析。
2 结 果
2.1虾青素预处理对高糖作用下晶状体上皮细胞增殖影响 0、4、8、16 μg/L虾青素处理后的晶状体上皮细胞增殖活性(0.66±0.05、0.63±0.05、0.64±0.07、0.62±0.06)差异无统计学意义(P>0.05);与对照组晶状体上皮细胞增殖活性(0.67±0.05)比较,HG组(0.25±0.03)显著下降(P<0.05);与HG组比较,实验-L、实验-M、实验-H组晶状体上皮细胞增殖活性(0.35±0.04、0.49±0.05、0.62±0.06)依次升高(P<0.05)。表明虾青素预处理提高高糖作用下晶状体上皮细胞增殖活性。
2.2虾青素预处理对高糖作用下晶状体上皮细胞凋亡影响 与对照组比较,HG组晶状体上皮细胞凋亡率显著升高,细胞中Bax蛋白表达水平显著升高,Bcl-2蛋白表达水平显著下降(P<0.05);与HG组比较,实验-L、实验-M、实验-H组晶状体上皮细胞凋亡率逐渐降低,细胞中Bax蛋白表达水平逐渐降低,Bcl-2蛋白表达水平逐渐升高(P<0.05)。见图1、图2、表1,表明虾青素预处理抑制高糖作用下晶状体上皮细胞凋亡。
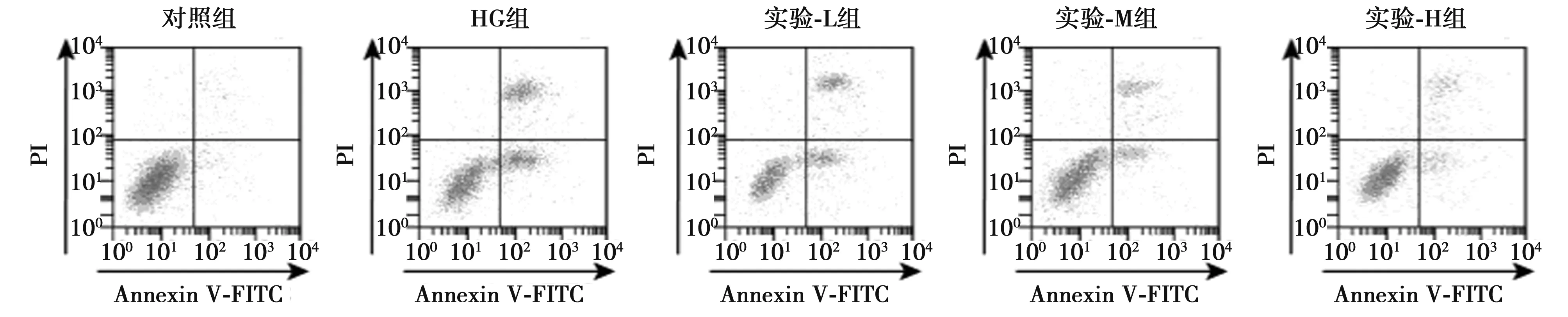
图1 流式细胞术检测凋亡

图2 Western印迹检测Bax、Bcl-2蛋白表达

表1 虾青素预处理后高糖作用下晶状体上皮细胞凋亡率和Bax、Bcl-2蛋白水平
2.3虾青素预处理对高糖作用下晶状体上皮细胞中MDA、SOD、GSH-Px、CAT水平影响 与对照组比较,HG组晶状体上皮细胞MDA水平显著升高,SOD、GSH-Px、CAT水平显著下降(P<0.05);与HG组比较,实验-L、实验-M、实验-H组晶状体上皮细胞MDA水平逐渐降低,SOD、GSH-Px、CAT水平逐渐升高(P<0.05)。见表2。表明虾青素预处理抑制高糖作用下晶状体上皮细胞氧化损伤。
2.4虾青素预处理对高糖作用下晶状体上皮细胞中Notch信号通路影响 与对照组比较,HG组晶状体上皮细胞Notch1、NICD1、Hes1水平显著升高(P<0.05);与HG组比较,实验-L、实验-M、实验-H组晶状体上皮细胞Notch1、NICD1、Hes1水平逐渐降低(P<0.05)。见表2、图3,表明虾青素预处理抑制高糖作用下晶状体上皮细胞中Notch信号通路激活。

表2 虾青素预处理后高糖作用下晶状体上皮细胞中MDA、SOD、GSH-Px、CAT、Notch1、NICD1、Hes1水平

图3 Western印迹检测虾青素处理后高糖作用下晶状体上皮细胞中Notch1、NICD1、Hes1蛋白表达
2.5Notch信号通路激活剂对虾青素预处理影响高糖作用下晶状体上皮细胞中Notch信号通路作用 与实验-M组比较,实验-M+Jagged1组晶状体上皮细胞Notch1、NICD1、Hes1水平显著升高(P<0.05)。见图4,表3。

图4 Western印迹检测Notch1、NICD1、Hes1蛋白表达

表3 Notch信号激活剂和虾青素预处理后高糖作用下晶状体上皮细胞中Notch1、NICD1、Hes1蛋白水平
2.6Notch信号通路激活剂对虾青素预处理影响高糖作用下晶状体上皮细胞增殖、凋亡和MDA、SOD、GSH-Px、CAT作用 与实验-M组比较,实验-M+Jagged1组晶状体上皮细胞增殖活性显著降低,凋亡率显著升高,Bax蛋白表达水平显著升高,Bcl-2蛋白表达水平显著降低,MDA水平显著升高,SOD、GSH-Px、CAT水平显著下降(P<0.05)。见图5、表4。

图5 检测Notch信号激活剂对虾青素预处理影响高糖作用下晶状体上皮细胞凋亡和Bax、Bcl-2蛋白表达

表4 Notch信号激活剂和虾青素预处理后高糖作用下晶状体上皮细胞增殖活性、凋亡率和Bax、Bcl-2蛋白水平及MDA、SOD、GSH-Px、CAT水平
2.7虾青素对糖尿病白内障小鼠晶状体混浊程度的影响 对照组晶状体混浊程度Ⅰ度9例,Ⅱ、Ⅲ度均0例,虾青素组Ⅰ度6例,Ⅱ度3例,Ⅲ度均0例。两组糖尿病白内障小鼠晶状体混浊程度严重,且虾青素组晶状体混浊程度较对照组明显减弱。
3 讨 论
糖尿病的发病率呈逐年上升趋势,糖尿病患者病程较长,长期的高血糖可诱导多种并发症发生,糖尿病白内障是糖尿病引起常见的眼部疾病〔7〕。晶状体上皮细胞是糖尿病白内障的重要靶细胞,其在高糖刺激下发生氧化损伤和细胞凋亡,这也是目前发现的糖尿病白内障发病机制之一〔8〕。正常情况下,存在于机体内的抗氧化系统和氧化系统处于动态平衡状态,而当抗氧化酶活性下降,而机体内氧自由基不断产生时,细胞内过量的氧自由基可诱导脂质发生过氧化,造成细胞损伤〔9〕。SOD、GSH-Px、CAT是存在于机体内的抗氧化酶,其活性下降可诱导氧化损伤〔10〕。MDA是脂质过氧化的产物,其表达水平异常升高是氧化损伤的标志之一〔11〕。研究表明,细胞内过量的氧自由基可诱导细胞凋亡,促进细胞损伤发生〔12〕。Bcl-2蛋白家族是与细胞凋亡关系密切的调控因子,其含有多个成员,分别在细胞凋亡进展中发挥促进和抑制作用,Bax是Bcl-2蛋白家族中的促凋亡蛋白,Bcl-2是Bcl-2蛋白家族中的抑凋亡蛋白〔13〕。本研究结果提示高糖诱导晶状体上皮细胞损伤,说明构建了晶状体上皮细胞损伤模型。
虾青素是一种从藻类、真菌、虾蟹外壳中提取出来的红色类胡萝卜素,其有降低血压、保护神经系统、延缓衰老、保护视力、增加免疫力等功效〔14〕。研究发现,虾青素能抑制紫外线诱导的晶状体上皮细胞损伤〔5〕。虾青素还能改善糖尿病大鼠血管内皮功能障碍,减少血管氧化损伤〔15〕。虾青素预处理后的糖尿病肾小管上皮细胞凋亡水平下降〔6〕。虾青素能预防糖尿病白内障发生〔16〕。本研究结果提示虾青素预处理能通过抑制细胞凋亡和氧化损伤发挥抗糖尿病白内障作用。
Notch是一个高度保守的信号通路,由跨细胞膜配体、受体及下游信号等组成,Notch1是Notch信号的受体之一,Hes1是Notch的下游效应因子,NICD1是Notch信号活化后的形式〔17,18〕。Notch信号有调控细胞增殖、分化、凋亡及氧化应激等作用〔19,20〕。研究显示,Notch与糖尿病并发症有关,在糖尿病肾病发生过程中,人们发现Notch信号病理性激活,影响肾纤维化、足细胞损伤发生〔21~23〕。研究表明,Notch在高糖诱导的晶状体上皮细胞中过度激活,并且抑制Notch信号可减少高糖诱导的晶状体上皮细胞损伤〔24〕。本研究结果说明虾青素作用机制可能与Notch信号有关。激活Notch信号可逆转虾青素预处理对高糖条件下晶状体上皮细胞凋亡和氧化应激的抑制作用,充分证实虾青素作用机制与Notch信号有关。
综上,虾青素预处理能改善高糖诱导的晶状体上皮细胞损伤,减少细胞凋亡和氧化损伤,机制与抑制Notch信号有关,虾青素可能是预防和治疗糖尿病白内障的途径之一。

