沙格列汀片联合二甲双胍治疗2型糖尿病合并动脉粥样硬化患者的疗效及对炎症反应和氧化应激的影响
朱丽丽,傅绪栋,魏淑珍
(聊城市人民医院干部保健病房,山东 聊城 252000)
国际糖尿病联盟发布的第九版《糖尿病图集》数据显示,截至2019年全球糖尿病患者约4.63亿,预计到2045年该病人数将升高至7亿[1],其中2型糖尿病(T2DM)是临床常见的慢性代谢疾病。随着人们物质生活的逐渐提高,生活、饮食结构及老龄化进程的加快,我国T2DM患者数量持续上升。T2DM的发生与心、脑、肝肾代谢均密切相关[2],患者由于胰岛素抵抗带来的糖脂代谢紊乱,使甘油三酯水平失调,加之代谢紊乱引发的炎症反应及氧化应激,增加患者心血管粥样硬化及心血管事件的发生风险。因此,调控T2DM患者血糖水平,改善患者胰岛素敏感性,促进机体恢复正常的糖脂代谢,可延缓心血管并发症的发生,改善患者预后[3]。二甲双胍是临床治疗T2DM的基础药物之一,但有研究[4]指出,大部分患者随着病程延长及胰岛β细胞的功能下降,二甲双胍的作用受到影响。沙格列汀是一种选择性二肽基肽酶-4(DPP-4)的抑制剂,可以在降糖的同时保护残存的胰岛β细胞功能,有利于T2DM远期控制及预后。本研究采用沙格列汀联合二甲双胍治疗T2DM并发动脉粥样硬化,借以观察临床疗效及其对炎症因子及氧化应激的影响。
1 资料与方法
1.1 一般资料
选取2018年6月至2021年4月聊城市人民医院收治的187例T2DM合并颈动脉粥样硬化(AS)患者为研究对象,根据治疗方案不同分为研究组(n=94)及对照组(n=93)。本研究经院伦理委员审核批准,患者及家属均知情并同意,两组患者一般资料比较,差异无统计学意义(P>0.05)。见表1。纳入标准:(1)符合《中国2型糖尿病防治指南(2013版)》[5]中的相关诊断标准:①多饮、多食、多尿及体质量下降;②随机血糖≥11.1 mmol/L,或空腹血糖≥7 mmol/L。(2)颈动脉粥样硬化符合《慢性稳定型心绞痛诊断与治疗指南》中的相关标准,并经冠状动脉造影确诊患者。(3)患者入院时病情稳定,无急性抢救等处理。排除标准:(1)合并I 型糖尿病或糖尿病酮症中毒患者;(2)合并不稳定型心绞痛或有心脏手术史患者;(3)合并心律失常、充血性心率衰竭等患者;(4)合并严重感染患者;(5)合并精神类疾病或语言沟通障碍患者;(6)酗酒或对实验药物过敏者;(7)临床资料不全或依从性差者。(8)未按照实验设计计量或周期服用的患者;(9)无法完成随访或无法联系患者。
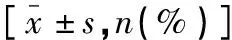
表1 两组患者一般资料比较
1.2 方法
两组患者入组后均进行常规处理,糖尿病患者进行血糖、血脂控制,戒烟戒酒,控制高糖高脂肪饮食,加强运动,对血糖、血压检测、糖尿病足预防等进行健康教育。对照组患者采用口服阿司匹林肠溶片(拜耳医药保健有限公司)100 mg,1次/d+二甲双胍(中美上海施贵宝制药有限公司)0.5 g,3次/d;研究组患者在对照组基础上增加口服沙格列汀片(AstraZeneca Pharmaceuticals LP)0.5 g,1次/d。疗程均为24周。另嘱患者治疗周期结束后来医院复查。
1.3 观察指标
(1)血糖及血脂指标:采集患者治疗前及连续治疗24周后(检查前12 h禁食、禁药,采血时间基本相同)清晨空腹静脉血10 mL,3 500 rpm离心10 min,取上清液置于-80 ℃待测。采用全自动生化分析仪(迈瑞,BS-350S)测量空腹血糖(FBG)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、低密度脂蛋白胆固醇(LDL-C)、总胆固醇(TC)、糖化血红蛋白(HbA1c)水平;采用化学发光法检测空腹胰岛素(FINS),并计算胰岛素抵抗指数(HOMA-IR)=[(FINS ×FBG)/22.5];另抽血检验餐后2 h血糖(PBG)情况,本实验试剂盒均购自上海酶联生物科技有限公司,实验严格按照说明书操作。(2)炎症因子水平:采用酶联免疫吸附法检测(试剂盒购自武汉基因美生物科技有限公司)白细胞介素-6(IL-6)、IL-10超敏C-反应蛋白(hs-CRP)、肿瘤坏死因子α(TNF-α)水平;采用高效液相色谱-荧光法测定血浆同型半胱氨酸(Hcy)水平。(3)氧化应激及颈动脉粥样硬化指标:由同一位资深影像医生运用多功能彩超仪(飞利浦,HD5)进行颈动脉超声检查,将探头测量频率调整至7~10 MHz,取颈部总动脉球部膨大起始处下方10 mm内最厚处测定颈动脉中层厚度(IMT)(扫描图像中颈动脉腔内膜表面与外膜上层回声线前缘间的垂直距离),同时记录斑块面积及数量,并连续测量3次,取均值纳入数据。采用免疫比浊法检测血清丙二醛(MDA)。(4)临床疗效[6]:①治愈:患者临床病症消失,颈动脉厚度变薄,血管腔通畅宽敞;②显效:血糖、血脂指标接近正常范围,蛋白质及糖脂代谢紊乱改善;颈动脉斑块明显减少,血管腔血流较通畅;③有效:血糖、血脂指标均得到有效控制,颈动脉粥样硬化有一定改善;④无效:患者临床指征改善不明显,胰岛素抵抗引起的蛋白质、糖脂代谢紊乱无改善,颈动脉粥样硬化几乎无改善或加重趋势。总有效率=(治愈+显效+有效)例数/总例数×100%。(5)不良反应发生情况:包括头晕、恶心、呕吐、皮疹、心律失常等。
1.4 统计学分析
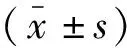
2 结果
2.1 两组患者血糖血脂指标比较
治疗前,两组患者血糖、血脂各项指标比较,差异无统计学意义(P>0.05)。治疗后,研究组患者FBG、PBG、HbA1c、TG、TC、LDL-C水平及HOMA-IR均低于治疗前及对照组(P<0.05);HDL-C、FINS高于治疗前及对照组(P<0.05)。见表2。
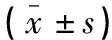
表2 两组患者血糖血脂指标比较
2.2 两组患者炎症因子水平比较
治疗前,两组患者血清各炎症因子水平比较,差异无统计学意义(P>0.05)。治疗后,研究组血清IL-6、hs-CRP、TNF-α、Hcy水平均低于治疗前及对照组(P<0.05);血清IL-10水平高于治疗前及对照组(P<0.05)。见表3。
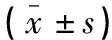
表3 两组患者血清炎症反应相关细胞因子比较
2.3 两组患者氧化应激及颈动脉粥样硬化指标比较
治疗前,两组患者氧化应激及颈动脉粥样硬化指标比较,差异无统计学意义(P>0.05)。治疗后,研究组患者血清MDA水平、IMT、斑块面积及斑块数量均低于治疗前及对照组(P<0.05)。见表4。
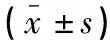
表4 两组患者氧化应激及颈动脉粥样硬化指标比较
2.4 两组患者临床疗效比较
研究组患者总有效率高于对照组,差异有统计学意义(P<0.05)。见表5。
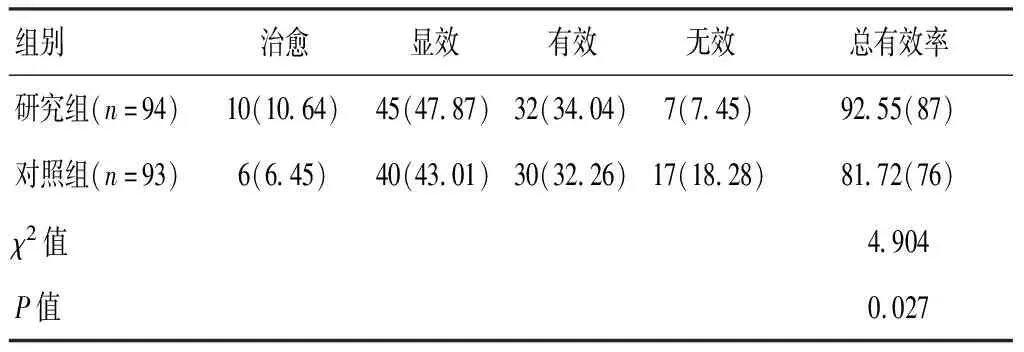
表5 两组患者临床疗效比较[n(%)]
2.5 两组患者不良反应发生情况比较
治疗期间,研究组患者出现头晕、恶心呕吐1例,皮疹1例,不良反应发生率为2.13%;对照组患者出现心律失常2例,皮疹1例,头晕、呕吐1例,不良反应发生率为4.30%。两组患者不良反应发生率比较,差异无统计学意义(P>0.05)。
3 讨论
本研究结果显示,T2DM并发AS患者经规范化治疗后,血糖、血脂各项指标较治疗前均明显改善(P<0.05),血清IL-6、TNF-α、Hcy等炎症相关因子水平均明显降低(P<0.05),IL-10水平升高(P<0.05),MDA水平降低(P<0.05),IMT、斑块面积及斑块数据量均明显下降(P<0.05)。提示两种治疗方式均可改善免疫功能,降低氧化应激反应,改善动脉功能,但沙格列汀联合二甲双胍治疗各项指标改善情况更佳(P<0.05)。
糖尿病分为1型糖尿病、T2DM和特殊类型糖尿病等,1型糖尿病由胰岛素分泌绝对不足引起,T2DM是由胰岛素分泌相对不足或受体受限引起的[7-8],由此可知,胰岛β细胞受损是糖尿病发生的中心因素。由于糖尿病患者体内游离脂肪酸过多,一方面造成脂肪酸以为沉积,造成神经酰胺及一氧化碳生成及释放增加,促进胰岛细胞的凋亡[9];另一方面,通过增加肝糖原输出妨碍葡萄糖的清除,刺激胰岛细胞,逐步促成胰岛素抵抗[10]。此外,游离脂肪酸可通过抑制葡萄糖进入细胞及氧化过程,抑制肌糖原的合成,造成血糖异常升高和糖异生代谢紊乱;通过降低络氨酸激酶活性,抑制胰岛受体底物的表达及生物活性,加重糖代谢紊乱及胰岛素抵抗形成[11]。而紊乱的糖脂代谢过程是机体发生AS的重要病理基础[12],其早期病理即表现为血管内膜下层出现平滑肌细胞及泡沫细胞,并发生胆固醇等脂质类物质异常沉积。因此临床通过结合饮食调整及降糖药物,减低血糖对胰岛β细胞的刺激,降低血浆游离脂肪酸水平,恢复机体正常的糖脂代谢功能,延缓AS的发生。本研究结果显示,两组患者经过规范化治疗后,FBG、PBG、TG、TC、HbA1c、LDL-C水平均明显低于治疗前(P<0.05);HDL-C水平均高于治疗前(P<0.05)。同时近年来的研究[13]指出,炎症反应及氧化应激在T2DM及AS的发生发展中均发挥重要影响。
T2DM患者机体内慢性炎症反应由多种细胞因子介导发生,细胞免疫在该病进程中被过度激活,使患者体内炎症因子水平失衡。IL-6可参与机体炎症反应过程,并可通过调控凋亡控制脂肪和肌肉的总量,是机体能量代谢平衡的重要调节因子。研究[14]显示,IL-6可同时由免疫活性细胞或脂肪及肌细胞分泌,且肥胖患者体内IL-6的水平更高;与健康机体相比,IL-6升高并伴有IL-1β升高的人群更易发展为T2DM。TNF-α参与并介导机体生长、炎症、细胞毒性、免疫调节等多项生命活动的重要细胞因子。有文献[15]指出,TNF-α激活胰岛内的巨噬细胞,释放IL-1,诱导一氧化氮合酶在胰岛β细胞中的表达,促进一氧化氮合酶及一氧化氮的大量释放,抑制胰岛素发挥作用。hs-CRP是机体感染或组织损伤后肝脏分泌的一种急性蛋白,而与健康机体相比,T2DM患者体内hs-CRP也处于异常高水平。T2DM患者胰岛素抵抗过程刺激TNF-α的过表达,使其在血循环中的水平异常升高,并刺激肝脏通过抑制胰岛素受体酪氨酸激酶活性,加重胰岛素抵抗;高血糖环境刺激胰岛细胞大量合成释放IL-6,IL-6通过促进B淋巴细胞分化产生过量IgG,并与其他细胞因子共同产生细胞毒性作用,使胰岛细胞凋亡[16]。Hcy可通过上调IL-6等炎性细胞因子,促进血管内皮黏附因子的表达,加快泡沫细胞的形成。随着血糖水平升高,患者体内糖基化产物增加,血管内皮受损,血管平滑肌细胞增殖进程加快[17]。但有研究[18]指出,在斑块患者体内IL-6、TNF-α、CRP均呈高水平,而IL-10呈低表达。因此,IL-10可能通过抑制TNF-α mRNA下调其表达水平,降低促炎因子释放,减少细胞粘附因子表达,抑制血栓形成,降低一氧化氮合成量等过程,发挥保护机制。本研究结果也显示,两组患者治疗后血清IL-6、TNF-α、hs-CRP、Hcy水平均低于治疗前(P<0.05);IL-10水平升高(P<0.05)。
胰岛素抵抗造成的糖脂代谢紊乱,刺激高活性反应分子性氧簇(ROS)和活性氧簇(RNS)的生成,激活体内氧化应激机制,而胰岛β细胞是重要靶点[19]。ROS可直接损伤胰岛β细胞促进凋亡,并可干预胰岛素信号通路,抑制胰岛β细胞发挥作用。脂质过氧化可直接损伤内皮细胞,破坏PGI2/TXA2平衡,促进血小板聚集及LDL修饰机能,促进AS进展[20]。MDA是观察机体氧化应激的常规指标,可以反应脂质过氧进程。本研究结果显示,两组患者治疗后血清MDA水平及IMT、斑块面积及斑块数量均明显下降。但在上述结果比较中,沙格列汀联合二甲双胍的研究组结果表现更为突出。沙格列汀是DPP-4的抑制剂,通过延缓胰升血糖素样肽-1的降解,进而促进胰岛β细胞分泌胰岛素;抑制胰岛α细胞释放胰高血糖素,降低血糖浓度。临床上常将沙格列汀与二甲双胍联用,发挥两者作用机制互补、糖尿病多重病理生理缺陷的优点[21]。近年来研究[22]显示,沙格列汀可能对心血管疾病发挥作用。该研究指出,DPP-4在内皮细胞中的表达受氧气和葡萄糖耗竭/复氧(OGD/R)诱导,而OGD/R是促进内皮损伤、线粒体功能障碍的重要因子,其通过激活炎症通路及促炎因子的合成及释放,激活并诱导血管黏附因子的黏附作用。该研究证实,沙格列汀可减轻OGD/R诱导的细胞死亡,改善细胞氧化应激反应,通过抑制OGD/R触发的脂肪酸次级产物产生的细胞毒性及基因毒性;降低IL-6、TNF-α、血管黏附因子、单核细胞趋化因子的释放,进而发挥血管内皮细胞的保护作用。
综上所述,沙格列汀与二甲双胍联用可有效改善T2DM患者糖脂代谢情况,降低血清炎症细胞因子水平,降低氧化应激反应,保护胰岛β细胞功能,缓解病程进展。

