黑龙江省马铃薯黑痣病菌融合群类型分析
杨帅,郭梅*,王文重,魏琪,董学志,毛彦芝,闵凡祥,王玲
(1.黑龙江省农业科学院经济作物研究所,黑龙江哈尔滨150086;2.黑龙江省农业科学院耕作栽培研究所,黑龙江哈尔滨150086)
立枯丝核菌(Rhizoctonia solaniKühn)是一种在全球范围内均有分布的土壤习居菌,其侵染寄主广泛、腐生能力强且土壤中存活时间长,被认为是最具破坏性的土传病原之一。该病原菌最早由法国人Kühn于1858年[1]发现,此后美国、澳大利亚、南非等国也分别进行了报道。在中国最早的报道是在20世纪初期,但因当时危害并不严重而未引起人们的关注[2]。在立枯丝核菌的研究方面,因其种内和种间存在着丰富的遗传多样性而被认定为是一个遗传差异较大的复合种。此后,以Schultz[3]提出的菌丝融合概念和Parmeter等[4]提出的种内融合群分类法为基础,日本学者生越明[5]建立的融合群分类法成为国际公认的分类标准。随着国内外学者研究的深入,目前国际公认的已知融合群类型已有14种,分别被命名为AG-1~AG-13及AG-BI[6,7]。此外,根据融合群内的融合频率、寄主范围、培养性状、致病性及生化和遗传特性等差异,一些融合群还可以进一步被划分为不同的亚群。如根据寄主的不同,AG-3融合群还被分为AG-3PT(马铃薯型)、AG-3TB(烟草型)和AG-3TM(番茄型)[8];而根据致病性,AG-1可以被分为IA、IB和IC三个亚群。
马铃薯是中国的第四大粮食作物,具有耐旱、耐贫瘠、广适性强等优点。由立枯丝核菌引起的马铃薯溃疡病和黑痣病是马铃薯生产上极具威胁的一种土传病害[9,10]。该病能在马铃薯生育期持续造成危害,如苗期危害幼芽引起生长点坏死从而导致气生块茎的产生;危害地下茎基部形成褐色梭型条斑导致地上部植株出现萎蔫等症状。同时其菌丝在薯块表皮还可以形成黑色菌核,造成马铃薯块茎表面出现裂口、粗皮、黑痣等症状,严重影响了种薯的品质和商品性,进而造成巨大经济损失[11]。
黑龙江省地处中国东北部,不仅地理位置优越而且兼具得天独厚的冷凉气候,是中国重要的马铃薯种薯及商品薯主产区之一[12]。然而,近年来随着马铃薯产业的快速发展,由于缺乏轮作、种薯调运不当等原因,造成黑龙江省马铃薯黑痣病发生日趋严重,一般年份可达10%~30%,重症地块发病率高达70%~80%,严重影响了马铃薯的产量和品质[13]。本研究采用分子生物学方法,系统分析了近十年来黑龙江省马铃薯主产区黑痣病菌融合群类型变化情况,以期更好地了解黑龙江省黑痣病菌融合群组成、分布及变化动态,进而为制定科学、精准的黑痣病防治策略提供科学依据。
1 材料与方法
1.1 供试材料
供试马铃薯黑痣病样品分别于2012~2021年采自黑龙江省10个马铃薯主产区的21个马铃薯种植区,具体见图1。田间采集样品经常规组织分离法[14]分离后,获得纯化立枯丝核菌菌株,经PDA平板活化后,移入试管PDA斜面,4℃保存、备用。

图1 黑龙江省马铃薯黑痣病样品地理分布Figure 1 Geographical distribution of potato black scurf samples in Heilongjiang Province
1.2 菌株基因组DNA的提取
黑痣病菌经分离、纯化后,采用商业化基因组DNA提取试剂盒提取总DNA。提取DNA后利用微量分光光度计检测DNA纯度,取OD260/OD280比值在1.8~2.0的DNA用于后续PCR扩增试验。
1.3 融合群类型测定
根据White等[15]报道的ITS序列分析法进行融合群测定。采用通用引物(ITS4和ITS5)对菌株样品的ITS1-5.8S-ITS2区段进行扩增,同时利用特异性引物AG-2-1-F/R和Rs1F2/AG-3PR2对AG-2-1和AG-3PT进行辅助验证[16,17],引物见表1。PCR反应条件及体系按照康为世纪生物科技有限公司的2xEs Taq MasterMix产品说明书进行。扩增产物在1.0%琼脂糖凝胶中进行电泳后,利用凝胶成像仪在紫外光下检测并拍照。
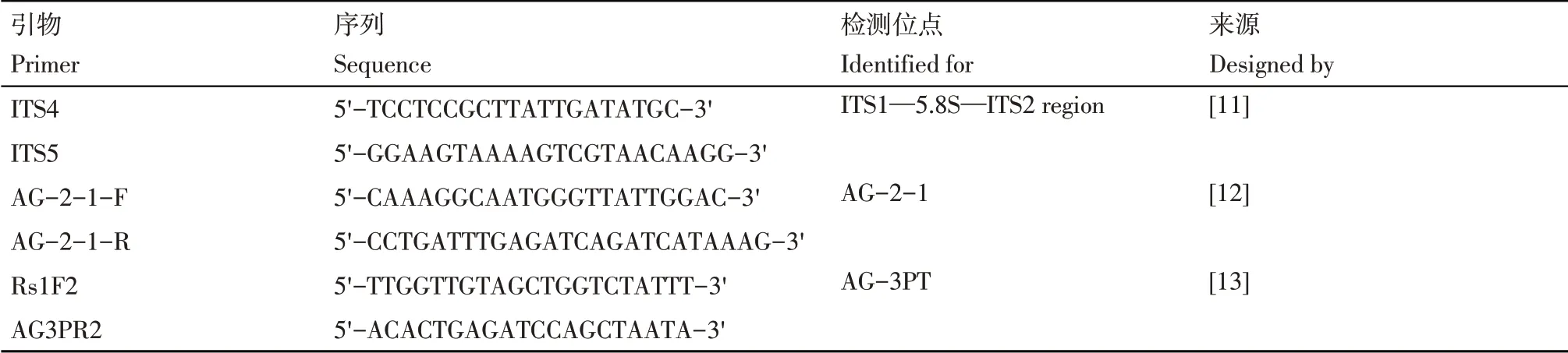
表1 融合群测定引物Table 1 Primers for detection of anastomosis group
2 结果与分析
2.1 马铃薯黑痣病菌样品采集及分离
2012~2021年在黑龙江省哈尔滨、齐齐哈尔、绥化、牡丹江、双鸭山、佳木斯、伊春、鹤岗、黑河和大兴安岭10个马铃薯主产区共采集分离了482份马铃薯黑痣病菌菌株样品,具体信息如表2所示。
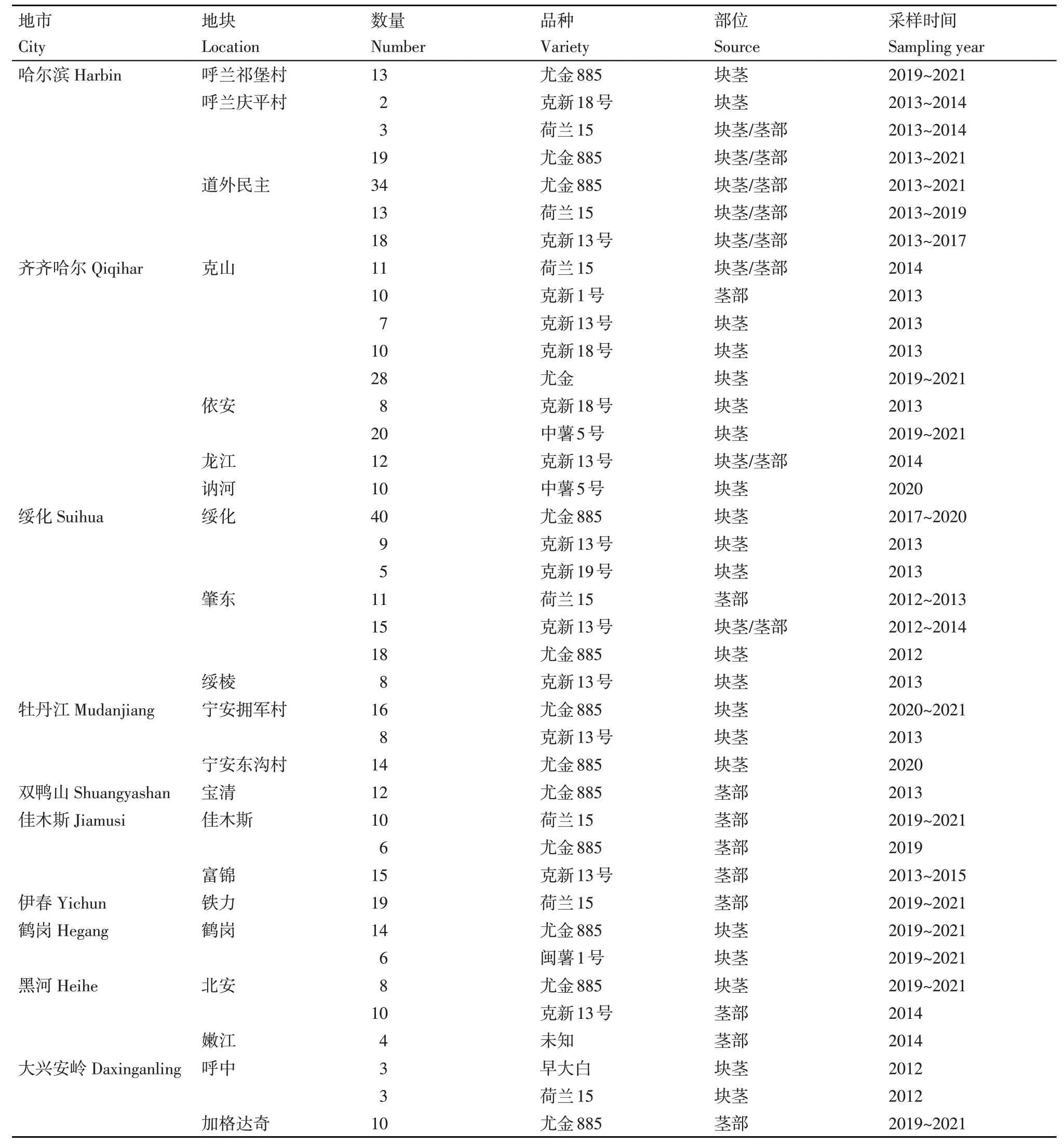
表2 2012~2021年黑龙江省黑痣病菌样品采集信息Table 2 Information of potato black scurf isolates collected from 2012 to 2021 in Heilongjiang Province
2.2 黑龙江省马铃薯主产区致病菌融合群类型鉴定
对采自黑龙江省10个主产区的482份致病立枯丝核菌样品完成分离纯化后,采用商业化基因组DNA提取试剂盒提取每个样品的总DNA,并进行纯度检测。微量分光光度计检测结果表明,所提DNA样品的OD260/OD280比值均介于1.8~2.0。电泳结果如图2所示,均为单一条带,可以用于后续试验。

图2 黑龙江省马铃薯黑痣病样品基因组DNA检测电泳图(部分样品)Figure 2 gDNA extracted from potato black scurf isolates in Heilongjiang Province(partial samples)
利用ITS区通用引物进行融合群鉴定,经PCR扩增后获得约700 bp的ITS1-5.8S-ITS2区域目的片段,部分样品电泳见图3。经BLAST序列比对后,482份菌株隶属5个融合群,其中,344个菌株属于AG-3,出现频率为71.37%;70个菌株属于AG-5,出现频率为14.52%;32个菌株属于AG-2,出现频率为6.64%;34个菌株属于AG-4,出现频率为7.05%;2个菌株属于AG-1,出现频率为0.42%;无其他融合群出现(表3)。其中,AG-2融合群中包括AG-2-1、AG-2-2IIIB和AG-2-2IV三个融合亚群,出现频率分别为50.00%、6.25%和43.75%;AG-4融合群中只鉴定到AG-4-HGI和AG-4-HGII两个融合亚群类型,出现频率分别为70.59%和29.41%,未有AG-4-HGIII出现(表4)。同时,AG-2-1和AG-3PT经特异性引物AG-2-1-F/R和Rs1F2/AG-3PR2进行辅助验证,PCR扩增分别可以获得480和474 bp阳性目的片段(图4)。
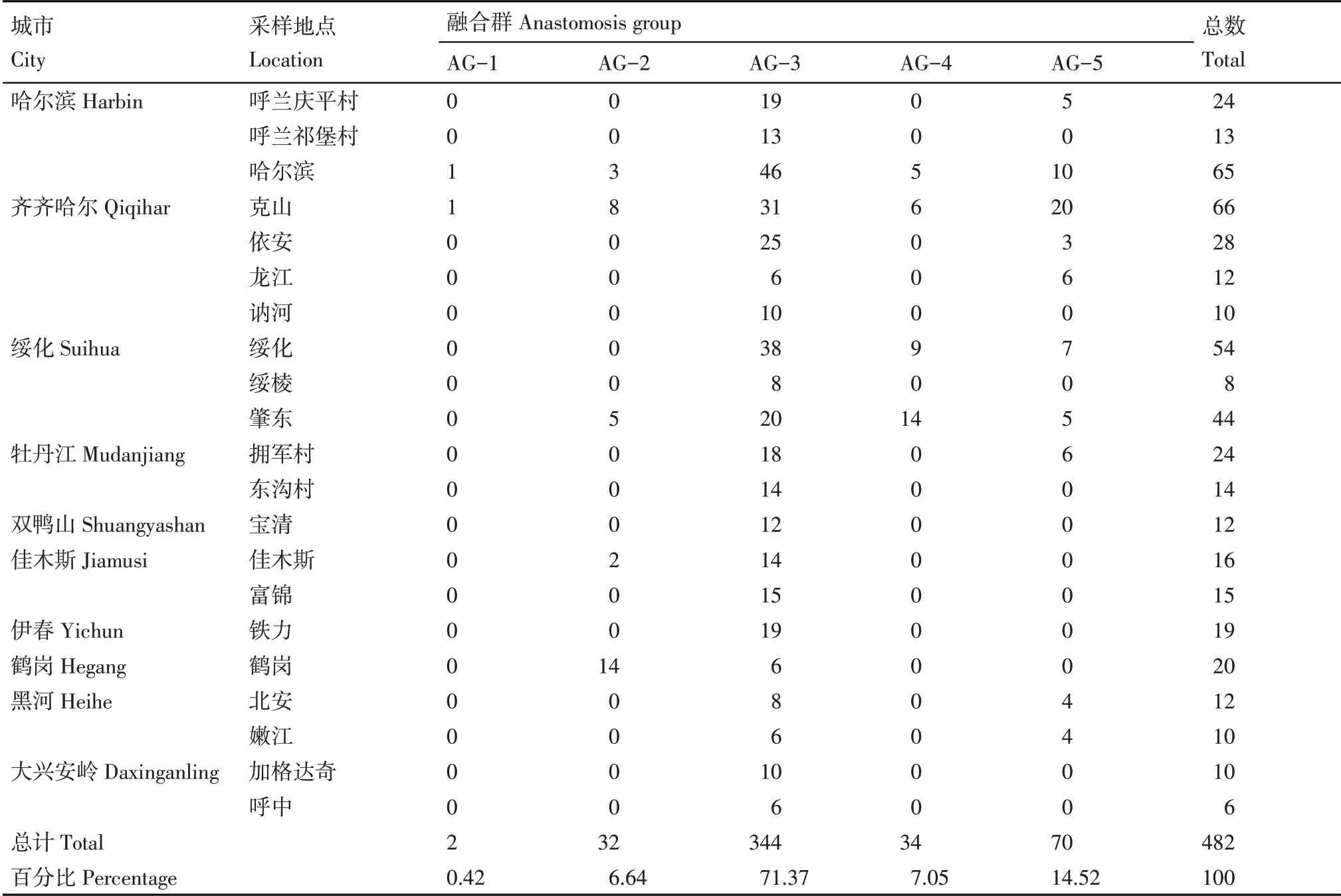
表3 黑龙江省马铃薯立枯丝核菌融合群类型及分布Table 3 Anastomosis group and distribution of R.solani isolates collected in Heilongjiang Province
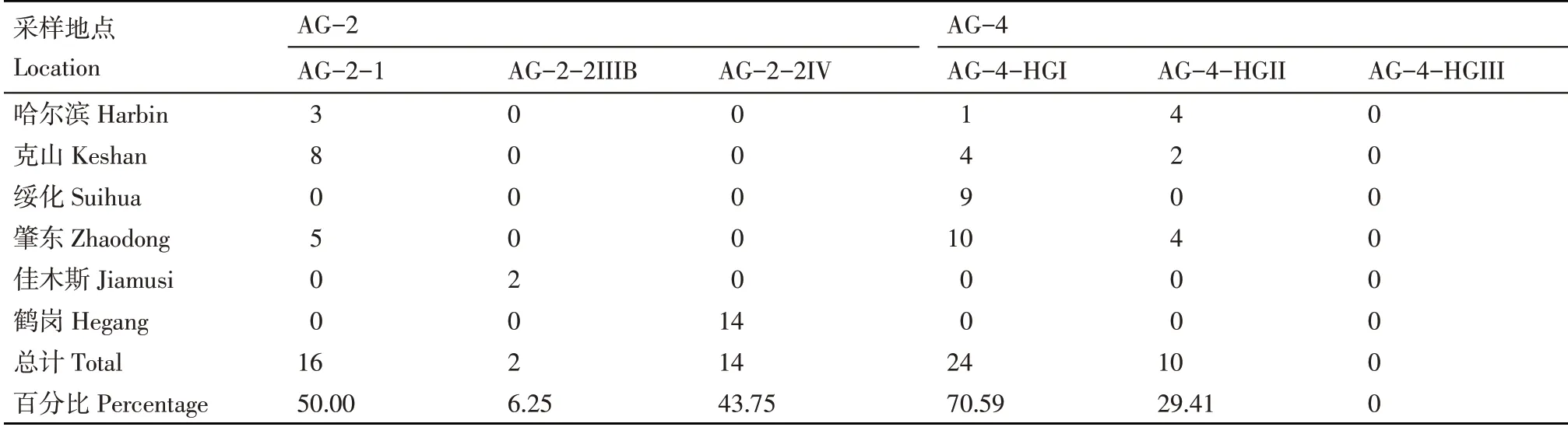
表4 马铃薯立枯丝核菌AG-2和AG-4融合亚群的鉴定及分布Table 4 Anastomosis subgroup and distribution of R.solani AG-2 and AG-4

图3 ITS引物扩增PCR产物凝胶电泳图(部分样品)Figure 3 Agarose gel electrophoresis of PCR products amplified by ITS primers(partial samples)

图4 AG-2-1和AG-3PT特异性引物检测电泳图Figure 4 Agarose gel electrophoresis of AG-2-1和AG-3PT amplified by specific primers
从黑龙江省马铃薯种植区域分布来看,在全省10个马铃薯主产区AG-3融合群均有发生,且所占比例均很高,因此,AG-3是马铃薯致病立枯丝核菌的优势融合群。从致病融合群的丰富度来看,哈尔滨、齐齐哈尔、绥化3个地区的融合群类型较为丰富,除了AG-3外,还有AG-1、AG-2、AG-4和AG-5多种融合群,说明黑龙江省西部地区的马铃薯黑痣病菌群体遗传多样性较为复杂。与之相对比,黑龙江省东部地区融合群类型相对单一,其中牡丹江和黑河地区均有少量AG-5融合群发生,佳木斯和鹤岗则偶有AG-2融合群出现,其他地区仅有AG-3融合群(图5)。
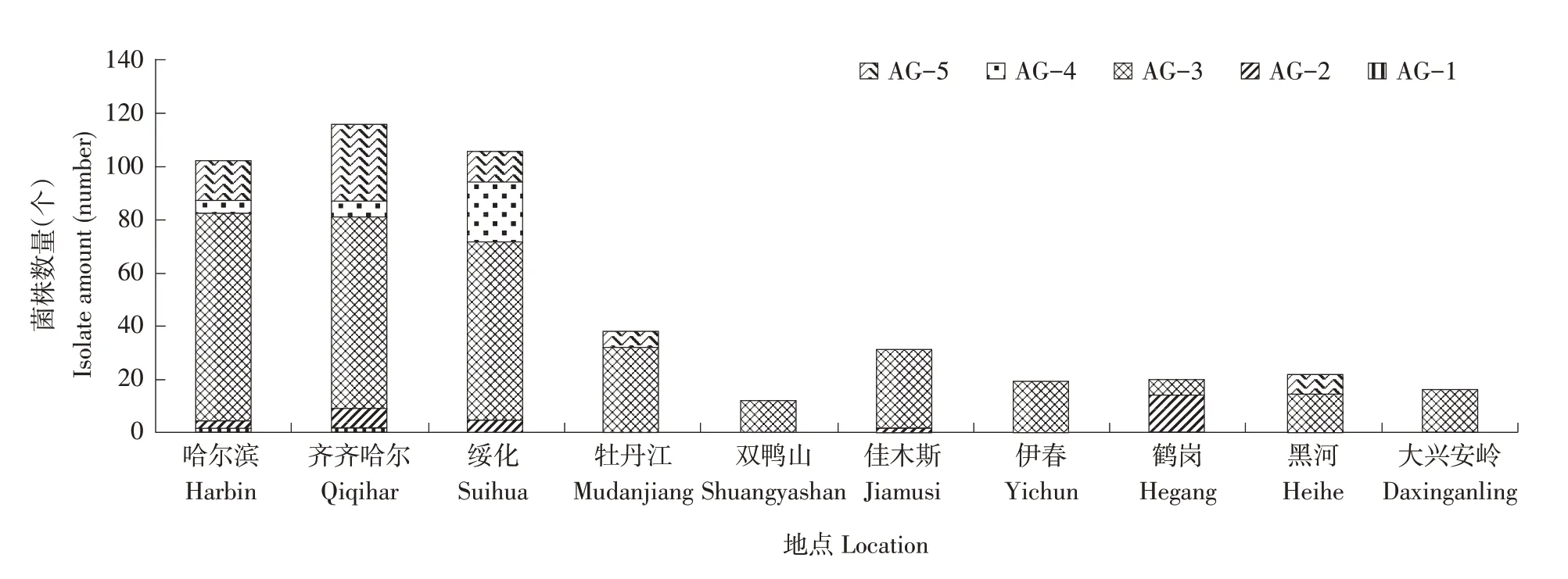
图5 黑龙江省马铃薯主产区黑痣病菌融合群类型组成及分布Figure 5 Type and distribution of anastomosis group of black scurf isolates collected in main potato growing regions of Heilongjiang Province
3 讨论
鉴于立枯丝核菌种内及种间遗传多样性丰富,因此该菌常被界定为一个遗传差异较大的复合种[17]。自1936年Schultz[3]首次提出立枯丝核菌菌丝融合群的概念后,由日本学者生越明[5]建立了得到国际公认的融合群鉴定方法。传统的菌丝融合群是将2个待测菌株进行对峙培养后,利用光学显微镜观察菌丝的生长和交叠现象。由于菌丝融合法只能划分不同融合群,但不能很好的反映其种内及种间的变异关系,因此随着分子生物学的发展,能够在分子水平上反映遗传变化的rDNA-ITS序列分析法,成为研究立枯丝核菌遗传多样性的重要手段。
马铃薯黑痣病是马铃薯生产上最具威胁的土传病害之一。国内外研究均表明AG-3融合群是引起马铃薯黑痣病的优势融合群类型[18]。黑龙江省作为中国东北部主要的种薯和商品薯生产基地,近年来马铃薯黑痣病的发生呈逐年增加且日趋严重的趋势,田间发病率在大发生年份可达70%以上。关于黑龙江省马铃薯黑痣病融合群的相关研究起步较晚,其中田晓燕等[19]、李晓妮等[20]虽然均有关于黑龙江省黑痣病菌融合群类型的报道,但由于样品数量和采集地点相对较少,因此并不能很好的反映出黑龙江省的病原特点。本研究系统梳理了10年来黑龙江省马铃薯黑痣病菌的融合群类型组成及分布情况,综合样品数量、出现频率以及地域分布情况,不仅充分说明了AG-3依然是黑龙江省马铃薯主产区优势致病融合群类型,也清晰的反映出AG-5融合群已经和AG-4融合群一样成为了危害黑龙江省马铃薯的次优势菌群。同时,本次调查还发现了AG-1-IB、AG-2-2IIIB、AG-2-2IV三个融合亚群,这也是分别在黑龙江省的首次发现。此外,在AG-4融合群中仅鉴定出AG-4-HGI和AG-4-HGII两个融合亚群,未获得AG-4-HGIII,这一结果与李晓妮等[20]的研究结果相一致,但Yang等[21]在黑龙江省39份样品中分离出AG-4-HGIII,说明黑龙江省马铃薯黑痣病菌融合群类型较为复杂,融合群的丰富度与样品的来源密切相关。牟明等[22]对黑龙江省马铃薯黑痣病融合群的鉴定中,发现了AG-1-IA、AG-1-IC、AG-6、AG-8四个融合群类型,也再次证明对不同区域马铃薯黑痣病菌融合群类型的监测十分必要。

